塩田清二,中町智哉,鈴木隆介,大滝博和(昭和大学医学部・第一解剖学)
坪川宏,岡田泰伸
虚血性神経細胞死は炎症性サイトカイン,グルタミン酸,アラキドン酸,接着分子,フリーラジカルや一酸 化窒素(NO)などの様々な因子が関与する。しかし,その詳細な機構については依然不明である。近年,細胞容積調節の異常がアポトーシス様細胞死誘導に先 立って出現し細胞容積調節の破綻を抑制すると細胞死誘導が抑制されることが報告された(Maeno et al 2000)。また,我々は,容積感受性クロライドチャネルを抑制することにより海馬の虚血性神経細胞死が抑制しうることも明らかにした。脳において,容積 感受性イオンチャネルおよび水チャネルは恒常性の維持に重要な働きをする。一方で水チャネルのひとつであるアクアポリン4はアストログリアに発現している ことが報告されており脳虚血時において,その過剰応答や応答の減少により,細胞死誘導に関与することが示唆されている。しかし細胞性浮腫の誘導に関してア ストログリアはまだ不明な点が多い。今回,我々は中大脳動脈閉塞による局所脳虚血モデルを用い,脳虚血後に生じるアストログリアの変化をGFAPの組織染 色によりを用い経時的に明らかにした。さらに,脳虚血性神経細胞死抑制作用が示されている,神経ペプチドPACAPのレセプターPAC1Rの特異的抗体を 用いてアストログリアにおけるPAC1Rの発現を検討した。
脳虚血前,大脳皮質においてGFAP陽性細胞は主に表層である分子層および血管周囲に認められる。脳虚 血後その発現は徐々に強くなる。さらに,1日後から脳梗塞周辺部に沿ってGFAP陽性細胞が強く認められはじめ,2から4日ではその発現量,アストログリ アの形態的な変化も生じる。PAC1Rは脳虚血前には主に神経細胞に認められるが脳梗塞部位は時間に従い弱くなる。一方,2日目以降には脳梗塞周辺部に存 在する活性化したアストログリアにおよび神経細胞における発現が強くなる。
これらの結果はアストログリアが脳虚血時にPAC1Rを介し神経細胞死抑制に働く可能性を示唆する。
富永真琴(自然科学研究機構・岡崎統合バイオサイエンスセンター)
赤塚結子(三重大学医学部・生理学第一講座)
清水貴浩,高橋信之,岡田泰伸
細胞外及び細胞内の浸透圧変化に対応して自らの容積を一定に保とうとする働きは,動物細胞が生命を維持 する上で必要不可欠な機能であるが,最近ではこの容積調節の破綻が細胞死につながることが明らかとなっており,細胞がいかに自らの容積をセンスし対応する かという点に注目が集まっている。細胞が一旦膨張した状態から元の体積に戻る調節性容積減少(regulatory volume decrease: RVD)の過程は,細胞内の蛋白質による情報伝達を介して,最終的には細胞内からのK+とCl-流出が駆動力となって細胞内の水が細胞外に流出することによって達成される。特にこの場合のCl-の通り道であるチャネルは細胞の容積上昇を感知して開口するために容積感受性Cl-チャネル(VSOR)と名づけられているが,最近では正常浸透圧下でアポトーシス誘導剤やH2O2に よってVSORが活性化されることによって,細胞の持続性収縮が起こることが明らかとなり,容積調節だけでなくアポトーシスにも深く関わっていることがわ かってきている。VSORの分子実体はいまだ不明であるが,VSOR及びVSORの制御因子はアポトーシスをコントロールするという観点からも重要な蛋白 質であり,これら蛋白質群の分子同定によって細胞の容積調節やアポトーシスのメカニズムについてさらに多くの情報が得られることが期待される。
現在までに報告者らは,VSORの調節蛋白質としてATP-binding cassette(ABC)蛋白質スーパーファミリーに属するABCF2を同定しているが,今回の共同研究によって,ABCF2がVSORの電流を抑制す ることと,ABCF2の発現によってRVDの遅延が起こることを明らかにしている。さらに,ABCF2がアクチン結合蛋白質であるアクチニン-4と結合す ることも見出しており,アクチン-アクチニン-4-ABCF2が相互作用し容積センサーとして働くことが明らかとなった。また,ABCF2結合蛋白質の探 索によってVSORの候補蛋白質を見出し,その機能解析を進めている。
河田照雄,井上和生,江川かおり,加藤壮太(京都大学大学院農学研究科)
高橋信之,岡田泰伸
脂肪細胞は「脂肪を貯める」ことが第一義的な生理機能である。そのために容積が約1~2万倍まで肥大化 し,可逆的に維持しうる。このような特性は他の細胞に類を見ない。このことは生体のエネルギー供給の保証ともなり,また動物が獲得した進化特性でもある。 しかしながら,飽食化した現代社会においては,生活習慣病を招来する主要因ともなっている。本研究では,脂肪細胞が,自身でその発達度合いをどのようにモ ニターして,その形態形成・容積維持・肥大化制御を行っているかを分子細胞生物学的に解明することを目的としている。
現在までに報告者らは,脂肪細胞が脂肪酸を初めとする様々な分子に細胞内カルシウムイオン濃度の上昇と いう応答を示すこと,またこのカルシウムイオンによる応答性が脂肪細胞の容積変化・肥大化と密接に関連しうることを明らかにしてきた。このことから脂肪細 胞は自身の細胞容積ならびに肥大化を,細胞内カルシウムイオン濃度変化をもたらす分子を介してモニターしている可能性が高いと考えられた。そこでまず,脂 肪滴を貯め込んだ脂肪細胞を用いたカルシウムイメージング系の起ち上げを試みた。カルシウムイオン指示薬としてFura2を,細胞内カルシウムイオン濃度 を変化させる刺激としてカルシウムイオノフォアであるイオノマイシンを用いて,分化した脂肪細胞の細胞内カルシウムイオン濃度変化を検出する実験系を確立 した。現在,この系を用いて,脂肪酸などのシグナル分子の細胞内カルシウムイオン濃度変化に対する作用を詳細に検討している。
またパッチクランプ法による,脂肪細胞の電気生理学的解析のための実験系も確立した。脂肪細胞は,細胞 質に脂肪滴を貯め込んでいるため,パッチクランプが困難であったが,今後は脂肪細胞に発現するチャネルの特性を正確に解析することが可能となった。浸透圧 変化による一時的な細胞容積変化に伴い活性化されるイオンチャネルが脂肪細胞に存在しているかなど,現在,検討中である。
宮崎裕明,新里直美,丸中良典(京都府立医科大学大学院・生理機能制御学)
サビロブ ラブシャン,清水貴浩,岡田泰伸
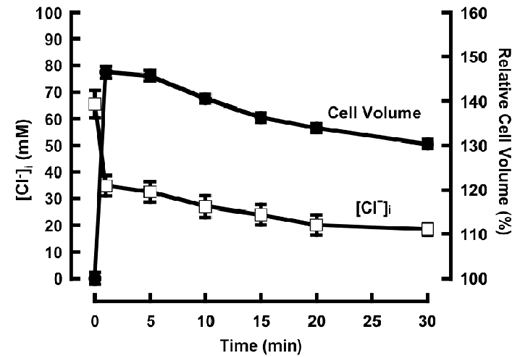
腎遠位尿細管上皮組織でのナトリウム再吸収は血圧調節や体液量維持にとって重要な機能であり,血漿浸透 圧によって厳密に制御されている。しかし,細胞がどのように細胞外浸透圧変化を感受するのかという疑問に対する明確な回答は得られていない。一般的に,低 浸透圧刺激により一過性の細胞容積膨張とそれに引き続く調節性容積減少(Regulatory Volume Decrease; RVD)という現象が観察されるが,RVDの生理的意義については明らかにされていない。我々は,低浸透圧刺激時により惹起されるRVD が,tyrosine phosphataseの活性化を制御し,腎遠位尿細管Na+再吸収に関与する上皮型ナトリウムチャネル(ENaC)の遺伝子発現を増大させることを報告した。一般的に,RVD惹起時には,細胞からのCl-のeffluxが活性化されることが知られており,それに伴った細胞内Cl-濃度([Cl-]i)変化が想定される。すなわち,RVDによって引き起こされた[Cl-]i変化が,低浸透圧刺激に対する細胞内シグナルとして機能する可能性が強く示唆される。しかしながら,従来の蛍光Cl- indicatorと蛍光顕微測光を用いた[Cl-]i測定法では,RVDのように細胞容積変化と[Cl-]i変化が同時に起こる場合,細胞内の蛍光Cl- indicator濃度変化により,継時的な[Cl-]i変化を計測することは非常に困難であった。
そこで本研究では,腎遠位尿細管上皮由来細胞であるA6細胞の容積変化と蛍光輝度をcell analyzer“Quanta”を用いて同時計測し,Cl- indicatorの蛍光輝度を細胞容積で補正することで,RVD時における[Cl-]iの測定を試みた。定常時(等浸透圧環境下)で約65 mMであった[Cl-]iは,低浸透圧刺激(50%低浸透圧)後の急激な細胞容積増大(定常時の約1.5倍)に伴い,約35 mMに減少した。その後,RVDが惹起され,徐々に細胞容積は減少し,30分後には定常時の約1.3倍にまで減少した。また,[Cl-]iもRVDに伴い減少し,30分後には約20 mMまで低下した(図参照)。以上のことから,A6細胞においては,低浸透圧刺激後のRVDによる[Cl-]iの変化が,細胞外浸透圧感受メカニズムの一つとして機能していることが示された。
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
関係論文
宮川 剛,大貫宏一郎(京都大学大学院 医学研究科)
八木 健,平林敬浩(生理学研究所 高次神経機構)
我々はこれまでカルシニューリンCNの前脳特異的ノックアウトマウスが統合失調症様の行動異常を示すこ とを見出し,さらに統合失調症患者のゲノムDNAを用いた相関解析によりCNが統合失調症の感受性遺伝子であることを明らかにしてきた。本研究はこの知見 に基づき,CN情報伝達経路に関与する分子をターゲットとしたコンディショナルノックアウトマウスを作製し,統合失調症発症のメカニズムを解明することを 目的とする。
本年度はターゲティングベクター作成に必要な材料(ネオマイシン耐性遺伝子,DTA遺伝子などのプラス ミドDNA,目的の遺伝子を含むBACクローンなど)を入手し,各断片を順次ベクターに挿入してコンストラクトを完成した。塩基配列に変異のないものを選 択し,ES細胞への相同組換え実験の検討を進めたが,残念ながらloxPの位置によって相同組換えが起こりにくくなる可能性があるという指摘を受け,現 在,ノックアウトベクターの短腕,長腕のそれぞれの長さの不足を補うようloxPの位置を変更したコンディショナルベクターを再構築しているところであ る。今後,ベクターが完成しだい,ES細胞への遺伝子組み換えを行う。今年度はこれと並行して,tTA-tetO systemとCre-loxP systemの両方を組み合わせることにより遺伝子発現部位・時期を調節するのに必要な各遺伝子改変マウスの系統を入手した。
濱田 俊(大阪大学生命機能研究科)
八木 健,平林敬浩,金子涼輔(生理学研究所 高次神経機構)
CNR/プロトカドヘリンファミリーは神経系で発現するプロトカドヘリン様分子群であり,特異な遺伝子 クラスター構造をとる。マウスの場合,遺伝子クラスター全体では50~60種類のプロトカドヘリン分子がコードされており,その蛋白質は軸索やシナプスな どに局在し,神経回路形成に重要な役割を果たしていると予想されているが,まだ実験的な検証はほとんど進んでいない。CNR/プロトカドヘリンファミリー は3つの異なるサブファミリーからなるが,本研究ではこのうちCNR (Pcdhα)の遺伝子改変マウスを作成し,その生体内機能を明らかにすることを目的としている。
本年度は,昨年度に引き続き,CNRの細胞内領域の大部分を占め,かつ全てのCNRが共通して利用する 3つの定常領域エクソン全てを欠損させたCNR遺伝子改変マウスの作成を行った。既に高次神経機構部門で作成済みの定常領域エクソン上流にlox-P配列 を挿入した遺伝子改変マウス(G1)と,本計画共同研究で作成した定常領域エクソン下流にlox-P配列を挿入した遺伝子改変マウス(CNRdA, CNRdB)およびCAGプロモータ制御下でCreリコンビナーゼを発現するトランスジェニックマウス(CAG-Cre:大阪大学宮崎純一教授より供与) との交配を行うことにより,CAG-Creトランスジーンを有し,CNR遺伝子座においてG1/CNRdA,G1/CNRdBの遺伝型をもつマウスを交配 により作成し,生体内でCNR遺伝子座における染色体間組換えを誘導した。この遺伝子改変マウスと野生型C57BL/6マウスとの交配を行い,F1におい て定常領域エクソンが欠損しているマウスをPCR法およびサザンブロット法により検索し,CNR遺伝子定常領域エクソン欠損マウスを得た。今後,このマウ スを用いてCNRの生体内における機能を解析する予定である。
福井裕行,堀尾修平(徳島大学大学院ヘルスバイオサイエンス研究部)
八木 健,平林敬浩(生理学研究所高次神経機構)
中枢においてヒスタミンH1受容体は,睡眠・覚醒,学習・記憶,食欲の制御などの機能に関与することが 指摘されている。また最近では,ストレス刺激時にヒスタミン神経系が活性化されること,環境の急激な変化への対応にヒスタミンH1受容体が関与しているこ となど,さらに新しい知見も加わりつつある。そこで本研究では,ヒスタミンH1受容体の中枢における機能をさらに詳しく解析するため,H1受容体に関する 遺伝子改変マウスを作製しその行動を解析することをめざしている。
本研究では遺伝子改変マウスとして,2つの異なる系統を作製することを考えている。1つは前年度から継 続しているもので,H1受容体を過剰発現させた遺伝子改変マウスの作製である。このためには,H1受容体の脱感作(ダウンレギュレーション)が全く生じな い変異をH1受容体遺伝子に生じさせた遺伝子改変マウスを作製する。この遺伝子改変マウスでは,H1受容体脱感作異常のため受容体発現レベルが増大し,ヒ スタミン応答が過剰になると考えられる。
もう1つは,イムノトキシンを用いて,H1受容体発現ニューロンのみを部位特異的に除去することにより,H1受容体発現ニューロンの機能を調べようとするものである。
第1の遺伝子改変マウスについては,前年度までにキメラマウスが得られたので,まずC57BL6マウス と交配することによりF1マウスを得た。サザンブロット及びPCR法により,ヘテロ遺伝子改変マウスが得られていることを確認した。その後さらに C57BL6マウスとバッククロスを重ね,現在F4マウスまで得られている。
第2の遺伝子改変マウスについては,H1受容体遺伝子部分をイムノトキシン用のカセット(ヒトIL- 2R発現カセット,福島県立医科大学小林和人博士より授受)に置換えたターゲティングベクターを作製し,ES細胞に導入,サザンブロット法により相同組換 え変異体を同定した。400個余りのコロニーを検定した結果,相同組換えをおこしたES細胞クローンが2個得られた。今後キメラマウスの作製をめざす予定 である。
【追加情報】(調査月2007年8月、記入月2008年6月)
関係論文
山下拓史,中村 毅,永野義人,松本昌泰(広島大学大学院脳神経内科)
高橋哲也(翠清会梶川病院神経内科)
八木 健,平林敬浩(生理学研究所 高次神経機構)
平林真澄(生理学研究所 脳機能分子解析室)
パーキンソン病(PD)の発症機序については遺伝性PDの原因遺伝子を中心に解析がすすめられているが いまだ解明に至っていない。PD剖検脳では黒質ドパミン神経の脱落と神経細胞内凝集体形成が特徴的であり,その形成過程の解明はPD病態解明に重要であ る。凝集体形成にはubuquitin-proteasome systemの異常が考えられており,それらの機能異常が凝集体形成に重要と考えられている。われわれはα-synuclein,synphilinを分 解する新規タンパク質としてE3 ubiquitin ligaseの一つであるSiahをyeast-two hybrid systemにより同定した。(Nagano,2003)凝集体の主要蛋白質にはα-synuclein,synphilin-1, ubiquitinなどが知られている。これまでα-synucleinタンパク質を過剰発現させる動物モデルやノックアウトマウスが複数の研究グループ から報告されており,PDモデルとして解析されているが忠実にPDにみられる凝集体,病理変化を再現したモデルは無い。Siah蛋白質をノックアウトし凝 集体形成への影響を検討するため,cre-loxp systemを用いたコンディショナルノックアウトマウスのターゲティング遺伝子の作成を継続している。コンストラクト作製にあたりベクターに組み込む insertをBAC cloneを用いてPCR法にて構築中であるが,その過程においてmutationを生じるなどの問題が生じ完成に至っていない。また,われわれは新たに 凝集体の主要構成タンパク質の一つでありSiahの基質であるsynphilin-1のトランスジェニックマウスの作製を試みている。 Synphilin-1のcDNAをMoPrP vectorにサブクローニングし,マウス卵に導入することで,トランスジェニックマウスの作製を行っている。現在までに解析した77匹の仔においてトラ ンスジーンを有するものを8匹得ている。今後これらマウスの系統を確立し,脳内タンパク質発現の確認,凝集体形成をはじめとする病理学的変化,行動解析を 行っていく予定である。
鈴木 敦詞,安田 啓子,小野 保長(藤田保健衛生大学・内分泌代謝内科)
平林 真澄,加藤めぐみ,金子涼輔(自然科学研究機構・生理学研究所)
細胞外基質石灰化の中核をなす基質小胞でのリン酸取り込みを担う細胞膜III型Na依存性リン酸輸送担 体Pit-1過剰発現ラットを共同研究にて作製した。Pit-1トランスジェニック(Tg)ラットは,骨格の成長には影響を認めないものの,長期間飼育す ることにより腎臓で糸球体障害を惹起し,低アルブミン血症に引き続き,骨軟化症へと進行することが観察された。その作用メカニズムとしては,出生後の組織 におけるリンの取込み増加が細胞障害を惹起し,自然発症ネフローゼ症候群のかたちとなること,またその結果として,ヒトでも認められるような低蛋白血症に 由来する骨軟化症が引き起こされることが示唆された。同時にこのPit-1/Tgラットは出生後約4週で白内障を自然発症することが認められ,出生後にリ ンの取込み増加により蛋白質の変性が惹起されることが示唆された。
今後はさらに骨格,血管,腎臓ならびに水晶体における組織学的検討を加え,疾患発生メカニズムの解明を目的として研究をすすめる予定である。
片上秀喜(宮崎大学医学部第3内科)
平林 真澄,加藤 めぐみ(生理学研究所脳機能分子解析室)
成長ホルモン(GH)の作用は肝臓で作られるソマトメジンC(IGF-1)を介するものとされている。血中IGF-I濃度非依存性のGHの各臓器への直接作用は明らかではない。遺伝性侏儒症ラット(dr)は本邦で発見されたGH単独完全欠損症のモデル動物で,天然に存在するGHノックアウトラットである。本研究では脂肪細胞・軟骨細胞の発生・分化と機能にあたえるGHの組織特異的影響を明らかにするため,自然界に存在するGH・IGF-Iノックアウトラットであるdrに 着目し,ヒトGH遺伝子を脂肪細胞や軟骨細胞などに特異的に発現させ,その生物作用を検討した。平成16年度に2つの遺伝子,ヒトleptin遺伝子とヒ トα1-collagen遺伝子のそれぞれ上流域数kbpをヒトゲノム情報に従い,特異的なオリゴprimerを設計し,PCRで増幅し,pGEMベク ターに組み込み,PCRクローニングを行った。うち,ヒトLeptin遺伝子上流域-3.6kbpとヒトGH遺伝子2.1kbpのキメラ遺伝子(Lep- hGH;7.6kbp)を調製した。遺伝性侏儒症ラットの未受精卵への顕微注入は技術的に困難で,かつ,遺伝子注入後の受精卵は対照SDラットのそれと比 較し,脆弱である。従来は遺伝性侏儒症ラットの生殖細胞系列に組み込むためには,Wild typeの対照SDラット受精卵への注入(Lep-hGH-SD),drとの交配(Lep-hGH-SD/dr)という間接的手法を採用していた。今回は drの受精卵に,キメラ遺伝子を注入し,効率よく,Lep-hGH-drを作出する方法,すなわち,凍結ラット精子とキメラ遺伝子混合物をラット未受精卵 子に顯微注入する方法(Mol. Reprod. Dev. 69: 153-158, 2004)を採用した。207個のdr未受精卵子にLep-hGHキメラ遺伝子とdr凍結精子混合液を顯微注入し,生存した195個をレシピエント雌に移 植したところ38匹の産仔が得られた。PCR解析の結果,3匹のLep-hGH-dr個体が得られた。今後,Lep-hGH-dr個体の解析を進めるとと もに,残るColl-hGH-drの作出を予定している。