細胞器官研究系
生体膜研究部門
【概要】
脳の興奮性シナプス伝達を司るAMPA型グルタミン酸受容体の動態や機能を制御する機構を以下の2点に着目して解明し,シナプス可塑性およびてんかんなどの脳神経疾患発症のメカニズムの理解を目指す。
(1) シナプス膜蛋白質ネットワークの同定と機能解析
シナプス膜蛋白質(受容体,イオンチャネル,接着分子など)は足場蛋白質,シグナル蛋白質などと複合体(ネットワーク)を形成して,その機能を遂行する。独自に開発した特異性の高い生化学的手法により,脳組織からシナプス蛋白質複合体を精製・同定する。同定したシナプス蛋白質ネットワークがシナプス伝達効率を制御する機構を分子細胞生理学的,遺伝学的手法を用いて統合的に明らかにする。
(2) パルミトイル化脂質修飾機構の全容解明
翻訳後脂質修飾であるパルミトイル化は,外界刺激に応答してシナプス蛋白質のシナプス膜局在を制御し,シナプス伝達効率や細胞内情報伝達を調節する。我々は独自に発見したパルミトイル化酵素群を手がかりとして,シナプス活動に応答したAMPA受容体の動態制御機構を明らかにする。以下に今年度行った研究課題とその内容の要約を記す。
てんかん関連リガンドLGI1の生理機能の解明
深田優子,岩永 剛,深田正紀
AMPA型グルタミン酸受容体は脳内の主要な興奮性シナプス伝達を司り,神経活動に応じてシナプス伝達効率を動的に制御している。最近,私どもはシナプス足場蛋白質PSD-95複合体として痙攣・てんかんと関連のあるAMPA受容体附属サブユニットStargazin,膜蛋白質ADAM22,および分泌蛋白質LGI1の3つを同定した。これまでに,私どもはLGI1がADAM22のリガンドとして機能し,AMPA受容体機能を促進することを報告した。LGI1の作用機構を明らかにするために,脳内LGI1複合体を精製,同定し,巨大な蛋白質複合体のネットワークを明らかにしつつある。さらに,LGI1以外のLGIファミリー(LGI2, -3, -4) およびADAM22ファミリー (ADAM22, -23, -11) の生理機能,および機能解析を進めている。今年度は各ファミリー同士の結合特異性,および機能相補性を明らかにした。
PSD-95パルミトイル化酵素によるシナプス機能制御
則竹 淳,深田優子,岩永 剛,松田尚人,深田正紀
今年度はPSD-95パルミトイル化酵素P-PAT(DHHC2, 3, 7, 15)の活性が神経活動により制御されているか,さらにP-PATが何らかのシナプス可塑性を制御しているかを検討した。海馬培養神経細胞の神経活動を低下させると,PSD-95のパルミトイル化レベルが大きく上昇し,シナプスにおけるPSD-95量が増加し,その結果,AMPA受容体がシナプス後部に集積してくることを見出した。この神経活動依存的なPSD-95のパルミトイル化はシナプスに移行してくるDHHC2によるものであり,ゴルジ体に限局するDHHC3によるものではないことを見出した。このようにDHHC2を介したPSD-95のパルミトイル化はAMPA受容体恒常性維持の表現型であるSynaptic scalingに必須であることが明らかになった。
Gaパルミトイル化酵素の同定と性状解析
堤 良平,深田優子,深田正紀
3量体G蛋白質a サブユニット(Ga)は分子スイッチとして細胞内情報伝達の要として機能する。Ga は古くからパルミトイル化を受けることが知られており,パルミトイル化が細胞膜への集積や機能の発揮に重要であることが示唆されてきたが,Ga パルミトイル化酵素は同定されていなかった。私どもはDHHC3およびDHHC7をGa パルミトイル化酵素として同定し,アゴニスト依存的な a1Aアドレナリン受容体・G aqを介した情報伝達系にDHHC3およびDHHC7が必須であることを見出した。さらに,photoconversion法やFRAP法を利用し,Gaqが常に細胞膜に静的に局在するのではなく,パルミトイル化依存的にゴルジ-細胞膜間をshuttlingしていることを見出した。現在,脱パルミトイル化酵素の脳組織からの精製,同定に取り組んでいる。
分泌蛋白質BDNF,およびLGI1の分泌機構の解明
松田尚人,深田優子,則竹 淳,深田正紀
Mu-ming Poo(カリフォルニア大学バークレー校 分子細胞生物学部)
神経栄養因子BDNFは神経分化や神経活動依存的なシナプス可塑性に重要な役割を果たしている。BDNFは合成後,デンスコア小胞として軸索,樹状突起の両方に輸送され,分泌される。しかし,BDNFの分泌機構については殆ど明らかになっていない。私どもは海馬培養神経細胞からのBDNFの分泌過程を全反射顕微鏡を用いることにより可視化することに成功した。興味深いことに,軸索,樹状突起からの分泌過程はそれぞれ神経活動により,異なる様式で制御されていることを明らかにした。同様の手法を用いててんかん関連分泌蛋白質LGI1の分泌制御機構の解明にも取り組んでいる。
神経細胞におけるパルミトイル化酵素ファミリーの制御機構の解明
奧慎一郎,堤 良平,岩永 剛,深田優子,深田正紀
パルミトイル化修飾は多くの機能蛋白質にみられる脂質修飾であり,外界刺激依存的に可逆的に代謝回転し,生体の恒常性や可塑性を精密に制御していると考えられている。最近,私どもはパルミトイル化脂質修飾酵素(23種類)をゲノムワイドに同定し,次々と新しい酵素-基質ペアを明らかにしている。しかし,パルミトイル化酵素群の活性制御メカニズムに関しては未だ殆ど不明である。最近,私どもは23種類の酵素群がいくつかのサブファミリーに分類されることを見出し,サブファミリー毎に異なる局在,制御を受けることを見出しつつある。そこで,DHHC蛋白質サブファミリー特異的な輸送・局在化メカニズムの解明を試みている。今年度はサブファミリー特異的な結合蛋白質を網羅的に生化学的に精製,同定した。今後,これら結合蛋白質の性状解析を通じて新規パルミトイル化酵素群のサブファミリー特異的な制御機構を明らかにする。
機能協関研究部門
【概要】
脳神経系など生体機能のもととなる細胞機能のすべては,細胞膜におけるチャネル(イオンチャネル,水チャネル)やトランスポータ(キャリア,ポンプ),バイオ分子センサーの働きによって担われ,支えられている。私達は容積調節や吸収・分泌機能や環境情報受容,網膜における光受容と視覚情報処理など最も一般的で基本的な細胞活動のメカニズムを,チャネル,トランスポータ,レセプター,センサー,メッセンジャーなどの機能分子の働きとして細胞生理学的に解明し,それらの異常と疾病や細胞死との関係についても明らかにしようとしている。主たる研究課題は次の通りである。
(1)「細胞容積調節の分子メカニズムとその生理学的役割」:細胞は(異常浸透圧環境下においても)その容積を正常に維持する能力を持ち,このメカニズムには各種チャネルやトランスポータやレセプターの働きが関与している。これらの容積調節性膜機能分子,特に外向整流性容積感受性クロライドチャネル(VSOR)やそのシグナルの分子同定を行い,その活性メカニズムと生理学的役割を解明する。
(2)「アポトーシス,ネクローシス及び虚血性細胞死の誘導メカニズム」:容積調節能の破綻は持続性の容積変化をもたらして細胞死を誘導する。多くの細胞のアポトーシス,ネクローシス,更には脳神経細胞や心筋細胞の虚血性細胞死の分子メカニズムを解明する。特に,イオンチャネルの関与とそのメカニズムを明らかにし,「細胞死の生理学」という分野を切り開く。
(3)「バイオ分子センサーチャネルの分子メカニズムの解明」:イオンチャネルはイオン輸送や電気信号発生のみならず,環境因子に対するバイオ分子センサーとしての機能を果たし,他のチャネルやトランスポータ制御にも関与する多機能性蛋白質である。特に,アニオンチャネルやATPチャネルやTRPカチオンチャネルの容積センサー機能,メカノセンサー機能およびストレスセンサー機能の分子メカニズムを解明する。
(4)「網膜における視覚情報処理のメカニズム解明」:網膜には,光感受性センサーなど様々な種類のバイオ分子センサーが発現し,初期の視覚の形成を担っている。とくに網膜神経節細胞での視覚情報の統合処理について,網膜組織培養法を活用したバイオ分子センサーの遺伝子操作および電気生理学的手法を用いて明らかとする。
プロトンチャネルとしてのTRPM7:その分子基盤
沼田朋大,岡田泰伸
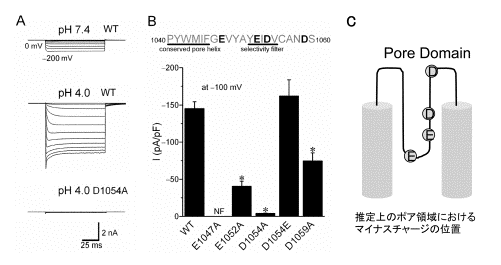
TRPM7は広範に発現する非選択性の陽イオンチャネルであり,細胞周期,細胞増殖,細胞死にかかわることが知られている。最近私達は,メカノセンサーとしても働き,細胞容積調節にも重要な役割を果たすことを明らかにした(Am J Physiol Cell Physiol 292: C460, 2007)。現在まで,TRPM7は1価カチオンおよび2価カチオンを透過させるチャネルであるという報告はあるがプロトンそのものの透過については,知られていない。本研究では,TRPM7を発現させたHEK293T細胞でプロトンの透過の有無を検討した結果,内向き整流性の比較的大きなプロトン電流がパッチクランプ法で観察された(図1A)。また,このプロトン電流に対する生理的濃度のCa2+とMg2+の影響から,pH5.5付近でプロトンは2価カチオンと同じ結合サイトを競合して透過することが分かった。そこで,TRPM7におけるプロトンの通り道と考えられるポア領域の負電荷アミノ酸を中性化する点変異 (E1047A, E1052A, D1054A, D1059A) を導入した結果,D1054Aでは,電流が大きく抑制され,E1052A, D1059Aでは,部分的に抑制された(図1B)。これらのことより,プロトンはTRPM7のポア領域における負電荷アミノ酸部位(図1C)を介して流入していることが明らかとなった。ところで,子宮頸部では,常にpH4からpH5付近に保たれているので,子宮頸部上皮由来のHeLa細胞を用いて実際にTRPM7の活性を確認した。この結果,発現系と同様のプロトン電流が観察され,siRNAを用いたノックダウンによってこれが大きく抑制された。これらの結果より,子宮頸部でTRPM7を介するプロトン流入が生理的条件においても機能している可能性が示唆された。さらに,TRPM7は心臓や脳でも発現が見られるので,酸性化がもたらされる虚血や炎症などの病的状況で機能している可能性も示唆された。この結果は次の論文に報告:J Biol Chem 283: 15097-15103, 2008.
| |
|
図1 |
TRPM7のプロトン電流とその分子基盤。(A) hTRPM7を発現したHEK293T細胞で記録したプロトン電流。(B)ポア領域の負電荷アミノ酸の中性化点変異によるプロトン電流の抑制。(C)TRPM7のS5-S6間の推定上のポア領域を示す模式図。 |
成熟心筋細胞ATP放出性マキシアニオンチャネルはT管開口部に局在する
DUTTA Amal K,SABIROV Ravshan Z,岡田泰伸
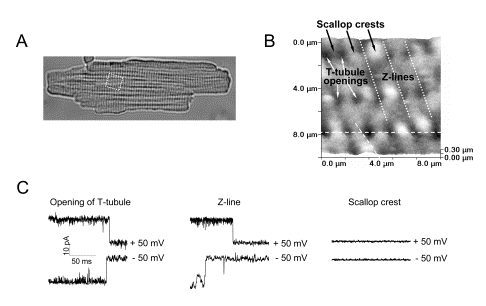
大型のポアを持つマキシアニオンチャネルは,細胞内から細胞外にATPを放出する通路を与える。新生仔ラット心筋細胞は虚血条件下でこのチャネルが活性化されて,ATPを放出することを既に私達は報告している。ところが成熟ラット心筋細胞は,同様に虚血性ATP放出を示すにもかかわらず,マキシアニオンチャネルを発現していないと報告されて来た。今回私達は,走査イオンコンダクタンス顕微鏡法による微細構造観察下においてパッチクランプ単一チャネル記録を行うという「スマートパッチ法」を適用し,マキシアニオンチャネルがT管開口部とその付近の乙帯線上という大変狭い領域にのみ局在することをはじめて明らかにした(図2)。これによって長年にわたる矛盾が解決し,成熟心筋細胞の虚血性ATP放出にもマキシアニオンチャネルが関与することが明らかとなった。この結果は次の論文に報告:Biophys J 94, 1646-1655, 2008.
|
|
図2 スマートパッチ法による成熟心筋細胞上のマキシアニオンチャネルの局在観察 |
アストロサイトからの虚血性・細胞腫脹性ATP放出は
Pマキシアニオンチャネルから行われる
LIU Hongtao,SABIROV Ravshan Z,岡田泰伸
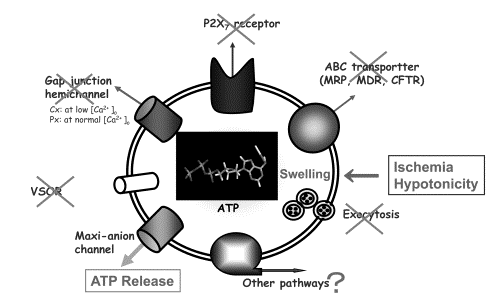
グリアからニューロンへのシグナル伝達物質(gliotransmitter) の1つであるATPは,種々の刺激によってアストロサイトから放出される。その放出路としては,エキソサイトーシス,アニオンチャネル,ABCトランスポータ(MDR, MRP, CFTR), P2X7レセプター,ギャップジャンクションヘミチャネル(コネキシンCx,パネキシンPx)などの種々のものが候補に挙がっていた。今回,マウスアストロサイトの虚血(酸素・グルコース除去)刺激や低浸透圧刺激による細胞腫脹時におけるATP放出の通路を調べた。このATP放出は,エキソサイトーシス,MDR1, MRP1, CFTR, Cx, Px, P2X7レセプター及び容積感受性外向整流性アニオンチャネル(VSOR)などの阻害剤には影響を受けないが,マキシアニオンチャネルの阻害剤(Gd3+やアラキドン酸)によって著しく抑制されることが判明した。また,アストロサイトのマキシアニオンチャネルは実際にATP透過に伴うATP4-電流を発生させることがわかった。それゆえ,このときの主たるATP放出路はマキシアニオンチャネルによって与えられることが明らかとなった(図3)。これらの結果は次の2つの論文で報告:Purinergic Signalling 4: 147-154, 2008; Cell Res 18: 558-565, 2008.
|
|
図3 アストロサイトの虚血/低浸透圧刺激によるATP放出の通路 |
Hypertonicity-Induced Cation Channel (HICC)の活性化は
アポトーシス死を救済し,その抑制はアポトーシス死を誘導する
沼田朋大,佐藤かお理,WEHNER Frank,岡田泰伸
アポトーシス誘導時には細胞縮小後の容積調節(Regulatory Volume Increase: RVI) が破綻していることを私達は以前示した (FEBS Lett 580: 6513, 2006)。RVIには細胞縮小時に活性化されるカチオンチャネル(HICC)が関与するので,アポトーシス時にはHICCが抑制されている可能性が考えられる。事実,今回,スタウロスポリン(STS)でHeLa細胞にアポトーシスを誘導した時にはHICCの抑制が見られることが判明した。逆に,事前に高浸透圧刺激を与えてHICCを活性化させておくと,その後のSTS投与によるアポトーシスの誘導は著しく抑制されることが明らかとなった。この結果は次の論文に報告:Apoptosis 13: 895-903, 2008.
細胞生理研究部門
【概要】
細胞は,それを取り巻く環境の大きな変化の中で,その環境情報を他のシグナルに変換し,細胞質・核や周囲の細胞に伝達することによって環境変化にダイナミックに対応しながら生存応答を行っている。細胞が存在する臓器・組織によって細胞が受け取る環境情報は異なり,従って細胞が持っている環境情報を受信する機能も異なる。それらセンサー蛋白質は環境の変化に応じてダイナミックに感受性や発現等を変化させてセンシング機構の変化からよりよい生存応答を導く機能を有している。これらのセルセンサー蛋白質は種々の化学的,物理的情報を受容し,センサー間の相互作用を行い,多くは最終的に核への情報統合を行う。これらの細胞環境情報センサーの分子システム連関を解明していくことは,個体適応の理解のための基本単位である「細胞の生存応答」を解明するうえで極めて重要である。この細胞外環境情報を感知するイオンチャネル型のセンサー蛋白質の構造機能解析,活性化制御機構の解析を通して細胞感覚の分子メカニズムの解明を目指している。特に,侵害刺激,温度刺激,機械刺激の受容機構についてTRPチャネルに焦点をあてて解析を進めている。
また,本能機能を司る視床下部ペプチド作動性神経に注目し,摂食行動や睡眠覚醒を制御する神経機構について明らかにする研究を行っている。
TRPA1チャネルの細胞内アルカリ化による活性化
藤田郁尚,内田邦敏,富永真琴
生体の細胞内外のpHは中性付近に保たれているが,病態において酸性化あるいはアルカリ化すると痛み感覚の発生をもたらす。TRPA1を強制発現させたHEK293細胞に細胞外アルカリ刺激(pH 8.5)やアンモニウムクロライドの投与によって細胞内Ca2+濃度の上昇がもたらされた。パッチクランプ法を用いて解析すると,細胞内アルカリ化,細胞外アルカリ化,アンモニウムクロライド投与によって外向き整流性を有し,ルテニウムレッドやカンファーで阻害されるTRPA1に特徴的な全細胞電流の活性化が観察された。Inside/outモードでの単一チャネル電流記録で,細胞内ドメインのアルカリ化によるTRPA1単一チャネルの開口増大が確認された。アンモニウムクロライドによる応答は後根神経節細胞でも観察され,アンモニウムクロライド投与による活動電位発生も確認された。アンモニウムクロライド応答はAITC感受性の細胞でしか観察されず,TRPA1欠損マウスの後根神経節細胞ではみとめられなかったことから,TRPA1を活性化しているものと考えられた。マウスの後肢足底にアンモニウムクロライドを投与することによって痛み関連行動が観察され,それがルテニウムレッドで抑制され,TRPA1欠損マウスではみとめられなかったことから,アンモニウムクロライドによるTRPA1活性化が痛み感覚を惹起しているものと推定された。
Off channelとしての酸感受性PKDチャネル複合体
稲田 仁,富永真琴
以前に報告した味細胞に発現して酸味受容に関わるTRPチャネルであるPKD2L1/PKD1L3複合体の活性化機構を解析した。PKD2L1/PKD1L3複合体を発現したHEK293細胞は,酸刺激の後にのみ細胞内Ca2+濃度の増加を示した。パッチクランプ法を用いて全細胞電流を解析すると,酸の投与時間を1-15秒に変えても,酸を除去した後に活性化電流が観察された。電流がみられた時に再び酸を投与すると速やかな電流の消失が観察された。この現象はoutside/outモードの単一チャネル電流記録でも同様であった。よって,PKD2L1/PKD1L3複合体の活性化には酸への曝露が必要であるが,チャネル開口には,酸の除去が欠かせないと結論した。従来のリガンド作動性チャネルをリガンド存在時にのみ開口するon channelととらえると,PKD2L1/PKD1L3複合体はoff channelとみなすことができる。このPKD2L1/PKD1L3複合体活性化は弱酸,強酸のどちらでも認められ,純粋にpHに依存しているものと考えられた。電流とpHの同時測定によって活性化pHの閾値を求めたところ,先ずpH2.5以下への酸刺激が必要だが,その後0.3のpH増加でチャネルが開口することが明らかになった。変異体を作成して解析することによって,PKD1L3の大きな細胞外ドメインが酸の感知に関わっていることが明らかになった。
ショウジョウバエpainlessは熱感受性チャネル
曽我部隆彰,門脇辰彦,富永真琴
painlessは強い熱刺激に対して抵抗性のあるショウジョウバエ変異体から単離された遺伝子のコードする蛋白質でTRPAサブファミリーに属するイオンチャネルである。TRPA1チャネルは種々の侵害刺激によって活性化するイオンチャネルである。PainlessをHEK293細胞に発現させて解析したところ,painlessがNa+の40倍以上のCa2+透過性を有する熱感受性チャネルであることが明らかとなった。その活性化温度閾値は約42.6度で,活性化温度閾値,活性化キネティクス等が細胞内Ca2+濃度によって変化した。活性化温度閾値は細胞内にCa2+が存在するときに低く,繰り返し熱刺激によっても低下した。パッチ膜だけの状態でもpainlessの単一チャネル電流は観察され,おそらく熱によって直接活性化しているものと考えられた。Painlessの熱活性化電流は,ruthenium redやcamphorによって抑制され,哺乳類のTRPA1と類似の化学物質感受性を示したが,AITCや冷刺激によっては活性化されなかった。加えて,painlessの熱活性化電流の細胞内Ca2+による制御に関わるアミノ酸を同定した。
表皮ケラチノサイトにおけるTRPV4の生理機能の解析
曽我部隆彰,福見-富永知子,富永真琴
温度感受性TRPチャネルのTRPV4, TRPV3は表皮ケラチノサイトに強く発現しているが,TRPV3がより主に表皮での温度感知に関わっていることを観察している。TRPV4の温度感知以外のケラチノサイトでの機能を明らかにする目的でケラチノサイトcDNAライブラリーを用いてTRPV4の細胞内ドメインと結合する蛋白質のスクリーニングを行い,興味深い結合蛋白質を得た。その結果,TRPV4がアドヘレンスジャンクションでコンプレックスを形成してケラチノサイトの細胞接着能を制御して,皮膚のバリアー機能に影響を及ぼしていることが明らかとなった。TRPV4欠損マウスの皮膚では,注入した色素がタイトジャンクションを越えて野生型マウスより速やかに移動すること,それを防ぐために角質層が肥厚していること,表皮からの水分漏出が有意に多いことが判明した。25度ではなく37度において細胞外にCa2+を投与してからの細胞内Ca2+の増加がTRPV4欠損マウスのケラチノサイトに比べて野生型マウスのケラチノサイトで有意に大きいことが分かった。表皮ケラチノサイトでは,細胞外Ca2+濃度の上昇に応じてTRPV4を通ってCa2+が流入し,細胞間接着能を高めているものと推定された。
オレキシン神経の電気生理学的解析
山中章弘,常松友美
オレキシンは視床下部の少数の神経(オレキシン神経)において産生される神経ペプチドであり,オレキシン神経は,脳のほとんどの領域に軸索を投射している。オレキシン遺伝子欠損マウスの解析から,オレキシンが睡眠覚醒調節に重要な役割を担っていることが明らかになってきた。すなわち,オレキシン神経への入出力系を明らかにすることによって,未だによく分かっていない睡眠覚醒調節に関わる神経回路網の解明が期待された。そこで,オレキシン神経特異的に緑色蛍光タンパク質を発現する遺伝子改変マウスを作成し,スライスパッチクランプによって,入力する神経とその神経伝達物質に対する応答について解析を行った。まず,神経ペプチドを中心に解析を行ったところ,オレキシン神経が神経ペプチドバソプレシンによって活性化されることを明らかにした。また,行動薬理学的解析により,この神経回路が絶水などの生命危機に陥った時に,新たな水源を探索するために重要であることが示唆された。
光活性化タンパク質を用いたオレキシン神経活動の光制御
常松友美,山中章弘
近年,光によって神経活動の制御を可能にする分子であるチャネルロドプシン2(ChR2)やハロロドプシン(Halo) が報告された。摂食行動や睡眠覚醒などの本能機能は,個体でのみ生じる生理現象のため,それらを調節する神経機構の解明には,個体を用いた解析が欠かせない。そこで,睡眠覚醒調節に重要な視床下部のオレキシン神経特異的に光活性化タンパク質を発現させた遺伝子改変マウスを作成し,インビボにおいてその活動の制御を行い,その結果表出する行動を解析することによって,睡眠覚醒を調節する神経機構の解明を試みている。既にオレキシン神経特異的にHaloを発現する遺伝子改変マウスを作成しており,組織化学的手法を用いて特異的発現を確認している。また,スライスパッチクランプなどのインビトロ解析によって,オレンジ光照射が約15mVの過分極を誘導できることと,また,それに伴い自発発火を完全に抑制できることを確認した。このマウスを用いると意識下行動中のマウスにおいて,オレキシン神経活動を任意のタイミングで抑制することが可能となるため,個体を用いた睡眠覚醒調節に関わる神経機構の解明に大きく前進した。