1.酸感受性イオンチャネルを介したバゾプレッシンニューロンの
興奮性調節機構の解明
大淵豊明,上田陽一(産業医科大学医学部第1生理学)
佐藤かお理,岡田泰伸
バゾプレシン(arginine vasopressin: AVP)は体液恒常性を維持するため重要なホルモンである。視床下部に局在するAVPニューロンの活動性は,液性因子およびシナプス入力によって調節されている。プロトン(H+)を含有するシナプス小胞の拡散はニューロンに断続的な酸刺激を与えていると考えられる。酸感受性イオンチャネル(Acid-sensing ion channels: ASICs)は細胞外H+により活性化されるアミロライド感受性非電位依存性Na+チャネルである。AVPニューロンの酸感受性は知られていなかった。
我々は,雄性幼若AVP-eGFPトランスジェニックラットの視索上核(supraoptic nucleus: SON)を含む脳組織を単離・培養後,AVP-eGFP発現ニューロンを同定し,ホールセルパッチクランプ法によりAVPニューロンの酸感受性を調べた。pHを瞬時に低下させた場合,pH依存性に一過性のアミロライド感受性内向きNa+電流と脱分極,活動電位が観察された。Multi-cell RT-PCR法,免疫組織化学的染色法により,AVPニューロンにASIC1a+ASIC2a heteromerが発現していることが示唆された。
近年,浸透圧負荷がSONにおいて局所的な低酸素を惹起するとの報告がなされた。局所的な虚血および低酸素は乳酸(La-)の濃度を上昇させる。La-はCa2+キレートによるASICs電流の増強作用を有している。これらを考慮し,浸透圧ストレスにより惹起されるSONの低酸素が局所的なLa-濃度上昇を誘導し,ASICs電流が修飾されるのではないかと考えた。
AVPニューロンにおける酸刺激による電流は細胞外Ca2+濃度を低下させることで増強され,La-存在下でこの反応性増加が再現された。さらに,in vivo において2%食塩水飲水負荷したラットのSON組織中のLa-が増加し,in vitro においてSONを含むスライス組織を低酸素状態に暴露することでLa-放出増加反応が再現された。
以上より局所的な低酸素状態により増加したLaが内因性Ca2+キレーターとして作用することで,ASICsを介したAVPニューロンの興奮性を調節している可能性を見出した。
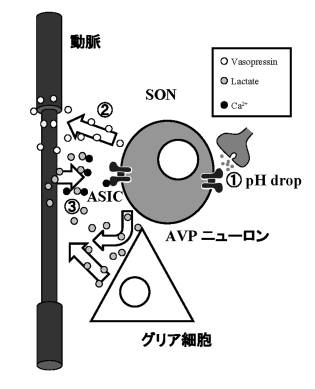 図1:①H+を含有するシナプス小胞の拡散により,ニューロンはpH dropに暴露される。②SONで分泌されたAVPが血管収縮作用により視床下部の局所的虚血を誘発する。③低酸素に反応した血管内皮細胞やグリア細胞,ニューロンからLa-が放出される。増加したLa-がCa2+キレーターとして作用することで,ASICsを介したAVPニューロンの興奮性を調節している。 |
2.白色脂肪細胞における容積センサーアニオンチャネルの
インスリン抵抗性発症への関与の検討
城田(井上)華,小西真人(東京医科大学細胞生理学講座)
岡田泰伸
容積センサーアニオンチャネルは細胞膨張によって活性化されるイオンチャネルであるが,TNFa刺激などによって生成される活性酸素によっても活性化される。TNFaは脂肪細胞においてインスリン抵抗性を引き起こすことが知られているため,本研究では脂肪細胞における容積センサーアニオンチャネルの活性とインスリン抵抗性の関連について検討を行った。
正常マウス(C57BL/6およびKKマウス)およびインスリン抵抗性を発症するインスリン依存性糖尿病モデルマウス(KKAyマウス)より白色脂肪細胞を単離し,ホールセルパッチクランプ法を用いて,低浸透圧刺激によって活性化される容積センサーアニオンチャネル電流を記録した。正常マウスおよび糖尿病マウスの脂肪細胞は,どちらも容積センサーアニオンチャネルを発現していることが明らかとなった。しかしながら,電流密度すなわち機能的発現レベルを比較すると,糖尿病マウスで有意に低いことが明らかとなった。また,容積センサーアニオンチャネルは細胞膨張後の細胞容積調節を担うが,糖尿病マウスの脂肪細胞では,この容積調節能が正常マウス脂肪細胞に較べて低かった。次に,TNFaによる容積センサーアニオンチャネルの活性化について検討した。正常マウス脂肪細胞および糖尿病マウス脂肪細胞のどちらにおいても,TNFaは容積センサーアニオンチャネルの活性化を引き起こさなかった。また,過酸化水素によって活性酸素を発生させた場合にも容積センサーアニオンチャネルの活性化は見られなかった。
インスリン依存性糖尿病マウスに,pan-PPARgアゴニストであるbezafibrateを投与し糖尿病を改善したときの容積センサーアニオンチャネルの機能的発現について検討を行った。5週間のbezafibrate投与により,血糖値および血中インスリン濃度の改善,脂肪細胞の肥大化の抑制が認められ,容積センサーアニオンチャネルの発現レベルも回復した。
以上の結果から,白色脂肪細胞において,糖尿病では容積センサーアニオンチャネルの活性が低下し容積調節能も傷害されており,それはTNFaや活性酸素の容積センサーアニオンチャネルへの直接的な効果とは関連していないと考えられた。本研究成果は,American Journal of Physiology-Cell Physiology(Inoue et al., 2010, 298:C900)に報告した。
3.細胞容積センサーとして働く分子群の同定及び機能解析
赤塚結子(鈴鹿医療科学大学薬学部)
岡田泰伸
細胞外及び細胞内の浸透圧変化に対応して自らの容積を一定に保とうとする働きは,動物細胞が生命を維持する上で必要不可欠な機能であるが,最近ではこの容積調節の破綻が細胞死につながることが明らかとなっており,細胞がいかに自らの容積をセンスし対応するかという点に注目が集まっている。細胞が一旦膨張した状態から元の容積に戻る調節性容積減少(regulatory volume decrease: RVD)の過程は,細胞の容積上昇を感知して開口する容積感受性Cl-チャネル(VSOR)の機能が必要不可欠であるが,このチャネル分子の実体が不明であるため,RVDのメカニズムはわからない点も多い。
報告者は,本共同研究によってVSORの負の調節蛋白質としてATP-binding cassette(ABC)蛋白質スーパーファミリーに属するABCF2を同定し,さらにABCF2がアクチン結合蛋白質であるアクチニン-4と結合することを見出しているが,細胞膜画分に存在するアクチニン-4とABCF2の親和性は低浸透圧刺激によって約8倍に高まることがわり,低浸透圧刺激後に両者の結合能力が高まることによってABCF2がVSORに結合することを抑制し,RVDが促進されると考えられた。
またABCF2の点突然変異体であるG232Dのアクチニン-4への結合能について,G232D発現細胞のミクロゾーム画分を界面活性剤可溶,不溶に分けて検討した結果,両者においてG232Dは野生型よりも高いアクチニン-4結合力を持つことがわかり,G232D大量発現細胞では野生型ABCF2大量発現細胞よりもABCF2によるVSORの抑制がはずれ易いことが考えられた。これに一致してG232D発現細胞ではmock細胞よりは弱いものの野生型ABCF2発現細胞よりは大きいVSOR電流が観察され,RVDのブロックも野生型ABCF2発現細胞よりは弱かった。一方,別の点突然変異体であるG520Dは界面活性剤可溶画分においてのみアクチニン-4への結合力が野生型よりも高かったので,G520D発現細胞ではVSOR電流やRVDがG232D細胞よりも抑制されると予想されたが,結果はVSOR電流もRVDのスピードもmock細胞と変わらなかった。このことから,G520DはVSORを抑制しない点突然変異体である可能性が示唆された。
4.TRPM7と容積感受性クロライドチャネルの機能的相互作用と
その分子同定
沼田朋大,森 泰生(京都大学工学研究科)
佐藤かお理,岡田泰伸
細胞は,たとえ異常な浸透圧条件下においても,自らの細胞容積を調節することにより生命活動を維持している。低浸透圧暴露による細胞膨張後の細胞容積調節過程,すなわち調節性容積減少(Regulatory Volume Decrease: RVD)の過程,には細胞容積増大をセンスして開口するTRPM7(Transient Receptor Potential Melastatin 7)および容積感受性Cl-チャネル(VSOR)が大きな役割を担っている。TRPM7およびVSORは細胞容積調節のみならず細胞増殖や細胞周期および細胞死に関わるなど多くの両チャネルに共通した生理機能を持つ。このことから両チャネルには機能連関があると考え,分子実体の既知であるTRPM7の機能制御を行うことによりVSORの機能変化を観察し,分子実体に迫った。
現在までTRPM7とVSORに強い機能連関があることを阻害剤,siRNAおよびノックアウト細胞を用いることにより確認している。本研究では,VSOR活性におけるTRPM7の重要な部位及びその制御因子を同定し,それら分子群の相互作用メカニズムを解明することを目指した。
今回我々は,TRPM7がVSOR活性にどのように関与するのかより強い証拠を得るために野生型DT40細胞,そのTRPM7欠損細胞,TRPM7欠損細胞にTRPM7を遺伝子導入した細胞に加えて,TRPM7欠損細胞にTRPM7イオン透過阻害ポア変異体,TRPM7酵素活性部位変異体,TRPM7C末端欠損変異体を遺伝子導入した細胞を作出した。それぞれのTRPM7変異体細胞を用い,VSORの機能評価を行った。その結果,パッチクランプ法を適用することにより,低浸透圧刺激によりVSORチャネル電流を見出した細胞は,野生型DT40細胞,TRPM7発現細胞に加え,TRPM7イオン透過阻害ポア変異体,TRPM7酵素活性部位変異体発現誘導細胞であった。一方でTRPM7C末端欠損変異体発現細胞においては,TRPM7欠損細胞と同様にVSOR活性が大きく抑制されていた。またこの結果は,パッチクランプ法にてTRPM7活性の機能評価した結果およびコールターカウンター法によりRVD率を評価した結果ともよい相関が見られた。以上のことより,TRPM7そのものがVSOR活性に重要であり,細胞膜でVSOR活性を支えるためのプラットホームのような役割を果たしていることが示唆された。
5.シナプス後膜におけるグルタミン酸受容体のトラフィック制御機構
柚﨑通介(慶應義塾大学医学部)
記憶・学習を支えるシナプス可塑性の実体は,神経活動に基づくシナプス後膜におけるAMPA型グルタミン酸受容体の数の増減であることが,近年明らかとなってきた。本研究では,これまでの予備的実験結果を踏まえ,神経活動がどのようなバイオ分子によりセンスされ,どのようにしてAMPA受容体の数の制御に変換されて長期記憶を担うのかを明らかにすることを目指している。
小脳平行線維―プルキンエ細胞シナプスにおける,長期抑圧(LTD)は運動学習の基礎過程と考えられている。シナプス前部を構成する平行線維が分泌するCbln1と,シナプス後部を構成するd2型グルタミン酸受容体(GluD2)は,ともに平行線維シナプスにおけるLTDとともにシナプス形成を制御することが分かっている。しかしCbln1やGluD2がどのようにこれらの経路を制御するのかは明らかでなかった。平成21年度には,Cbln1とGluD2によるシナプス形成制御機構を中心に研究を進めた。最近培養細胞を用いた研究により,Cbln1はシナプス前部を誘導するのみでなく,シナプス後部においてGluD2の集積とともに,GluD2の細胞内ドメインを介してシナプス後部分子の集積も引きおこすことが分かってきた。そこで,実際にin vivo においてもCbln1の有無によってGluD2のシナプス集積度合いが異なるかどうかをSDS-FRL法によって定量したところ,Cbln1欠損マウスにおいてはシナプス後部における表面GluD2の集積が有意に低下していることが明らかになった(Science, 2010)。また,Cbln1欠損マウスやGluD2欠損マウスでは,定常状態においてAMPA受容体の数が増加していた(論文準備中)。すなわち,シナプス前部から分泌されるCbln1が,シナプス後部においてGluD2の集積化とシグナル伝達系を駆動することによりAMPA受容体のエンドサイトーシスを制御している可能性を示唆している。神経活動によってどのようにCbln1―GluD2シグナリングが制御されるのかを,引き続き電気生理学・分子生物学,そして生理学研究所脳形態解析研究部門におけるSDS-FRL法による解析によってさらに解明していく予定である。
6.中枢性摂食調節におけるPRIP - GABAシグナリングの役割解明研究
平田雅人,兼松 隆(九州大学大学院歯学研究院口腔細胞工学)
(現:広島大学 大学院医歯薬学総合研究科 歯科薬理学)
鍋倉淳一(生理学研究所生体恒常機能発達機構研究部門)
【目的】PRIPとは,我々が見出した新規イノシトール三リン酸結合性タンパク質である。これまでの本共同研究において,PRIP分子がGABAA受容体の細胞内輸送を制御する分子であることを明らかにしてきた。その過程で,PRIPノックアウトマウスを作製し,その表現型解析を行った。その中で,このマウスは,過食であるという興味ある表現型を示すことに気がついた。一方,同マウスは,インスリンの開口放出機構の調節にも関係しており,過食であるという表現型は,インスリン分泌量が増加した結果であるという事も考えられた。
しかしながら,視床下部の摂食中枢がGABAシグナリングによって制御されている(Tong Q, et al., Nat Neurosci. 2008)ことが明らかとなったため,我々がこれまでに明らかにしてきたPRIPとGABAA受容体シグナリングとの関係からも,PRIPノックアウトマウスの過食という表現型の原因を明らかに出来ないかと考え,本研究を行った。
【実験内容】PRIP KOマウスと野生型の摂食行動やエネルギー代謝変化の違いを明らかにするために,経時的な摂餌量変化と体重変化,呼吸代謝量,日内体温変化,自発運動量などを行動学的な解析を行って検討した。次に,中枢におけるGABA抑制神経系の制御がPRIP KOマウスの摂食行動にどのような影響を与えるかを明らかにするために,第3脳室内にGABAのアゴニストやアンタゴニスト,ジアゼパムなどのGABA受容体関連薬物を投与して摂食行動(摂餌量等)の変化を解析した。
【結果】PRIP KOマウス(雄)の摂餌量は,野生型の摂餌量に比べて有意に増加していたが,体重は野生型に比べてむしろ低体重で推移した。呼吸代謝(酸素消費量と二酸化炭素排出量)は,野生型に比べて有意に亢進しており,体温も高値で推移した。自発運動量は,PRIP KOマウスで夜間特有なパターンを示したが,総運動量は野生型とあまり変わらなかった。昼間は,両者の運動量やそのパターンに明らかな差異が認められた。脳室内への薬物投与では,現時点で違いがあることが示唆出来ており,今後さらに詳しく検討して行く。
7.神経回路の発達・再編におけるバイオCl-モデュレータとしての
GABA/タウリンの役割
福田敦夫(浜松医科大学 医学部 生理学第一講座)
【タウリンによるKCC2蛋白機能抑制の検討】
胎齢15日でKCC2を子宮内電気穿孔法で遺伝子導入して24時間生存させた後に胎仔脳を摘出し,3日間Neurobasal mediumで分散培養したところ,異所性KCC2発現胎仔皮質板細胞では,インビボ(胎齢18日)とは違い[Cl-]iが低下していた。ついで,タウリン(3mM)を加えて分散培養した場合の,異所性KCC2発現培養細胞の[Cl-]iは非発現細胞と同程度であり,タウリンがKCC2機能を抑制していた。GABAA受容体阻害剤とグリシン受容体阻害剤を同時に加えて培養しても,タウリンのKCC2機能抑制に変化はなかった。ところが,タウリントランスポータ阻害剤を加えて培養すると,異所性KCC2発現培養細胞の[Cl-]iは非発現細胞に比べて有意に低下した。すなわち,タウリンは細胞内に取り込まれてKCC2蛋白機能を抑制することが明らかとなった。
【タウリン誘発電流ノイズとCa2+振動の相関の解析】
トニックGABA電流は,タウリンに富むサブプレート領域で,タウリンがほとんどない脳室帯/脳室下帯に比べて有意に大きく,タウリンによるGABAA受容体の持続刺激が示唆された。Ca2+イメージングを行い,皮質板細胞の自発性Ca2+振動の頻度に対してGABAは増加,タウリンは上昇と減少を惹起した。すなわち,ノイズ応答の異なるGABAとタウリンに対して自発的Ca2+振動の頻度も異なる応答を示すことを見出した。Ca2+振動と膜電位振動の関連性を解析するために,自発的なCa2+振動を起こしている細胞に対して,Amphotericin B穿孔パッチクランプ法を適用したところ,Ca2+振動に伴う脱分極性の膜電位の変化が認められた。しかし,この手法で同時記録できた細胞は10回の試行で1回と非常に効率が悪く,実験手技自体の改良が必要であると考えられた。
【KCC2蛋白機能抑制因子の検討(液性因子の検討)】
培養液中に17b-estradiol, progesterone,タウリンを加えて培養し,パッチクランプで異所性KCC2発現細胞のGABA逆転電位を測定し[Cl-]i変化を検討した。タウリンのみ,GABA逆転電位を脱分極側にシフトさせたので,KCC2蛋白機能を抑制したと考えられた。
【異所性KCC2蛋白の発達的機能変化とオリゴマー化の関係】
強制発現させたKCC2のオリゴマー化の阻害が原因で機能発現しない可能性を検討するため,sulfhydryl還元剤を含まないdetergentを用いて異所性発現させたKCC2のWestern blottingを行った。異所性KCC2のバンドは抗Flag抗体(1:1000)を用いて同定し,タウリンの有無での異所性KCC2のモノマー/オリゴマー比を比較してオリゴマー化の差を解析したが,有意な差は認めなかった。以上から,細胞内タウリンの異所性KCC2蛋白機能抑制作用にはオリゴマー化の障害は関係していないと結論した。
8.慢性疼痛による一次体性感覚野の活動変化とその機序の解明
野田百美(九州大学大学院薬学研究院)
慢性疼痛の多くの研究は脊髄において行われてきたが,痛み情報処理の中枢の一つである一次体性感覚野(S1)の研究はあまりなく,慢性疼痛時にS1で個々の細胞がどのような活動変化をしているか,また,その役割についてはわからなかった。そこで,本研究では2光子顕微鏡を用いたイメージング法と行動薬理学的手法を組み合わせて,慢性疼痛におけるS1の役割を明らかにした。炎症惹起物質である完全フロイントアジュバントをマウス後肢足底に投与し,慢性疼痛モデルを作成し,2光子顕微鏡を用いたin vivoカルシウムイメージングを行った。抑制性神経細胞のみが蛍光蛋白質Venusで標識されたVGAT-Venusマウスを用いることで,2/3層の興奮性神経細胞と抑制性神経細胞を識別した。その結果,慢性疼痛では,興奮性も抑制性も正常群に比べて,感覚刺激誘発カルシウム応答を示す細胞数,反応率,カルシウム応答の振幅,が増大していた。さらに,4層を電気刺激して誘発した2/3層の興奮性,抑制性細胞のカルシウム応答について,正常群に比べて慢性疼痛群において前述のパラメーターが増大していた。さらに,S1の2/3層神経活動をCNQXで抑制すると,痛み行動の減弱が認められた。これらの結果から,慢性疼痛時にはS1の2/3層において興奮性神経細胞と抑制性神経細胞の可塑的変化がS1内で起きており,おそらく抑制性細胞による抑制効果が十分でないため,興奮性細胞の過剰な活動が抑えきれず,慢性疼痛時の過剰な痛みが生じていることが予想される。今回の計画共同研究により,従来の手法では難しかった大脳皮質神経細胞活動の単一細胞レベルで観察することが2光子顕微鏡を用いることにより成功した。これにより,S1の慢性疼痛時の異常を詳細に捉えることができ,その意義も明らかにできた。この成果は現在投稿準備中である。
9.多光子顕微鏡を用いた嗅覚障害とその回復時における
ニューロンのターンオーバーの可視化解析
鍋倉淳一(生理学研究所 生体恒常機能発達機構研究部門)
澤本和延,金子奈穂子,加藤康子,澤田雅人
(名古屋市立大学大学院医学研究科再生医学分野)
成体哺乳類の脳室下帯(SVZ)では成体でも神経幹細胞が存在し,生涯にわたってニューロンを新生している。新生ニューロンが嗅覚の一次中枢である嗅球へと移動し,成熟して神経回路網に組み込まれる一方で,古い嗅球ニューロンは細胞死を起こしており,嗅球ニューロンは常に入れ替わっている。これまでの研究で,嗅球に供給された新生ニューロンの生存には嗅覚入力が重要であることが示されているが,生きた動物で同一ニューロンを長時間追跡することが困難であることから,嗅覚入力が嗅球ニューロンのターンオーバーに影響を与えるかどうかは分かっていない。近年,二光子顕微鏡を用いたin vivoイメージング法が発展し,生きた動物で蛍光標識された脳表層の神経構造を繰り返し観察することが可能になってきた。実際に,嗅球ニューロンの一種である傍糸球細胞は嗅球表層に位置するため,二光子顕微鏡を用いて同一細胞を長期間追跡することで,そのターンオーバーを観察出来ることが報告されている。
そこで,生理学研究所生体恒常機能発達機構研究部門及び名古屋市立大学大学院医学研究科再生医学分野の共同研究により,入力障害及び回復過程での嗅球ニューロンのターンオーバーの変化を,多光子励起法を用いて同一個体で経時的かつ詳細に解析し,嗅覚障害とその回復におけるニューロン新生の役割を解明することを目的とした。現在までに,傍糸球細胞の殆どが蛍光標識される遺伝子改変マウス(VGAT-Venusマウス及びGAD67- EGFPマウス)を用いて,2ヶ月以上の同一個体での嗅球生体観察法を確立し,嗅覚入力依存的に傍糸球細胞が入れ替わることを観察した。さらに,傍糸球細胞のサブタイプの1つであるTyrosine hydroxylase(TH)陽性細胞が激しく入れ替わっていることを,この細胞種が選択的に蛍光標識されるマウス(TH-GFPマウス)を用いて明らかにした。現在は,傍糸球細胞が入れ替わる時の時空間的特徴を把握すべく,二光子レーザーで狙った傍糸球細胞を焼灼した後,同じ場所に新生細胞が加わるか,さらにこの入れ替わりが入力に依存して制御されているかを解析中である。
10.多光子励起顕微鏡を用いた骨リモデリングのインビボ光イメージング
今村健志,井上靖道,羽生亜紀(財団法人癌研究会癌研究所)
鍋倉淳一(生理学研究所)
破骨細胞と骨芽細胞のカップリングが骨のリモデリングを制御する重要な機構であることが提唱されているが,その本体は明らかにされていない。本研究では,多光子励起顕微鏡を用いてインビボで骨芽細胞と破骨細胞の機能をイメージングする実験系を構築し,骨リモデリングのインビボ解析をおこない,破骨細胞と骨芽細胞のカップリングの分子メカニズムを明らかにすることを目的として研究を進めた。
まず,活性型骨芽細胞はI型コラーゲンを産生するので,I型コラーゲンのプロモーターの下流でCreが発現するトランスジェニックマウスとCreによって発光蛋白質と蛍光蛋白質が発現するトランスジェニックマウスを作製し,両者を掛け合わせて,活性型骨芽細胞を発光と蛍光で観察できる系を立ち上げた。このマウスの頭蓋骨に破骨細胞誘導因子RANKLを注射すると局所で骨吸収がおこるが,この時に活性型骨芽細胞を発光イメージングでトレースすると,RANKL投与後約2週で活性型骨芽細胞が激減し,その後投与後約4週をピークにその数が増加し,投与後約6週で元に戻ることわかった。
次に,活性型破骨細胞はカテプシンKを産生するので,カテプシンKのプロモーターの下流で蛍光蛋白質が発現するトランスジェニックマウスを準備し,Creによって発光蛋白質と蛍光蛋白質が発現するトランスジェニックマウスと掛け合わせをおこなった。
さらに,骨髄内に蛍光蛋白質を発現する細胞を移植し,2光子励起顕微鏡を用いてインビボで細胞を観察することを試みた。ところが,予想以上に骨髄内イメージングが困難で,2光子励起顕微鏡を用いても150umの深さまでしか観察できないことがわかった(共焦点レーザー顕微鏡で100um)。今後の課題として、モデル系の最適化,蛍光蛋白の選択,補償光学系の応用などが明らかになった。
一方,蛍光試薬を使った骨代謝関連細胞のイメージングにもトライし,インビボで骨細胞を可視化することに成功した。
11.視床下部の摂食調節にかかわる生体分子センサーについての
機能形態学的研究
塩田清二,影山晴秋,柴加奈子(昭和大学医学部第一解剖学教室)
竹ノ谷文子(星薬科大学薬学部体育学研究室)
箕越靖彦(自然科学研究機構生理学研究所)
視床下部には末梢からの摂食調節シグナルやエネルギー代謝調節にかかわる情報を感受するセンサーが存在している。主にニューロンがそのセンサーとしての機能を担っている。ガラニン様ペプチド(GALP)は摂食調節とエネルギー代謝にかかわるペプチドである。視床下部弓状核に存在するGALP含有ニューロンは他の摂食調節ペプチド含有ニューロンとニューロンネットワークを形成し,摂食調節を行っている。しかしGALPは血中にも存在していることから,末梢神経系あるいは末梢臓器にも作用している可能性がある。そこでGALPの末梢神経に及ぼす影響を検討した。麻酔下でラットの下大静脈にカテーテルを留置し,GALPを静脈内投与した。交感神経副腎枝,交感神経腎臓肢,迷走神経腹腔枝,迷走神経胃枝,迷走神経肝臓枝を分離し,中枢側より遠心性神経活動を,末梢側より迷走神経の求心性神経活動を記録した。さらに迷走神経胃枝および腹腔枝切断したときの交感神経副腎枝の遠心性神経活動も記録した。その結果,GALPの静脈内投与により,遠心性の交感神経腎臓枝と交感神経副腎枝の神経活動が促進した。一方,GALPは迷走神経胃枝の遠心性神経活動を抑制した。両側の迷走神経胃枝かつ腹腔枝の除神経はGALPによる交感神経副腎枝の遠心性神経活動に影響を及ぼさなかった。GALPは迷走神経胃枝と迷走神経肝臓枝の求心性神経活動を抑制したが,迷走神経腹腔枝の神経活動には影響を及ぼさなかった。
さらにGALPを脳室内投与した時,末梢臓器を支配している交感神経の活性をノルアドレナリンの代謝回転によって調べた。GALPを投与した後,組織を摘出してホモジナイズし,HPLCにてノルアドレナリンを検出した。GALP投与により骨格筋(ヒラメ筋,赤筋,白筋,腓腹筋そして長指伸筋),肝臓,褐色脂肪組織と心臓でノルアドレナリン代謝回転が増強していることが示された。また肺,膵臓や胃に関してはノルアドレナリンの代謝回転には影響を与えなかった。GALP脳室内投与は心拍数の上昇および褐色細胞での熱産生上昇は交感神経の活性化の上昇が関与していると考えられる。
したがって末梢血中のGALPは求心性の迷走神経を介して中枢神経系へ情報を送り,視床下部機能を修飾し自律神経の出力調節に関与している機構の存在が示唆された。
12.RCAN2遺伝子のノックアウトマウスを用いた機能解析
加納安彦,溝口博之(名古屋大学環境医学研究所)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
RCAN2はもともと甲状腺ホルモン(T3)応答性遺伝子としてクローニングした(文献1)が,その後の研究でタンパク質脱リン酸化酵素であるカルシニューリン(CaN)の活性を阻害・調節する機能を持つことが明らかとなった(文献2)。CaNは脳の発達や機能にきわめて重要な役割を果たすと考えられ,CaNを前脳特異的にノックアウトしたマウスが統合失調症に類似した精神症状を示し(文献3),逆に過剰発現させたマウスでは学習・記憶機能が障害される(文献4)。一方,統合失調症患者の死後脳でRCAN2遺伝子の発現が増加していた(文献5)。RCAN2タンパクは同様の機能を持つRCANファミリータンパク(RCAN1~3)の中で脳に最も強く発現し(文献6)ていた。
私たちはRCAN2の機能を明らかにする目的で,RCAN2ノックアウト(KO)マウスと過剰発現するトランスジェニックマウス(TGマウス)を作製した。これらRCAN2遺伝子改変マウスはともに正常に出生し,野生型と比べて大きな奇形は認めない。これまでの研究より,KOマウスでは野生型に比べてCaN活性が増加しRCAN2がin vivoでもCaN活性の抑制作用を持つこと,TGマウスは活動性が亢進しCaN KOマウスと酷似した表現型を示すことが明らかとなっている。すなわち,RCAN2によるCaN活性抑制が正常な精神機能を発揮するために必須であることが強く示唆された。
そこで,CaN/RCAN2の精神機能への関与を検討する目的で,系統的な行動解析を計画した。
2009年度は戻し交配によりほぼネジェニック系統を確立できたものの,系統的な行動解析に必要な動物数を確保できなかったため,一部を用いてKOマウスの自発行動性を評価した。7日間の行動量を測定した結果,KOマウスと野生型マウス,ヘテロ型マウスの行動量には優位な差は認められなかった。しかし,新規環境(測定のための新しいケージ)へ移動した直後にKOマウスの行動量が減少しており,今後オープンフィールド試験や新規環境探索試験を実施する予定である。
【文献】
1. Miyazaki et al. J. Biol. Chem. 1996
2. Davies et al. FASEB J. 2007
3. Miyakawa et al. Proc. Natl. Acad. Sci. USA, 2003
4. Mansuy et al. Cell, 1998
5. Hakak et al, Proc. Natl. Acad. Sci. USA, 2001
6. Mizuno et al. Eur. J. Endocrinol. 2004
13.グルタミン酸欠失変異型アミロイド前駆体蛋白遺伝子の
ノックインマウスを用いた機能解析
森 啓,藤田有紀(大阪市立大学大学院医学研究科脳神経科学)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
アルツハイマー病(AD)に特徴的な脳病変であるアミロイド老人斑が原因と考えるアミロイド仮説は,ワクチン療法により老人斑を消失させても臨床症状が改善されないことから見直しが議論されている。近年,老人斑を形成するアミロイド線維ではなく,非線維状体であるアミロイドオリゴマーを病因とするオリゴマー化説が提唱されているが,なお不明な点が多い。
我々は,早期発症型家族性AD家系に,新規の遺伝変異型アミロイドタンパク質を同定した。この変異は,アミロイド蛋白の22番目のグルタミン酸を欠失する異常があり,その結果,アミロイド線維を形成せずに,オリゴマー形成が促進される。この遺伝変異の病理作用を明らかにすることで,ADの病因解明をすることを研究目的としている。
まず同変異を発現するノックインマウスを作成し,コントロール,変異アレルをヘテロ状態にあるヘテロマウス,ホモ状態にあるホモマウスの週齢七ヶ月齢の三群を,各々約20匹準備した。
実施した行動生理学調査項目は,①General Health and Neurological Screening,②Wire hang test,③Grip strength test,④Light/Dark transition test,⑤Open field test,⑥Elevated plus maze test,⑦Hot plate test,⑧Social interaction test in a novel environment,⑨Rota-rod test,⑩Social interaction test : Crawley version,⑪Porsolt forced swimming test,⑫Gait analysis,⑬Barnes maze test,⑭T-maze test,⑮Radial maze testである。
その結果,コントロール群,ヘテロ群,ホモ群の三者間で有意な統計差を認められなかった。
ヒトとマウスでは5, 10, 13番目のアミノ酸が異なることから,ヒト特有のアミノ酸残基が病因分子種形成に重要な役割を担っている可能性が示唆された。
14.神経内分泌細胞から同定された新規ペプチドの機能解析
中里雅光,十枝内厚次(宮崎大学 医学部)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
【研究目的】国立循環器病センター研究所の南野らは,神経内分泌細胞に発現するVGF蛋白から合成される2つのペプチド(neuroendocrine regulatory peptide(NERP)-1とNERP-2)を同定した。NERP-1とNERP-2の前駆蛋白であるVGFの欠損マウスは痩せを呈するという表現型を有することから,NERP-1とNERP-2のエネルギー代謝調節機能について解析した。さらにVGF蛋白のように,前駆蛋白変換酵素の標的部位を複数有するグラニンファミリーから新たな生理活性ペプチドを同定し,その機能解析を行い,生理的役割を明らかにする。
【研究方法】我々は,NERP-1とNERP-2を脳室内投与し,摂食量を測定した。その結果,NERP-2にのみ摂食亢進作用が認められたことから,以下NERP-2におけるエネルギー代謝調節機能について解析した。ラット視床下部におけるNERP-2の分布を,免疫組織学的に検討した。NERP-2を脳室内に投与し,行動量,体温,酸素摂取量を測定した。オレキシン受容体遮断薬とオレキシンIgGを用いて,摂食調節系の中和もしくは遮断時のNERP-2による摂食亢進作用を検討した。オレキシン欠損マウスに,NERP-2を脳室内投与し,摂食および行動量を測定した。単離視床下部にNERP-2を投与し,オレキシン分泌を測定した。
【結果および考察】NERP-2のラット脳室内投与は,用量依存性に摂食を亢進した。また抗NERP-2 IgG脳室内投与により,概日摂餌量を有意に抑制したことから,NERP-2は内因性に摂食亢進に機能するペプチドであると考えられる。NERP-2は視床下部外側野に強く発現し,摂食亢進と覚醒に機能するオレキシンの産生ニューロンと完全に一致した。NERP-2の摂食亢進作用は,オレキシン系を遮断すると消失した。NERP-2の摂食亢進作用は,オレキシン系を介していると考えられる。ラットの単離視床下部培養系にNERP-2を投与した結果,培養上精中のオレキシン濃度が増大した。NERP-2の脳室内投与は,体温,酸素摂取量,行動量を増大させた。これらは,オレキシン投与によって生じる作用と同様であった。NERP-2の中和抗体を投与されたラットおよびオレキシン欠損マウスでは,これらの作用が消失する。以上のことから,NERP-2は,オレキシン分泌亢進を介して,オレキシンの持つ様々な生理作用を調節していると考えられる。
【今後の検討課題】NERP-1とNERP-2の標的蛋白の同定,NERP-1とNERP-2の下流シグナル分子の同定と作用機序を詳細に検討中である。また新規のグラニンファミリー蛋白由来のペプチドを同定中であり,候補ペプチドの精製と抗体作製に取りかかっている。組織分布や内在性の検討の後,生理機能解析を実施する予定である。
15.新規神経ペプチドQRFP欠損マウスの行動解析
岡本紀太郎,櫻井 武(金沢大学大学院医学研究科)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
我々のグループはGPR103AおよびGPR103Bの内因性リガンドとして新規神経ペプチドQRFPを同定した。QRFPは視床下部より発現し,受容体は大脳辺縁系や線条体に発現している。QRFPの脳内投与により摂食量の行進,交感神経系の活性化,常同行動の亢進などが観察されるが,このペプチドの正確な生理的役割は不明である。そこでQRFPノックアウトマウスの系統的な行動解析を行うことにより,QRFPが関与する病態の解明や治療への展開を図ることが今研究の目的である。現在QRFPノックアウトマウスのC57B6/Jへの8世代バッククロスマウスの作成がおわり,欠損マウス20匹,および同胞野生型20匹を用いて,運動機能,不安・恐怖反応,生理学的機能,学習・記憶機能,社会行動につき系統的な網羅的行動テストバッテリーをを行う予定をしている。使用機材としては,明暗選択箱テスト装置,オープンフィールド装置,高架式十字迷路,社会交互作用テスト装置,プレパルス抑制装置,強制水泳テスト装置,テールサスペンションテスト装置,恐怖実験付けテスト装置,バーンズ迷路,T字型迷路,8方向放射状迷路などである。以上の解析により,当ノックアウトマウスの表現系から,QRFPの生理的役割,かかわる精神疾患を探る予定である。
16.Cdk5活性化サブユニットp39ノックアウトマウスの行動様式解析
久永眞市,小林弘侑(首都大学東京 理工学研究科)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
遺伝子ターゲティング法は,遺伝子の機能を探る上で中心的な位置を占める方法であるが,遺伝子改変マウスを用いて,学習,記憶,注意,情動性,薬物感受性に関して詳細に調べられているケースは少なく,遺伝子の高次脳機能における未知の役割を見落としている場合が多いと推測される。我々は,行動テストバッテリーを用いて,遺伝子改変マウスの行動を体系的かつ効率的にスクリーニングする方法を確立し,これまで各種の遺伝子改変マウスについて新規の表現型を見出してきた。これにより見出した表現型を起点として,Cdk5の高次脳機能における役割を明らかにする。
Cdk5は活性化サブユニットp35またはp39を活性化に必要とする。Cdk5はシナプスの興奮性を制御していると考えられる。Cdk5ターゲティングマウスは周産期致死である。P35ターゲティングマウスは、生存可能であるが,脳の構造が変化し,行動テストバッテリーにおいてその影響を排除できない。P39ターゲティングマウスでは顕著な表現系が現れない。しかし,行動テストバッテリーを応用すれば,p39即ちCdk5の高次脳機能における役割を明らかにすることができると考えた。しかし,行動テストバッテリーを行うに十分な数のマウスが用意できず,実際の実験は行えなかった。しかし,行動様式解析室を訪問し,行動テストバッテリーを見学し,今後の研究の準備とした。
17.エピゲノム変異原性発達障害モデルマウスの行動解析
鹿川哲史,山口雄平,田賀哲也(東京医科歯科大学 難治疾患研究所)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
ヒストン修飾はダイナミックなクロマチン構造変化をもたらす主要なエピゲノム修飾機構であり,DNAメチル化と密接に連携して遺伝子発現を調節している。DNAメチル化異常に伴うエピゲノム修飾機構の破綻はヒト発達障害の一つであるRett症候群の発症要因となることから,正常なヒストン修飾制御は特に脳機能の発達や維持に必要であることが予想されていた。本研究では,遺伝子組換えマウスの手法を応用して,ヒストン脱メチル化酵素の機能の低下が多動性症状や知的障害などヒト精神運動異常様行動を誘導することを報告する。
我々が研究に用いたヒストン脱メチル化酵素遺伝子変異homozygousマウスの脳構造は形態学的には正常に思われたが,産仔の養育障害とてんかん様症状が多数見られたことから,社会行動の基盤となる脳機能の発達障害が示唆された。そこで,表現型を詳細に調べるため網羅的行動テストバッテリーを行った。変異マウスには著明な活動量や常同行動の増加,注意力の低下,不安様行動の減少,pre-pulse inhibitionの障害及び歩行機能の異常が観察された。さらに運動学習,空間学習記憶,参照学習記憶,作業記憶などの知的障害,固執性の上昇,サーカディアンリズムの障害が検出された。
近年,ヒト自閉症スペクトラム障害患者を対象とした連鎖解析および疾患関連分析から,本ヒストン脱メチル化酵素遺伝子座近傍に自閉症スペクトラム障害の責任遺伝子の存在が示唆された。我々が解析した変異マウスの表現型が,社会的行動の障害,興味の限局,反復的で常同的な行動といったヒト自閉症スペクトラム障害の中核症状と一致し,多動性や注意力の低下,及びてんかん様症状,活動周期の異常など多くの患者が併発する症状を示したことから,ヒストンメチル化修飾の異常が自閉症スペクトラム障害様行動を誘発することが示された。この結論は変異マウスに自閉症スペクトラム障害の多動症状に治療効果のあるmethylphenidateの投与により多動傾向が緩解されたことからも検証された。
以上より,本ヒストン脱メチル化酵素遺伝子変異マウスが多動性や知的障害を伴うヒト自閉症スペクトラム障害患者のモデル動物として有用であることが示され,今後の診断薬や根本治療薬の開発への寄与が期待される。
18.統合失調症関連遺伝子,メタボトロピックグルタミン酸受容体遺伝子
GRM3 のノックアウトマウスを用いた機能解析
二井偉暢,岩城明子,服巻保幸(九州大学生体防御医学研究所 ゲノム機能学分野)
高雄啓三(京都大学生命科学系キャリアパス形成ユニット)
服部聡子,駒田致和,宮川 剛(生理学研究所 行動様式解析室)
統合失調症は認知機能障害を基本とした精神疾患であり,人口の約1%という高い罹患率を示す多因子病である。我々はグルタミン酸伝達異常仮説に基づいて,グルタミン酸受容体遺伝子群についての系統的な関連解析を行い,代謝型グルタミン酸受容体3型(mGluR3)遺伝子であるGRM3 の多型と統合失調症との関連を見出した。本遺伝子の統合失調症や,高次脳機能への関わりを明らかにするために,マウスmGluR3遺伝子の膜貫通ドメインを含むexon4を欠損させたmGluR3ノックアウト(KO)マウスを作出し,系統的な行動解析を行った。C57BL/6Jに7世代戻し交配後,KOマウスおよび野性型マウスそれぞれ20匹を解析に用いた。その結果KOマウスではOpen field testおよびLight-dark transition testにおいて行動が亢進していた。Barnes maze testでは有意差が見られなかったが,Porsolt forced swim testにおいて参照記憶の障害がみられた。さらにT-maze forced alternation task testでは作業記憶の障害が確認された。新奇環境におけるSocial interaction testでは社会性に違いは見られなかった。CrawleyのSocial interaction testでは移動距離,移動のスピードには有意差はなかったが,KOマウスと野性型マウスとでは各チャンバーでの滞在時間,ケージ付近の滞在時間,ケージ付近の移動回数に差が見られ,KOマウスはsocial interactionが亢進しているものと考えられた。なおElevated plus maze test, Rota-rod testにおいては違いが見られなかった。またプレパルス抑制も正常であった。以上から,mGluR3 KOマウスは統合失調症の中間表現型の一部を表出しており,mGluR3の認知機能への関わりが考えられた。現在,KOマウスの前頭前野における遺伝子発現解析をマイクロアレイを用いて行っているが,MAPKシグナル伝達,カルシウムシグナル伝達,長期増強などのパスウェイに関与している遺伝子の発現変化を認めている。今後,行動亢進とともに参照記憶や作業記憶障害の分子機構を明らかにするために,線条体におけるドーパミン放出,代謝の解析とともに,海馬の成熟度やLTPの解析を行う予定である。
19.プロテインキナーゼPKN1遺伝子のキナーゼネガティブ変異
ノックインマウスを用いた機能解析
向井秀幸(神戸大学自然科学系先端融合研究環バイオシグナル研究センター)
服部聡子,駒田致和,宮川 剛(生理学研究所・行動様式解析室)
PKN1は,低分子量GTP結合タンパク質Rhoおよび脂肪酸依存性のタンパク質リン酸化酵素であり,脳を含む種々の組織において発現が認められている。海馬スライス標本をもちいた電気生理学的検討から,PKN1がシナプス可塑性に関与していることが示唆されてきた。そこでPKN1の,記憶・学習を含む神経機能における役割を明らかにすべく,PKN1のキナーゼ活性を欠失させた変異体のノックインマウス(以後「PKN1キナーゼネガティブノックインマウス」と表記)を作製し,系統的な行動解析を実行中である。
C57BL/6N純系バックグラウンドをもつPKN1キナーゼネガティブノックインマウスのホモ型ストレイン20匹,および同胞野生型ストレイン20匹を用いて,現在までにgeneral health and neurological screen, 明暗選択試験,オープンフィールド試験,高架式十字迷路,ローターロッド試験,ホットプレート試験,社会的行動試験,プレパルス抑制試験,強制水泳試験,社会的行動試験(Crawley version)などが行われた。現在までのところPKN1キナーゼネガティブノックインマウスにおいて不安様行動が亢進していることを示唆するデータが得られており,これについてさらに検討が必要である。今後は,恐怖条件付け試験,尾懸垂試験,ホームケージモニタリング,に加えて,バーンズ迷路や八方向放射状迷路等の記憶・学習試験を加え,解析をすすめる予定である。
20.光顕・電顕相関観察法による細胞内核酸分子動態の解明
金子康子,萩原小百合(埼玉大学)
新田浩二(テラベース株式会社)
永山國昭(生理学研究所・岡崎統合バイオサイエンスセンター)
Hoechst 33342で蛍光染色したDNAを含むバクテリアを位相差低温電子顕微鏡で観察すると蛍光DNAに対応する部位に繊維状構造を高コントラストで観察することができた。この方法を用い,同一試料のDNAを蛍光顕微鏡と位相差低温電子顕微鏡で観察することを目指した。
シアノバクテリアSynechococcus elongatus PCC7942は長さ数mmの桿状菌で,個々の細胞は2-5コピー(1コピーあたり約270万塩基対からなる)の環状クロモソームDNAを含む。このDNAは全長数mmに及び,高次のらせん構造や折れたたみ構造をとることにより細胞内にコンパクトに保持されていると考えられる。
S. elongatus PCC7942は明暗周期により細胞分裂が同調化する。Hoechst 33342で染色したDNAを経時的に蛍光顕微鏡観察すると,DNAの形状は細胞分裂の周期に合わせて規則的に変化した。細胞伸長期には細胞内に拡散しているDNAは,細胞分裂に先立ってスポット状に凝集し,さらに太いひも様構造を経て娘細胞に分配されることが明らかになった。このときの太いひも様DNAの微細構造を位相差低温電子顕微鏡で観察することを試みた。
加速電圧200~300kVの位相差低温電子顕微鏡により,DNA繊維などの微細構造を明瞭に可視化するために,半溶解細胞を作製した。細胞壁を酵素処理により分解した後,DNAの高次構造を維持するためにスペルミジンを加え,低張処理により細胞を穏やかに破壊した。蛍光顕微鏡観察でHoechst 33342染色したDNAの局在を確認した後,急速凍結し位相差低温電子顕微鏡観察を行った。DNAの局在を示す蛍光に相当する部位に高いコントラストで,一定の太さの繊維状構造が規則的にらせんや折れたたみ構造を構築する様子を明らかにすることができた。
今後,新たに開発されている同一細胞・同一視野を光顕・電顕同時観察することが可能なハイブリッド顕微鏡を用いることにより,蛍光染色したDNAの同定と微細構造観察を,同時により高精度で行うことが可能となる。また,細胞分裂に先立って形成されるDNAの太いひも様構造の3次元立体像を位相差トモグラフィーにより解明することができる。本研究の遂行により,バクテリア細胞分裂時のDNAコンパクト化と分配に関する新たな知見を得ることが期待できる。
21.ハイブリッド顕微鏡用環境制御セルの開発
箕田弘喜(東京農工大学工学部)
永山國昭(生理学研究所・岡崎統合バイオサイエンスセンター)
位相差電子顕微鏡法に光学顕微鏡を組み合わせたハイブリッド顕微鏡を開発したが,これに環境制御型透過電子顕微鏡法を組み合わせて,生体活性のある浸水状態の生体高分子の光学顕微鏡・電子顕微鏡同時直接観察を実現するために,試料ホルダーの設計製作を進める必要がある。
位相差顕微鏡法は,電子の干渉性を利用した観察手法であるのに対して,環境制御型電子顕微鏡法を用いた活きたミオシン分子の観察においては,液体中の試料の観察を行う必要があるため,入射電子の干渉性を低下させてしまう。干渉性の低下は試料コントラストの低下を招くため,干渉性の低下を極力抑制した条件での試料観察が可能な試料ホルダーを開発する必要がある。本共同研究はその試料ホルダー設計のための条件確認という予備実験としての意味合いを持っている。
ミオシン分子を重合して作製したミオシンフィラメントを位相差電子顕微鏡法で,室温および低温条件で観察した結果,いずれの条件でも高いコントラストでの観察が実現できることを確認でき,環境制御型電子顕微鏡法と組み合わせてミオシン分子を直接観察する見通しが立った。更に観察結果から,試料ホルダーのデザインを決定するのに必要な情報が得られた。この結果を元にH21年度も引き続き共同研究を進め,環境制御条件での位相差顕微鏡法観察による生体分子の直接観察を行うべく,試料ホルダーの設計製作と予備実験を進めた。
試作した試料ホルダーが概ね完成し,予備実験を行った。浸水条件での光学顕微鏡・電子顕微鏡同時観察は実現したが,電子顕微鏡内の真空が上がらず,長時間の使用に耐えられなかった。これは,ホルダー挿入による電子顕微鏡内部の真空劣化が原因であった。原因個所の特定に手間取ったが,結局,リークが原因ではなく,構造上ガス負荷が大きいことが真空が上がりにくい原因と分かり,ホルダーの改造を進めている。
予備実験については,昨年度使用したZernike位相差法に加えて,Hilbert位相差法を利用した試料観察も行い,位相差法と環境制御TEMとの組み合わせによるコントラスト,分解能と水膜厚さとの関連についての知見が得られてきており,ホルダーの改造が完了次第,環境制御試料ホルダーをハイブリッド電子顕微鏡に導入しての本格実験を進める予定であり,H22年度中の完成に向けて,予備実験およびホルダー改良を進めている。
22.抗酸菌におけるZiehl-Neelsen染色の機序に関する
位相差低温電子顕微鏡を用いた検討
山田博之,前田伸司(公益財団法人結核予防会結核研究所)
藤原永年(大阪市立大学)
Apoorva Bhaat(School of Biosciences, University of Birmingham)
新田浩二(テラベース(株))
Radostin Danev,飯島寛文,永山國昭(生理学研究所・岡崎統合バイオサイエンスセンター)
抗酸菌属は結核菌やらい菌など100種を超える菌から構成され,その特徴は抗酸菌染色の過程で酸による脱色に耐えて,フクシンによる染色が維持されることである。しかし,結核菌でも培養条件(低酸素,薬剤存在下)により抗酸性の低下することがあり,抗酸性自体の機序は不明である。そこで,位相差低温電子顕微鏡を用いて,抗酸菌染色が菌体のどこを染色するのか,抗酸性の有無を反映する菌体の構造的差異があるかどうかを検討する予定であったが,フクシンの溶媒であるフェノール・エタノールの混合液のみによる処理でも,位相差電顕観察でコントラストが生じたため,この試みは断念した。
2007年にBhaatらの報告で,結核菌細胞壁成分のミコール酸伸長酵素であるkasB を欠損させた変異株が抗酸性を完全に消失することが明らかにされたが,著者らは電子顕微鏡観察を行っていなかった。この変異株を入手することができたので,元の野生株,kasB KO株,kasB 補完株を2.5% glutaraldehyde固定し,DDWで洗浄後,氷包埋のcryoelectron microscopyで観察した。
当初,kasB KO株はミコール酸の伸長が不完全であるとされていたので,その細胞壁の厚さが野生株や遺伝子補完株と比較して減少していることを期待したが,残念ながら,3株間で細胞壁の厚さに有意な差はなかった(Wild 43.35 ± 6.13 nm vs. KO 45.98 ± 11.32 nm vs. Comp 40.71 ± 6.3 nm)。その代わり,細胞壁領域の電子密度はkasB KO株が他の2株と比較して有意に低く(wild 301.40 ± 262.13 vs. kasB KO 567.09 ± 372.65 vs. Comp 235.20 ± 174.9, wild vs. KO; p<0.05, Comp. vs. KO; p<0.01),KasBの欠損によりミコール酸の密度が減少し,細胞壁の構造が粗になったことが抗酸性の消失の原因であることが示唆された。
抗酸性の機序はいまだ不明であるが,今回のデータは抗酸性を消失した変異株の電子顕微鏡観察によるもので,これまで例がないと同時に極めて有意義なデータであり,現在論文執筆中である。
23.位相差電子顕微鏡によるインフルエンザウイルスの構造解析
山口正視(千葉大学・真菌医学研究センター)
Radostin Danev,永山國昭(生理学研究所・岡崎バイオサイエンスセンター)
インフルエンザウイルスは,世界的流行が危惧され,人類にとって大きな脅威の一つである。インフルエンザを適切に予防,治療するためには,インフルエンザウイルスの構造を正確に理解するなど,基礎的な情報が必須である。本研究では,永山國昭教授らが開発した位相差低温電子顕微鏡を用いて,自然なままのインフルエンザウイルスの詳細な構造を解析することを目的とする。
鶏卵で培養した,インフルエンザAウイルスを,ショ糖密度勾配遠心法などを用いて精製し,ホルマルン処理して,ウイルスを不活性化した。予め親水化したマイクログリッドにウイルス懸濁液を一滴つけ,余分の液を吸い取ったあと,急速凍結装置を用いて液体エタン中に投下し,液をガラス状に凍結した。この操作により,インフルエンザウイルスは薄いガラス状の氷中に包埋される。次に試料を,クライオトランスファーシステムにより,ゼルニケ位相板を装着したクライオステージをもつJEOL 3100FFC電子顕微鏡に挿入した。撮影は,加速電圧300kV,試料温度-269℃,直接倍率4万倍で,CCDカメラを用いて最少電子線照射法により行った。また比較のために,位相板をぬいて通常のクライオ電子顕微鏡像も撮影した。
インフルエンザウイルスは,氷包埋位相差電子顕微鏡法では,正焦点で撮影しているにもかかわらずコントラストが高く,脂質二重層や表面のスパイクが明瞭に観察できた。ウイルスは,球状および細長い形状の2種類に分類できるが,さらに,エンベロープのマトリックス層の微細構造により,3つの種類に分類できることがわかった。また,平均直径(120nm)のウイルス粒子には,約450個の糖タンパク質が存在することがわかった。さらに,コアの部分で,リボ核タンパク質が,1+7の配置を呈しているウイルス粒子も観察された。以上のことから,氷包埋位相差電子顕微鏡法は,さまざまなウイルスの微細構造解析に非常に有用な手段を提供すると期待される。
24.カイコの休眠誘導に関わる温度センサーの解明
塩見邦博(信州大学線維学部)
曽我部隆彰,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
生物は季節への適応進化として表現型の可塑的変化の一つである季節的多型を生活史形質として獲得している。カイコに見られる胚休眠はユニークな季節的多型であり,この休眠性は母蛾が胚期に受けた外部環境温度によって決定する。胚発生期を15度で過ごすと次世代は非休眠卵になり,25度で過ごすと休眠卵になること,さらに,この休眠卵は休眠ホルモンによって誘導されることが分かっている。カイコの胚休眠は外部環境温度の受容によって次世代の休眠性が決定するという,世代を超えた温度応答機構であると言える。しかし,胚期にどの細胞のどの分子が環境温度を感知して休眠ホルモンの放出制御が行われているかは不明である。そこで,哺乳類から昆虫まで広く環境温度の感知に関わる温度感受性TRPチャネルがカイコ胚の温度受容に関わっていると想定して,カイコTRPチャネルのクローニングを試みた。
その結果,BmTRPA1, BmTRPA3, BmPyrexia, BmPainless, BmTRPA4のクローニングに成功した。これらの遺伝子をHEK293細胞に導入してCa-imaging法,パッチクランプ法を用いて解析したところ,BmTRPA1が温度感受性をもつこと,さらに,哺乳類TRPチャネルを活性化することが知られている複数の化学物質がBmTRPA1を活性化することが明らかになった。
25.消化管に発現する化学物質受容細胞の発現動態に関する研究
桑原厚和(静岡県立大学環境科学研究所)
富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
消化管は消化酵素の分泌や様々な物質の吸収に関わるのみならず,感覚組織として機能することが近年明らかになりつつある。例えば,舌の味細胞に発現する味受容体も消化管上皮に発現することが報告されている。1989年に最初の分子が報告されたTRPチャネルは,現在では哺乳類でTRPC,TRPV, TRPM, TRPA, TRPP, TRPMLの6つのサブファミリーに分かれる大きなスーパーファミリーを形成し,そのうち9つは温度感受性TRPチャネルとして機能することが明らかになっている。その温度感受性TRPチャネルのうち,TRPV3, TRPV4は上皮で強く発現することから消化管上皮でも機能していることが推測された。そこで,TR-PCR法,免疫組織化学法を用いて,温度感受性TRPチャネルの遺伝子および蛋白質の消化管上皮での発現を検討した。TRPV2, TRPV3, TRPV4の遺伝子が広く(食道から小腸まで)消化管上皮細胞(培養)に発現することが分かった。さらに,TRPV3, TRPV4蛋白質の発現も確認された。TRPV4は機械刺激感受性を持つことが報告されていることから,消化管上皮でも温度受容や機械刺激受容に関わっているものと推定される。
26.黒質網様部GABA作動性ニューロンの代謝依存的活動調節機構
山田勝也(弘前大学医学部)
柴崎貢志,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
現在までに黒質網様部(SNr)が脳内エネルギー基質の低下を感知し,運動制御に結びつける代謝センサー器官として機能する可能性を見いだしている。SNrは高頻度の自発発火を営むGABA作動性ニューロンから構成され,隣接する緻密部からはドーパミンニューロンの樹状突起が侵入しドーパミンを樹状突起放出しているがその作用機序には不明の点が多い。そこで,バイオセンサー法を用い,ドーパミンがアストロサイトのグリシントランスポーターを介してSNrニューロンの自発発火活動を制御する可能性について検討した。多くのアストロサイトにはドーパミン受容体が発現しており,またSNrにおいてアストロサイト代謝の選択的阻害は代謝依存性グリシントランスポーターGlyT1を介して細胞外グリシン濃度を変化させると報告されている。一方,成熟SNrニューロンの発火がグリシンにより直接的に,ドーパミンにより間接的に調節されることを発見し,成熟SNrニューロンにおけるグリシン受容体発現も観察した。そこで,緻密部から放出されたドーパミンがアストロサイトのGlyT1を介したグリシン取り込み調節によりSNrの発火様式を制御する可能性を検証するために,HEK293細胞にグリシン受容体を強制発現させてホールセルパッチクランプ法によるバイオセンサーを用いてSNrの初代培養アストロサイトにドーパミンを投与した際のグリシン電流の観察することに成功した。ほとんどのGABA作動性SNrニューロンはドーパミンに応答しなかった。加えて,RT-PCR法によってアストロサイトにドーパミン受容体遺伝子が発現していることを確認した。これらの結果は,ドーパミンがアストロサイトを介してSNrニューロンに間接的に作用することを示している。
27.膜翅目昆虫特異的な温度応答性HsTRPAチャネルの活性化メカニズム
および生理機能の解析
門脇辰彦(名古屋大学大学院生命農学研究科)
曽我部隆彰,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
ミツバチの重要な社会性行動の1つとして,昼夜や季節に伴う外気温の変動に対し,巣内の温度を常に一定(33℃)に保つ行動がある。したがって,ミツバチは他の昆虫には存在しない,温度受容センサーおよび温度認知能力を持つことが推定される。そこで,ミツバチゲノムの解読結果から同定された新規温度受容センサーの生理機能を解明することにより,集団として恒温性を示すミツバチの社会性行動の動作原理を抽出することを試みた。6つのミツバチTRPチャネルをHEK293細胞に強制発現させて,Ca2+イメージング法を用いて温度感受性を検討した。6つのTRPチャネルのうちTRPAファミリーに属する1つのチャネルを発現させたHEK293細胞に置いて40度までの温度刺激に対して細胞内Ca2+濃度の増加が認められた。このクローン(ミツバチに特異的なTRPAチャネルでありAmHsTRPAと名付けた)について,パッチクランプ法による膜電流解析を行い,全細胞記録法において平均33.9度で活性化する外向き整流性のある非選性陽イオンチャネル電流を確認した。パッチ膜だけのinside-out modeにおいても温度刺激による単一チャネル電流活性化を観察した。このチャネルは哺乳類TRPA1チャネル刺激物質であるAITC, cinnamaldehyde, TRPV3刺激物質camphorによっても活性化された。AITC, camphor等は防虫剤として用いられており,34度以上の温度と刺激同様にミツバチに対して侵害刺激となっているものと推定された。ruthenium red, metholによってAmHsTRPAチャネル活性は阻害された。温度と化学物質刺激によって活性化された電流はともに陽性電位で外向き,陰性電位で内向きの整流性を示したが,陽イオンの透過性は異なり,チャネルのgating mechanismが異なるものと推定された。
28.筋機械痛覚過敏におけるTRPチャネルとASICチャネルの役割
水村和枝,片野坂公明,田口 徹(名古屋大学環境医学研究所)
曽我部隆彰,柴崎貢志,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
温度センサーや酸のセンサーとして見つかったTRPV1, 2, 4やASICsが,機械痛覚過敏に関わっているとの報告があり,水村らもまた伸張性収縮負荷による遅発性筋痛の機械痛覚過敏にTRPチャネル,ASICチャネルが関与することを明らかにしてきた。このように,通常機械応答に関与していない分子が,組織状態の変化により機械応答の増大をおこす機構を探ることは,侵害受容機構を理解する上で大変重要である。そこで,水村らが開発したラット後肢に伸張性収縮負荷を加えるモデルを野生型マウスに適用したところ,ラットより短いものの2日まで持続する遅発性筋痛の機械痛覚過敏が観察された。この機械痛覚過敏は,TRPV1阻害剤capsazepineで抑制され,TRPV1欠損マウスではほとんど観察されなかった。ASICs阻害剤amilorideでも伸張性収縮負荷による機械痛覚過敏の軽減が観察された。さらに,TRPV4欠損マウスでも伸張性収縮負荷による機械痛覚過敏の軽減が認められたことから,伸張性収縮負荷による機械痛覚過敏の発生に複数のチャネル(TRPV1,TRPV4, ASICs)が関与する可能性が示唆された。
29.CNR/プロトカドヘリン遺伝子ジーンターゲティングマウスの作製と機能解析
八木 健,平林敬浩(大阪大学大学院・生命機能研究科)
平林真澄,冨田江一,三宝 誠,山内奈央子
クラスター型プロトカドヘリン(Pcdh)ファミリー遺伝子はCNR/Pcdha,Pcdhb,Pcdhg 遺伝子クラスターから構成されており,これらの遺伝子クラスターから発現する約60種類のPcdh分子種はいずれも細胞外領域に6つのカドヘリンモチーフをもつ1回膜貫通型タンパク質である。プルキンエ細胞を用いてPcdhファミリー遺伝子発現を単一神経細胞レベルで解析した結果,個々のプルキンエ細胞では異なるPcdh分子種を複数組み合わせて発現していること,さらにこの発現が染色体レベルで制御されていることが明らかとなり,単一神経細胞内で発現するクラスター型プロトカドヘリンの組み合わせは,数百万通り以上になると推定される。また,この単一細胞レベルでの差次的な発現様式は,海馬,大脳皮質,嗅球,線条体などほとんど全ての神経細胞で認められており,Pcdh遺伝子ファミリーは脳神経系における単一神経細胞の多様化や個性に関わることが示唆されている。しかし,これまでに同遺伝子の生理機能については明らかになっていない点が多い。そこで本研究ではPcdh遺伝子ファミリーのうち,Pcdhg 遺伝子の生理機能を明らかにすることを目的とし,Pcdhg 遺伝子改変マウスを作製した。以前,他の研究グループによりPcdhg 遺伝子ノックアウトマウスでは出生後24時間以内に死亡することが報告されており,通常の遺伝子ノックアウトマウスでは生後の神経回路形成時におけるPcdhg の機能が解析できなくなることから,本研究で作製する遺伝子改変マウスはCreの発現により遺伝子を欠損できるPcdhg 遺伝子コンディショナルノックアウトマウスとした。
作製したPcdhg 遺伝子コンディショナルノックアウトマウスに全身でCreを発現するトランスジェニックマウスを交配し得られたマウスを解析したところ,Pcdhg タンパク質を発現せず,Pcdhg 遺伝子ノックアウトマウス同様に生後24時間以内に死亡した。また,大脳皮質特異的にCreを発現するトランスジェニックマウスと交配し得られたマウスは大脳皮質でのPcdhg の発現は認められないもの,生後まもなく死亡することはなかった。
現在,このコンディショナルノックアウトマウスに種々のCre発現トランスジェニックマウスを交配し,Pcdhg 遺伝子の機能解析を進めている。
30.脳領域特異的なコンディショナルなメタスチンノックアウトマウスの
作製とその解析
前多敬一郎,冨川順子,平嶋 昴(名古屋大学大学院生命農学研究科)
平林真澄
メタスチン(キスペプチン)はGPR54の内因性リガンドとして発見された神経ペプチドである。このペプチドを含むニューロンは,近年,性腺刺激ホルモン放出ホルモン(GnRH)の分泌を直接制御し,卵巣から分泌されるエストロジェンのGnRHへのフィードバック効果を仲介するニューロンとして注目されている。
メタスチンニューロンは,げっ歯類脳内では2つの集団を形成し,一つは前腹側室周囲核(AVPV)に,もう一つは視床下部弓状核(ARC)にある。AVPVにある集団は排卵を制御し,エストロジェンの正のフィードバックに関与するとされている。ARCの集団の機能は全くわかってないが,われわれはこの集団が,GnRHのパルス状分泌を制御しており,卵胞発育を制御することで生殖機能全体の中枢として機能していると考えている。本研究では,メタスチンニューロンの脳内の2つの集団の生理的役割を明らかにするため,Cre/loxPシステムを用い,それぞれの脳領域で特異的にメタスチン発現を欠損するようなコンディショナルKOマウスの作出を目指している。
マウスメタスチン遺伝子のexon 3を含む領域をloxPではさんだコンストラクトを組み込んだベクターをエレクトロポレーション法によりES細胞に導入し,同領域が組換えられたESクローンを得た。このESクローンを8細胞胚に注入し,キメラマウスを作出し,floxマウスが誕生した。
また,AVPVあるいはARCのいずれのメタスチンニューロンで特異的にCreを発現するマウスを作出するため,現在メタスチンの領域特異的なエンハンサー部位を明らかにしようとしている。このため,メタスチンペプチドをコードする遺伝子領域の上流22kbpおよび下流5kbpを上限とするさまざまな長さの配列にAcGFP1遺伝子をつないだコンストラクトを作成し,マウス受精卵に注入し,TGマウスを作成して,in vivoのreporter assayを行っている。現在複数のコンストラクトを導入したTGマウスが誕生し,うち,ひとつのラインについては,AVPVでのみGFPを発現していることを確認している。
31.臓器欠損モデルラットを用いた臓器再生
中内啓光(東京大学医科学研究所)
平林真澄
幹細胞を用いた臓器再生は我々の目指す究極的な目標の一つであり,そのための有用な実験動物モデルの存在は不可欠である。そこで本共同研究において臓器を欠損する遺伝子改変ラットを作製することにより,個体レベルでの臓器の“空き”を作り出す。そこに同種またはマウス等異種の幹細胞を移植することにより移植した細胞の治療効果,あるいは臓器発生への寄与能を評価する系として利用することを目的とする。
臓器欠損モデルラットの作製に向けて,第一に前核期DNA注入法を介してトランスジェニック(Tg)ラットを作製した。導入遺伝子はPdx1 という膵臓特異的な遺伝子のプロモーターの下流にloxPサイトで挟まれた蛍光タンパク質Venusの遺伝子,さらにその後ろにジフテリア毒素(DTA)を配した。よって通常のラインでは膵臓がVenusにより黄色蛍光を示し,Cre recombinaseの発現によりDTA発現が誘導され,膵臓を欠損可能なモデルである。生まれてきた数ラインのTgラットのうち,胎児期において膵臓の原基に特異的にVenusの発現が認められたラインを2系統確立することに成功した。現在,このラインにCreを恒常的に発現するTgラットを交配させ膵臓の欠損を引き起こすことができるか検証中である。
一方,昨年度我々は生殖系列に効率的に寄与するラットES細胞株の樹立に成功したことから,この株を用いてノックアウト(KO)ラットの作製も試みている。破壊する遺伝子は先にあげたPdx1 で,ラットPdx1 の遺伝子座近傍から相同領域をクローニングし,ターゲティングベクターを作製し,ラットES細胞にエレクトロポレーション法によりそれらを導入し,薬剤選抜を行った。その結果得られたコロニーからゲノムDNAを抽出し,PCR法により相同組換えの確認を行ったところ,組み換えが起こったES細胞を得ることに成功した。現在その細胞を用いてキメララットを作製し,生殖系列への伝搬を確認中である。
以上,TgラットもしくはKOラット作製の2つのアプローチから膵臓をターゲットとし臓器欠損を示すラットを作製中である。今後,得られた目的のラットを確立した後,それらにマーキングを施した幹細胞を胚発生,あるいは出生後に導入し,治療効果あるいは欠損臓器への寄与等をその後の解析により評価する。
32.トランスジェニック動物作製への凍結乾燥精子の利用
保地眞一(信州大学繊維学部・生物機能科学課程)
平林真澄
精子の凍結乾燥により遺伝資源の効率的保存が可能になるばかりでなく,顕微授精を介したトランスジェニック個体の作製にも応用できる。われわれは2008年,ラットの精子を凍結乾燥後に冷蔵保存し,1年後に正常な産仔を作製することに成功した。このように,マウスやラットに代表される小実験動物では長期にわたって冷蔵保存した凍結乾燥精子から産仔作製が可能である。しかし他の哺乳動物種における精子の凍結乾燥では,胚盤胞作製までか,産仔作製にまで行っても非常に低い成功率しか得られていない。これは齧歯類で効率的に機能した凍結乾燥条件があらゆる動物種に適用できないということを示す。そこで材料入手が比較的容易で,ICSI技術も近年大きく改善されたウシをモデルとし,凍結乾燥条件の最適化を目指した。まず,+4℃での冷蔵保存期間が凍結乾燥ウシ精子のDNA損傷に及ぼす影響をアルカリコメットアッセイによって調べたところ,半年までの保存では尾部モーメント(断片化DNAの量に損傷程度を乗じた値)に変化はなかったが,それより長い保存期間ではDNAの損傷度合いが増した。一方,精子頭部が引き金を引くカルシウムオシレーション誘導能力,♂ゲノムに特異的な能動的脱メチル化現象のプロフィール,精子中心体の微小管形成中心としての能力には,凍結乾燥による明らかな悪影響は認められなかった。最後に,乾燥行程を従来の2段階から1段階に短縮したプログラムに変更したが,顕微授精後の胚盤胞作製効率の改善にはつながらなかった。以上,ウシ精子に対して,凍結乾燥用バッファーの組成や乾燥プログラム自体の再検討が迫られる結果となった。
33.ラット精子幹細胞を用いた顕微授精
篠原隆司(京都大学大学院医学研究科・遺伝医学講座分子遺伝学分野)
平林真澄
我々は昨年までにラット精子幹細胞(Germline Stem, GS細胞)の遺伝子改変を行ってきた。現在の段階で問題がある点として,ラットGS細胞への遺伝子導入とその後の薬剤選択の部分があげられる。これを解決するために,昨年度に我々は異なったラットの遺伝系統からの新規のGS細胞の樹立を行った。本年度は1)これらの細胞への遺伝子導入の影響を調べてみるとともに,2)これらの異なったライン間での安定的な遺伝子導入効率の検討を行った。
1)異なった遺伝系統ラット精子幹細胞への遺伝子導入
これまでに樹立されたSD, Wistar, Donryu, Long-Evans, Brown Norway系統のラットのGS細胞にROSA betageoのレトロウイルスベクターを用いた遺伝子導入を行った。いずれのラインも6日で2-4倍に安定に増殖する。その結果,それぞれの系統で安定的に遺伝子導入されたGS細胞を得ることができた。遺伝子導入の効率は,系統により差があることがわかり,10(5)個あたりの遺伝子導入ではSD×Wistar F1系統では0.4だったのに対し,Wistar, BN系統では全くコロニーを得ることができなかった(図1)。遺伝子導入されたクローンについてはサザンブロットにより,これらの細胞へトラップベクターが一個だけ挿入されていることが確認された。これらの結果から,特にラットGS細胞の増殖および遺伝子導入効率については遺伝的な影響があることが明らかになった。
2)異なったクローンにおける遺伝子導入効率と胎児作製効率の違い
ノックアウトクローンを得るために,これまでに樹立されているSDラット由来のGS細胞に遺伝子導入を行った。合計で24ラインのGS細胞にトランスフェクションを行った後,ネオマイシンにより薬剤選択を行った。14ラインから合計82ラインのGS細胞が樹立されたが,(平均5.9個),他の10個のラインからは全く樹立することができなかった。以上の結果はラットGS細胞におけるエピジェネティックな差異が存在していることを示唆する。マウスでは同じ遺伝背景である限りは,このようなライン間の差というものは見られておらず,ラット特有の問題だと考えられる。
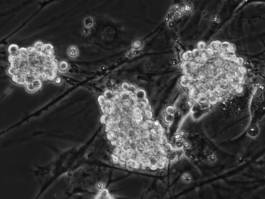 図1 ネオマイシン選択により樹立されたSD×Wistar F1ラット由来のGS細胞 |
34.2光子FRET顕微鏡を用いた複数機能を同時可視化する手法の開発と
細胞死の分子メカニズムの解明
永井健治,堀川一樹,植松利亮(北海道大学電子科学研究所)
根本知己(生理学研究所・多光子顕微鏡室)
【目的】アポトーシス(プログラム細胞死)は個体がその恒常性を維持するための最も重要な生理現象の一つである。例えば,癌化した細胞の除去や,個体発生における形態形成の原動力,或いは,免疫系の自己抗原に反応する細胞の除去など,様々な生理現象においてアポトーシスは重要な役割を果たしている。本研究はアポトーシス過程におけるCa2+シグナリングとカスパーゼ,それに細胞骨格ネットワークの3者を2光子FRET法により同一細胞内で観察する系を樹立し,アポトーシス誘導の分子ネットワークをシステム的観点から解明する。
【実験内容】我々は世界で最も波長が短い蛍光を発する群青色蛍光タンパク質(Sirius)を開発することに成功した。また,Siriusとシアン蛍光タンパク質(CFP)と組み合わせることで,効率の良いFRETが生じることが明らかにし,Sirius-CFPおよびuvGFP-OFPのFRETペアを利用して,1波長励起4波長測光により,カスパーゼの活性化とCa2+動態の同時可視化を試みた。
【成果】360nmの紫外励起,また710nmのフェムト秒パルスレーザによる2光子励起を用いて1波長励起4波長画像取得を行った後,オフラインでスペクトル分離を行って蛍光のクロストークを除去することで,定量的なDual FRETイメージング法を行うことができた。これにより,1つの細胞内における細胞死刺激に伴うCa2+濃度の変動とカスパーゼ3の活性化を同時に計測することに成功した(Tomosugi et al Nature Methods 2009)。
35.SNAP23膵臓外分泌細胞特異的欠損マウスを用いた
SNAP23の外分泌における機能の解明
原田彰宏,國井政孝(群馬大学生体調節研究所)
根本知己(生理学研究所・多光子顕微鏡室)
SNAREと呼ばれる蛋白は小胞と細胞膜の融合に重要である。SNAREは小胞側に局在するv-SNAREと標的膜側に局在するt-SNAREが存在するが,本研究では,調節性分泌に重要なt-SNAREであるSNAP23を膵臓外分泌細胞特異的に欠損するマウスを作製し,その外分泌細胞を2光子顕微鏡で観察することによってSNAP23の外分泌顆粒と細胞膜の融合時における機能の解明を行うことを目的とする。
群馬大学生体調節研究所でSNAP23 flox/floxマウスと膵臓外分泌腺特異的にCreを発現するElastase-Creマウス(熊本大学山村研一教授から分与)を交配しSNAP23を膵臓外分泌細胞特異的に欠損するマウスを作製した。
そのマウスを,生理学研究所・脳機能計測・支援センター・多光子顕微鏡室の根本知己先生に送り,2光子顕微鏡を用いて膵臓外分泌細胞の外分泌顆粒の放出過程の解析を行った。
その結果,コントロールマウスから採取した膵臓外分泌細胞では,分泌促進物質であるコレシストキニン(CCK)刺激によって腺腔膜における外分泌顆粒の連続的な開口放出(逐次開口放出)が観察された。しかし,膵外分泌特異的SNAP23ノックアウトマウス由来の外分泌細胞ではCCK刺激直後の瞬間的な開口放出は観察されたものの,その後の連続的な開口放出は観察されなかった。このことから,SNAP23が膵臓における外分泌細胞の逐次開口放出に大きく関与していることが推測された。
この結果を元に,今後SNAP23の外分泌における役割を更に解析する。
36.2光子顕微鏡によるPRIP分子を介した開口放出機構の
分子基盤解明研究
兼松 隆(九州大学大学院歯学研究院口腔細胞工学)
(現:広島大学 大学院医歯薬学総合研究科 歯科薬理学)
根本知己(生理学研究所・多光子顕微鏡室)
【目的】新規イノシトール三リン酸結合性タンパク質(PRIPと命名)は,我々が18年前に発見した分子である。この分子の生理機能解明を行うため,PRIPノックアウト(KO)マウスを作製し,その表現型解析を行った。その中で,このマウスの糖代謝機構が変調していることに気がついた。本研究では,糖代謝変調の原因を明らかにすることを目的に実験を行った。
【実験内容】PRIP KOマウスの血糖値や血清インスリン濃度が,野生型マウスのそれらと異なることが明らかとなった。この事から,膵臓のb細胞のインスリン分泌機構の異常を疑った。そこで,野生型およびPRIP KOマウスの膵臓からランゲルハンス島を単離培養し,2光子顕微鏡イメージングによりインスリンの開口放出を可視化し,高グルコース刺激を行った時のインスリン顆粒の単一の融合細孔形成を定量した。PRIP分子は,タンパク質脱リン酸化酵素と複合体を形成する。そこで,次に,PRIPを介した開口放出機構に,タンパク質のリン酸化/脱リン酸化機構が関与しているかを解析した。
【結果】PRIP KOマウスの膵b細胞では,高グルコース刺激時のインスリン開口放出の頻度が,野生型に比べて明らかに亢進していた。インスリンの開口分泌過程は,タンパク質のリン酸化制御によって修飾される。そこで,PRIP KOマウスの膵b細胞をホルスコリンで前処置し,高グルコース刺激を行ってインスリン開口放出頻度を測定した。すると,PRIP KOマウスの開口放出頻度は,野生型の開口放出頻度と同レベルであることが分かった。即ち,ホルスコリンの前処理で細胞内タンパク質のリン酸化レベルを亢進しておくと,刺激依存的な開口放出頻度は,野生型もPRIP KOマウスにおいても同程度になることが明らかとなった。この事は,PRIP KOマウスの膵b細胞では,刺激依存的なインスリン開口放出を調節するタンパク質のリン酸化レベルが,あらかじめ亢進していた可能性がある。そこで,単離しアイソトープでラベルしたランゲルハンス島を用いて,定常状態でリン酸化レベルが亢進しているタンパク質の同定を行った。現在,その候補タンパク質を見出しており,そのタンパク質が何であるか詳しく解析を行っている。
37.2光子顕微鏡による免疫細胞動態制御の解析
木梨達雄,片貝智哉,植田祥啓,羽廣克嘉(関西医科大学附属生命医学研究所)
根本知己(生理学研究所・多光子顕微鏡室)
【目的】リンパ球はリンパ組織と脈管系を循環しながら,生体防御を行っている。本研究はリンパ球とリンパ節ストローマ細胞を可視化して,2光子顕微鏡によるin vivoイメージングによってリンパ球移動を解析し,インテグリン制御分子RAPL, Mst1,ストローマ細胞の役割を明らかにする。
【実験方法】野生型RAPL-/-, Mst1-/-マウスの脾臓からT細胞を単離し,vital dyeでラベル後,正常マウスに静注する。24時間後,リンパ球がリンパ節内に移動した後の細胞移動の移動を,2光子顕微鏡で観察し,軌跡解析を行う。ストローマ細胞の可視化はGFPキメラマウスを作成して行った。2光子顕微鏡による観察は膝下リンパ節を露出し,37度にコントロールした肢固定装置に取り付け,顕微鏡ステージにセットして行った。イメージングは被膜下100mmから300mmの深さの領域を20-30秒間隔で行った。解析はVolocityによって3D自動追跡を行いvelocity, displacement等を測定した。
【実験結果と考察】前年度の研究によって開発した2光子顕微鏡用のリンパ節内イメージングに適した肢固定装置を用いた結果,安定したイメージングを取得できるようになった。野生型T細胞は移動速度(速度レンジ6-20mm/min,平均速度13mm/min,平均移動距離8mm/min)に対して,RAPL-/-T細胞は(速度レンジ2-18mm/min,平均速度7mm/min,平均移動距離4mm/min)であり,有意にリンパ節内移動が低下していた。GFPキメラマウスによってストローマ細胞のネットワークが明瞭に観察できた。野生型ではストローマ細胞に沿って素早く直線的に移動するのに対して,RAPL-/-, Mst1-/-T細胞では,頻繁に停止,turning,蛇行する細胞が目立った。以上の結果からRAPL/Mst1がT細胞のリンパ節内移動に必要であることが判明し,リンパ節ストローマがその移動に重要であることが示唆された。
【論文発表】
Ebisuno, Y. Katagiri, K, Katakai, T, Ueda, Y., Nemoto, T., Inada, H., Nabekura, J., Okada, T., Kannagi, R., Tanaka, T, Miyasaka, M., Hogg, N., Kinashi, T. Blood 115:804-814.2010