1.Electron tomographic investigation of dendritic spine of whole mount cultured neuron on the silicon nitrate EM grid
Hyun Wook Kim, Seung Hak Oh, Im Joo Rhyu
(Department of Anatomy, College of Medicine, Korea University, Seoul, Korea1)
Tatsuo Arii, Keiji Imoto (National Institute for Physiological Sciences, Okazaki, Japan)
The dendritic spine is a protrusion of dendrite of the neuron, which is a major synaptic input of excitatory synapse. Recently many dendritic spine researches on plasticity have been reported thanks to improved quality of the confocal microscopy with fluorescent technique. But the fluorescent images are dependent on the intensity of fluorescence, not actual size of the region of interest (spine). Especially histological characteristic of dendrtic spine neck is important to understand compartment resistance chemical gradient and electricity flow.
We tried to construct high resolution electron tomography with high voltage electron microscope. The 7-10 day-old hippocampal neuron was transfected with a vector containing GFP using a lipofectamine 2000 protocol.
The grid with neuron was fixed and processed for HVEM observation according to the methods of Aizu et al., (1981) except critical point drying. We used freeze drying method. The ficidual gold of 100 nm was applied to this grid. And then the grid was observed and taken serial tilting image for electron tomography. After acquisition of serial tilting image of +/-60o, the series of image was aligned and virtual volume was reconstructed by IMOD program. Further analysis of the neck with control and chemical LTP model is under way.
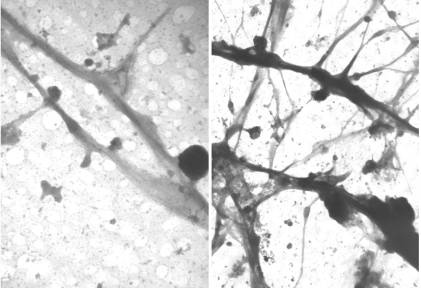 |
|
Representative Image of dendrite and spines after whole mounted grid preparation. |
2.電気シナプスを形成した網膜及び脳ニューロンの樹状突起の構造
日髙 聰(藤田保健衛生大学医学部生理学教室)
ギャップ結合の蛋白サブユニット・コネキシンには,4つの膜貫通ドメインがあり,N末端とC末端は細胞内にあって,1つの細胞内ループと細胞間ドッキングに必要な2つの細胞外ドメインがある。ギャップ結合は,接触する2つの細胞の間で,細胞膜にあるコネキシンチャネルのドッキングによって細胞間チャネルを形成し,ニューロンでは電気シナプスとして働く。電気シナプスはコネキシン36(Cx36)から構成されており,ニューロン群で同期した興奮を引き起こすことに必要であり(Hidaka等,2004, 2006),また神経回路網の発生過程で出現して,ニューロンの機能分化の研究でも注目されている。ニューロン間での電気シナプスの働きを解明するために,コネキシン36に対する特異的な抗体を作成することが重要である。コネキシン36の細胞内ループに対する抗体(Cx36細胞内抗体:Hidaka等,2004)に加えて,人工抗体作成法(Kurosawa等,2008)を用いてギャップ結合の細胞外ドメインに対する抗体(Cx36細胞外抗体)を作成した。
網膜ニューロン間での電気シナプスの形成過程を解明するために,ギャップ結合に対するCx36細胞内抗体とCx36細胞外抗体との免疫反応性を,超薄切片で同定すると共に,5mmの厚さの切片を1,000kVの加速電圧の超高圧電子顕微鏡下で解析した。これらの抗体は,ニューロンペアの突起間にあるギャップ結合を,ニューロンの内側と細胞外からそれぞれ染色した。Cx36細胞内抗体は,超薄切片で大きなギャップ結合の細胞膜直下の細胞内にある裏打ち構造を強く染色した。ギャップ結合によっては,一方の細胞内部分だけが染色された場合があった(hemichannel様の構造)。一方,5mmの厚さの切片を作成し,超高圧電子顕微鏡を用いて,Cx36細胞外抗体の免疫反応性から,ギャップ結合の立体構造を解析した。ニューロン間の接触部位のclose membrane appositionの形態を呈する部位にCx36細胞外抗体の強い免疫反応性が見つかった。これらの微細構造における電子顕微鏡レベルでの免疫反応性と,Cx36細胞内抗体とCx36細胞外抗体とのギャップ結合における免疫反応性を,共焦点レーザースキャン顕微鏡を用いた解析結果とを検討した結果,生きている網膜ニューロンにおける,Cx36細胞外抗体によるニューロン間免疫反応性の強さは,ニューロン間でのギャップ結合形成の発達過程に対応していることが明らかになった。
[文献]
1) Hidaka, S. et al., (2004) Journal of Neuroscience, 24 (46): 10553-10567.
2) 日髙 聰 (2006) 日本顕微鏡学会誌「顕微鏡」 41 (2): 117-119.
3) Kurosawa, G., Akahori, Y., 他29名. (2008) Proc. Natl. Acad. Sci., U S A. 105 (20): 7287-7292.
3.細胞膜タンパク質や細胞骨格などの3次元構造解析
遠藤泰久,吉村亮一,伏木大輔,四方雅人(京都工芸繊維大学・応用生物学)
有井達夫(生理学研究所)
ギャップ結合はすべての多細胞動物にみられる細胞間結合装置で,隣接する細胞と直接的情報伝達を行い,発生期の形態形成,筋組織の同調,神経系における電気シナプスなど多様な機能をはたしている。脊椎動物ではコネキシン・ファミリー,無脊椎動物ではイネキシン・ファミリーが構成タンパク質として知られている。両ファミリーはアミノ酸配列に相同性が見られないが,膜4回貫通構造などの共通性を有している。最近,イネキシンのホモログであるパネキシンが哺乳類で同定され,ギャップ結合の系統発生的な起源,機能的分担,ヘミチャネルとしての機能の詳細はいまだ不明である。我々はイネキシンの細胞膜上での詳細な分布を解析するため,昆虫培養細胞系を用い超高圧電子顕微鏡によって観察を行った。
ホルムバール支持膜を張った金メッシュを70%エタノールで滅菌後,コラーゲンコートを施し,ショウジョウバエ由来の培養細胞株Kc167細胞を培養した。この細胞は胚の血球由来であるが、ホルモン(エクダイステロイド)により神経細胞様に分化することが知られている。4%パラフォルムアルデヒド固定後,抗イネキシン2抗体によりABC-HRP法で免疫染色し,DAB,硫酸ニッケルアンモニウムで発色した。1%オスミウム酸で後固定し,エタノール系列で脱水し,二酸化炭素−臨界点乾燥を行った。試料をカーボン蒸着後,超高圧電子顕微鏡(H-1250M 加速電圧1,000kV)により,同一視野を-60度から+60度まで2度刻みの傾斜連続写真撮影を行った。イネキシンの免疫反応は図1に示すように,ほぼ円形の電子密度の高い構造が細胞膜上に密に集合しており,昨年度観察したヒトスジシマカ培養細胞の構造とよく類似している。個々の構造は酵素反応によって増感されていることを考慮すると,フリーズフラクチャーによって観察されるギャップ結合の膜内粒子の構造に相当すると考えられる。今後,3次元画像解析によりイネキシン・ヘミチャネルの構造を詳細に検討する予定である。
 図1.ショウジョウバエ培養細胞Kc167におけるイネキシン2の免疫反応は,細胞膜上の円形構造の凝集(white arrowheads)としてみられ,ギャップ結合のヘミチャネル構造と考えられる。右の拡大写真には座標用の40nm金粒子がみられる(arrow)。 |
4.細胞内亜鉛の分布に関する細胞化学的研究(継続)
野田 亨(藍野大学医療保健学部理学療法学科)
亜鉛は遺伝子の転写因子をはじめ,いくつかの酵素の構成要素ともなっており,人体に必須な金属である。最近,形質膜をはさんだ細胞内外の亜鉛の輸送や細胞質と細胞小器官との間の亜鉛の輸送に輸送蛋白が関与することが明らかになってきた。そこで我々は亜鉛輸送蛋白の電子顕微鏡レベルの免疫組織化学,および亜鉛そのものを検出する手法を用いて,亜鉛の細胞内動態とその意義について検討した。
昨年度の研究ではラット精巣上体について亜鉛の局在,亜鉛輸送蛋白の局在を検討したが,本年度ではラット膵組織について同様の検討を行った。ラットを亜鉛腹腔内投与群と無処置群の2群に分け,それぞれの組織について,亜鉛輸送蛋白であるZnT5, ZnT7の局在を免疫組織化学的に標識し,また亜鉛の局在をAutometallography(AMG)法で検出した。ラットへの亜鉛の投与は2日間,ZnSO4(5mg/100g.b.w.)を腹腔内投与し,3日目に組織を採取した。組織より凍結切片を作成し,一部の試料では比較のためゴルジ装置のtrans側を標識する抗TGN38抗体との蛍光二重標識を行った。また電顕レベルでの亜鉛輸送蛋白ZnT7の標識は酵素抗体法で行い,その試料の超薄切片はH-7650で,厚切り切片はH-1250M(生理研)を用いて観察した。AMG法によって亜鉛の局在を観察するためには,凍結切片に銀増感反応を行い,電子顕微鏡を用いて観察した。これらの実験より下記の結果が得られた。
1. 蛍光抗体法による観察では亜鉛輸送蛋白ZnT7の分布は膵外分泌細胞のゴルジ装置に,またZnT5の分布は分泌顆粒領域に集中していた。
2. 電子顕微鏡による観察ではZnT7の標識はゴルジ層板のcis側層板に局在していた。
3. AMGによる亜鉛の局在を示す銀粒子は無処置ラットでは有意な局在を認めることはできなかったが,亜鉛投与ラットではゴルジ装置のtrans側層板から分泌顆粒にかけて銀粒子が集中する傾向が認められ,この傾向は超高圧電子顕微鏡による観察からより明瞭となった。
上記の実験結果からラット膵外分泌細胞ではゴルジ装置から分泌顆粒までの広い範囲に亜鉛の取り込みに関係する輸送蛋白であるZnT5,およびZnT7が存在し,亜鉛の負荷に反応し,亜鉛の貯蔵を示唆する所見が示された。
 Autometallography法による亜鉛の局在(亜鉛投与群,1mm厚切り切片像)外分泌細胞の形質膜表面,および分泌顆粒領域には亜鉛の局在を示す銀粒子が集中して分布している。 |
5.嗅球ニューロン・グリアの三次元構造解析
樋田一徳(川崎医科大学解剖学)
シナプス結合の神経回路内での役割を考える上でastrocyteは重要であるが,様々な標識法により染め分けの出来るニューロンとは異なりグリアは細胞の突起部分まで詳細に全体像を特異的に染色することは難しい。これはastrocyteが極めて複雑な形態を呈することによる。そこで我々は超高圧電子顕微鏡によりラット及びマウス嗅球のゴルジ染色標本を層別にastrocyteのトモグラフィー解析を行なっている。当年度も引き続き,マウスの嗅球顆粒細胞層のastrocyteに注目し解析を行なった。
AstrocyteはS100b 免疫染色において顆粒細胞の周囲に微薄な免疫陽性構造が認められ,電顕連続切片から,この構造の多くは薄膜状に隣接する顆粒細胞を取り巻いている。電顕多重免疫染色によって,S100b 免疫陽性astrocyteが取り巻く顆粒細胞のGABA反応性は多様で,astrocyteの被覆率は50-80%であった。
一方,昨年度に引き続き,ゴルジ染色されたastrocyteの薄膜状のこの構造を超高圧電顕による解析を進めた。5mm厚ゴルジ染色切片から,astrocyteの薄膜状突起が顆粒細胞を取り巻いている部分を2º毎に±60º連続傾斜撮影しトモグラフィー解析から三次元再構築を行なった。その結果,顆粒細胞表面の50-90%がastrocyteに囲まれ,これは昨年度のラットastrocyteのデータ,及び,S100b 免疫電顕のデータに近似している。現在,更に解析例数を増やして慎重に検証している。
一方で120kVのデジタル電顕(JEOL-1400)により,150nm厚の準超薄切片のastrocyteの突起部分を報告者の所属する川崎医科大学で1º毎に±70ºトモグラフィー解析を進めているが,より広範かつ高解像度で記録された超高圧電顕像を部分的ではあるが裏付けている。ただ,生理研の超高圧電顕はフィルム撮影した後,PC上での解析処理までに多大な労力が必要であり,120kVデジタル電顕のようなデジタルシステムの導入が,超高圧電顕の汎用性の拡大に不可欠であると痛感している。今後,レーザー光顕と120kVデジタル電顕による解析とともに,超高圧電顕の広範囲かつ高解像度のトモグラフィー解析を進めて行きたいと考えている。
6.神経前駆細胞からの神経新生時の細胞微細構造の観察
小曽戸陽一(川崎医科大学・解剖学教室,
理化学研究所・発生再生科学総合研究センター)
末次妙子(理化学研究所・発生再生科学総合研究センター)
脊椎動物の発生期の脳形成過程で,中枢神経系の神経細胞は,神経管を縁取る脳室帯に存在する前駆細胞である「神経前駆細胞」から生み出される。神経前駆細胞は脳発生初期の自己複製的増殖から,後に神経細胞への分化という発生学上の運命をたどる。単純な神経管から複雑な脳へという組織形成の過程では「時空間的な秩序を伴った」神経前駆細胞の増殖・分化が必須であり,脳形成・神経発生の仕組みを統合的に解明することは,「脳の構築」を知る際の根幹となる。
増殖中の神経前駆細胞に見られる特徴として,その細胞核が「細胞周期」に従って組織内を往復運動することが知られている(“エレベーター運動”,図1)。すなわち,胎児脳組織のアピカル表層で細胞分裂(M期)が起こり,その後のG1期で基底膜方向に細胞核が移行する。DNA合成期であるS期に核は脳室帯の基底膜側に局在し,その後のG2期間に細胞核は再び基底膜側からアピカル側に逆方向に移行する。1930年代の現象の発見以来,動作機構について不明な点が多いこの細胞運動について,我々は包括的な解析を試みてきた。我々が行ったマウス胎児脳組織を用いた定量的タイムラプス測定の結果から,G2期にアピカル表層に向かう細胞核移行は、微小管結合タンパク質であるTpx2の持つ機能に依ることが示唆された。神経前駆細胞はその細胞体より,アピカル側および基底膜側に細長い突起を伸展させているが(図1),我々は神経前駆細胞のアピカル側突起におけるTpx2の局在解析を,生理学研究所の超高圧電子顕微鏡(HVEM1250)を用いて行った。その結果,Tpx2はアピカル側突起内に数本のファイバー様のパターンとして局在することが明らかとなった(図2)。このことは,脳組織中の神経前駆細胞で、Tpx2が微小管と考えられる細胞骨格に集積することを示している。これらの解析の結果,G2期にアピカル表層に向かう細胞核移行は,微小管細胞骨格の細胞周期依存的な制御が必要な「能動的」運動であることが見出された。
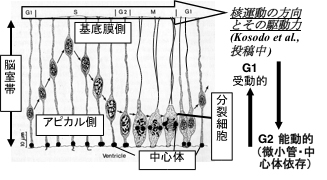 図1.神経前駆細胞のエレベーター運動
|
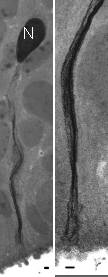 図2.超高圧電子顕微鏡による脳組織神経前駆細胞のアピカル突起内のTpx2の局在観察。
|
7.昆虫脳の微小モジュール‘微小糸球体’の三次元構造解析
泰山浩司,松村龍成(川崎医科大学・自然科学)
樋田一徳(川崎医科大学・解剖学)
有井達夫,村田和義(生理学研究所・脳機能計測センター・形態情報解析室)
昆虫の脳を構成するニューロパイルには,投射ニューロンの終末部をコアとして,これをシナプス後繊維が取りまいて形成される‘微小糸球体microglomerulus’がみられる。我々はこれまでに,キイロショウジョウバエの嗅覚二次中枢(キノコ体傘部と前大脳側葉)には,微小糸球体が機能モジュールとして多数分布していることを明らかにした(Yasuyama et al. 2002, 2003)。また,ワモンゴキブリでは,口器付属肢(小顎鬚と下唇鬚)に分布する嗅覚ニューロンが後大脳嗅覚一次中枢(lobus glomerulatus, LG)に投射し(西野ら,2006),その終末部の一部は微小糸球体様の構造を形成している(泰山と西野,未発表データ,2009)。そこで,昆虫の脳に広く見られる機能モジュールの三次元構造を明らかにする目的で,微小糸球体のコアとなる投射ニューロンの終末構造に注目して超高圧電子顕微鏡により形態解析を行った。
ショウジョウバエ三齢幼虫の脳において,キノコ体傘部に投射する嗅覚二次ニューロンを抗-コリンアセチルトランスフェラーゼ抗体を用いて免疫染色(ABC法とメタルDAB法)し,エポキシ樹脂に包埋した。また,ゴキブリ口器付属肢に分布する嗅覚受容ニューロンに0.25MNiCl2水溶液を注入した後,ルベアン酸による発色と硝酸銀による銀増感を行い,エポキシ樹脂に包埋した。両標本とも5mm厚の切片を作製し,超高圧電子顕微鏡H-1250Mにより加速電圧1000KVで観察した。
ショウジョウバエ幼虫のキノコ体傘部は,ほぼ球形(直径~40mm)のニューロパイルで,嗅覚二次ニューロンの巨大な終末膨大部(直径~6mm)がキノコ体傘部の周辺部に偏在して観察された。免疫染色による発色が弱く,終末膨大部に至る軸索の走行は確認できなかった。一方,Niイオンの注入によって標識されたゴキブリ嗅覚受容ニューロンは,LG内で糸球体を形成し(図1),糸球体内部を走行する嗅覚受容ニューロンの軸索と終末膨大部(直径~1mm)が明瞭に観察された(図2)。超高圧電子顕微鏡による観察によって,微小糸球体のコアとなる軸索終末部の立体像を比較的容易に把握することができ,従来の超薄切片では捉えがたい所見を得ることができた。なお,本研究の一部は北海道大学電子科学研究所神経情報研究分野助教 西野浩史氏との共同研究である。
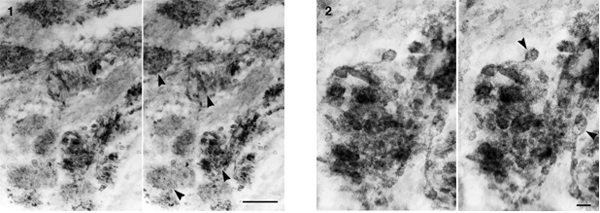
8.嗅覚系における新生ニューロンの遊走と分化に関する三次元的構造解析
清蔭恵美(川崎医科大学解剖学)
Adam C. Puche, Michael T. Shipley (Department of Anatomy and Neurobiology,
University of Maryland School of Medicine, MD, USA)
嗅覚一次中枢である嗅球の介在ニューロンは,成体においても神経新生によってたえず生まれ変わっている。成体側脳室前角の脳室下帯subventricular zone(SVZ)から生まれた前駆細胞は脳室壁に沿って接線方向に遊走し,嗅球に到達すると放射状に遊走しながら分化し,最終的に局在する層へたどり着く。最近我々は顆粒細胞層の約半数の遊走細胞がastrocytes及びその周囲の毛細血管を足場として移動することを発表した(Bovetti et al 2007)。本研究では特に嗅球深部における遊走細胞に注目し,その詳細な構造と,毛細血管及びその周囲にあるastrocytesとの関係について超高圧電子顕微鏡による高解像度三次元的構造解析を行った。
GABAの合成酵素であるglutamic acid decarboxylase 65KDa(GAD65)及びドーパミンの律速酵素であるtyrosine hydroxylase(TH)の発現をgreen fluorescent protein(GFP)で置き換えたトランスジェニック(Tg)マウスを灌流固定後,嗅球から50mm厚の連続スライスを作製した。抗GFP抗体を用いた免疫染色後,一部をエポン樹脂で包埋し,1~3mmの切片を作製し嗅球SVZの細胞を超高圧電子顕微鏡で観察を行った。Metal-DAB(Pierce社)によるニューロンの三次元構造は,適度なコントラストを得るための染色・撮影条件設定に苦慮したが,年度末になってようやく条件設定ができ始め,現在更に染色条件の向上を検討している。
また,6~8週マウスの側脳室前角のSVZにcholera toxin beta-subunit(CTb)をinjectionし,3~7日後に還流固定後,抗CTb抗体と抗S100b抗体を用いた免疫二重染色を行い,更に蛍光ゴールド試薬で追加標識後,同様に超高圧顕微鏡用に切片を作製し,嗅球SVZ内の遊走細胞の微細構造観察を計画している。現在,安定してSVZにトレーサーを入れられるようになり,遊走細胞の標識が向上してきた。今後も引き続き嗅球上衣層内の遊走細胞と毛細血管,その周辺のastrocytesとの局在関係についてより高精度な三次元計測を行なう予定である。
9.超高圧電顕観察のために作成した生物試料の検討
-準薄切連続切片を用いた皮膚光覚細胞を覆う支持細胞の同定-
片桐展子,片桐康雄(弘前学院大学・看護学部)
霜田幸雄(東京女医大・総研)
有井達夫(生理研超高圧電顕)
イソアワモチ(軟体動物・腹足類)の多重光受容系のうち,皮膚光覚細胞(Dermal Photoreceptor cell, DP細胞)は眼外光受容器の希少な例である(Katagiri, Y. et al. 1985)。DP細胞は皮下組織に分布,周囲に色素などがないので外表面から識別できない,切片上でもその存在を容易に捉えられない。多重光受容系の情報伝達機構の解明のため,準薄切連続切片の超高圧電顕観察を試みた。エポン包埋切片の超高圧電顕観察のために試みた諸方法は,2010年度生理研研究会に報告したので参照されたい。
DP細胞の微細構造,特に軸索の解明のため,加温オスミウム染色後にエポン包埋した試料を,準薄切連続切片(約700枚,0.4mm厚)を作製して超高圧電顕(H-1250M)で観察した。成体(体長7-8cm)では19個のDP細胞が一群をなす例を調べた。DP細胞は径100mmに達する大形,球形,その端部(細胞の1/3)には微絨毛が密生する特異な感桿型光受容細胞である。端部の基部付近から径0.5m前後の軸索が出ること(図A),DP細胞側面から出た軸索の走行を追跡して1群内の複数のDP細胞の軸索が同じ小神経束に入ることを明らかにした(図C)。DP6細胞(径40mm)では,軸索起始部から結合組織内の小神経束に至るまでの軸索の長さは310mmであった。その経路において軸索の周囲にはそれを覆い,支持する細胞は見られなかった。DP細胞の表面には支持細胞(Supportive cell, SC細胞)が存在し,特に軸索起始部にはその核が見られる(図B)。また,小神経束の表面には神経束を束ねるようにグリア細胞が存在する(Katagiri et al. 1990)。SC細胞は核のある部位では明瞭に認めることができるが,他の部位は薄く扁平で電顕観察でも識別が難しい。DP6細胞を覆うSC細胞はその核の数から4個と推定された。
幼動物(体長1cm)において,皮下組織に微絨毛やphotic vesicleが未発達で,DP細胞としては幼若な形態を示すDP1とDP2細胞を見いだした。これらの細胞は小形(径5-6mm)で,大きな核が細胞体を占める。両細胞の微絨毛の基部から,それぞれ1本の軸索が出て,すぐに(1-2mm)近くの小神経束に入る(Katagiri et al. 2003)しかし,両DP細胞には表面を覆うSC細胞が認められなかった。このことから,DP細胞の軸索は細胞の分化の初期に,鞘構造に関与する支持細胞は後から形成されると考えられる。
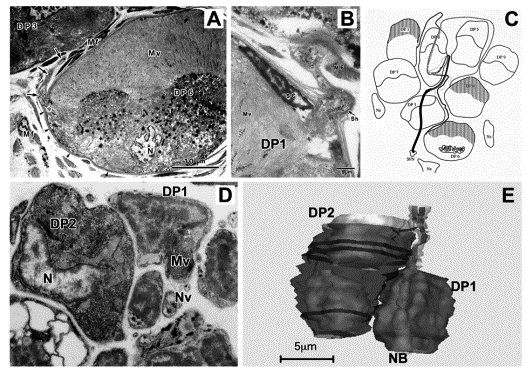 図の説明
(A) 成体のDP6細胞の軸索起始部(*)。細胞の左側面,端部の微絨毛基部から軸索が上方に出て,DP3細胞の間を通る。
(B) DP1細胞の軸索起始部。微絨毛(Mv)の表面を覆う支持細胞(SC)の核が存在,軸索の外表面には薄い鞘構造がある。
(C) DP細胞群。8個のDP細胞の軸索はいろいろな経路を経て,DP6細胞近くの小神経束に入る。
(D) 幼動物のDP1(右)とDP2(左)細胞の核のある部位。
(E) 再構築ソフトDelta Viewerによって,DP1(右)とDP2(左)細胞の形,核,微絨毛,軸索の起始部とその走行を構築した。両細胞の軸索は傍を通る小さな神経束(NB)に合流する(片桐ら 2009)。 |
10.精神疾患モデル動物を用いた脊髄内運動ニューロンの形態変化
坂本浩隆(岡山大学大学院・自然科学研究科・理学部附属臨海実験所)
河田光博(京都府立医科大学大学院・解剖学・生体構造科学)
有井達夫(生理学研究所・脳機能計測センター・形態情報解析室)
ラット球海綿体筋を支配する球海綿体脊髄核(SNB)は,腰部脊髄(L5-6)に存在し,雄優位の性的二型核を示す運動ニューロン群であり,陰茎勃起や射精など,雄の性行動に重要な役割を果たすことが知られている。一方,最近我々は,ガストリン放出ペプチド(GRP)の発現が雌に比べ,雄ラットの腰髄に有意に高いことを新規に見出した。ラット脊髄GRPニューロンは,L3-4付近に細胞体が存在し,L5-6に位置する勃起や射精を司る自律神経核にまで軸索を到達させていた。この腰髄GRP系は脊髄内に神経ネットワークを構築し,自律神経系を制御することにより,雄性性機能を調節していることを明らかにした(Sakamoto et al., 2008, Nature Neuroscience)。本研究では,GRP免疫組織化学法とSNBニューロンの逆行性標識法とを組み合わせることにより,超微形態学的にSNBニューロンの樹状突起上にGRP作動性のシナプス入力が存在するかを,超高圧電子顕微鏡を用いて解析した。ペルオキシダーゼ結合コレラトキシンbサブユニットにより逆行性標識されたSNBニューロンをテトラメチルベンジジン法で,また,GRP免疫組織化学法を従来のジアミノベンジジン法で,それぞれを可視化し,超高圧電子顕微鏡下で2者を区別することに成功した。その結果,SNBニューロンの樹状突起上にGRPを含む多くのシナプスが存在していることが明らかになった。球海綿体筋の収縮は勃起や射精に深く関与しており,SNBへの求心性GRPシナプス入力を介して性行動を制御している可能性が示唆された(Sakamoto, Arii, Kawata, Endocrinology, 2010: 151, 417-421)。現在,これらの逆行性標識法と免疫組織化学法とを組み合わせた先端的技術を利用して,超高圧電子顕微鏡下,多角的に解析を進めている。
以上の結果は,米国内分泌学会誌であるEndocrinology 誌(technical communication section)から発表した。また平成21年度に開催された形態科学の主要2学会である,第50回日本組織細胞化学会総会・学術集会,及び第115回日本解剖学会総会・全国学術集会でデータの一部を発表し,大きな反響を得た。
11.Three-dimensional analysis of mitochondrial formation dependent on the status of p53 tumor suppressor protein in human coloncells
Young Rok Seo (Department of Life Science,
Dongguk University-Seoul, Seoul 100-715, South Korea)
In response to ionizing radiation (IR), p53 has been known as a critical regulator of apoptosis. p53-dependent apoptosis via mitochondria has already been recognized by other researchers. Mitochondiral outer membrane permeabilization (MOMP) is one of the most prominent apoptotic checkpoint(s), and cytoplasmic p53 can induce MOMP by direct interactions with multi-domain proteins from BCL-2 family present at the mitochondrial outer membrane (MOM). Most of the studies previously performed related with functional aspects of mitochondrial formation, but none of them has focused on the alterations in mitochondrial structure via the p53-dependent apoptosis. In this study, we investigated the potential roles of p53 protein in mitochondria-dependent apoptosis employing a high voltage electron microscopy (HVEM). We observed mitochondria in HCT116 p53 wild and null type cells treated with IR. In order to definite understanding of alterations on mitochondrial formation, three-dimensional reconstruction is in progress using IMOD software. Our result might suggest a new approach to understand p53 function on mitochondria in human colon cells.
12.3-D Reconstruction of Plastid Crystalline Bodies during C-4 Cellular Differentiation (II)
Insun Kim (Keimyung University)
High voltage electron microscope (HVEM) has been used to reveal the distinctive structural pattern of the crystalline inclusions from cotyledons and shoot apical meristem of the C-4 Salsola. The research has been mainly focused on the initial stages of the plastid inclusions seen in varying degrees of the different cell types. The origin and formation of crystalline inclusion bodies (IBs) during C-4 cellular differentiation were examined for each tissue type. The IBs were formed only in the mesophyll (Fig. 1) and epidermal cells, but not in the bundle sheath cells as in the mature Salsola. The plastid IBs in both cell types exhibited paralleled and paracrystalline lattice structures, but the latter was more common in the epidermal cells. In the mesophyll plastids, usually one IB formed with membranous boundary, while the epidermal plastids developed more than one IB that occupied a major portion the plastid volume. The distance between paralleled elements in mesophyll plastid IBs was not consistent in the margin, whereas it was consistent and showed about 10.2nm distance, in the central area. Upon appression of the newly joined membrane elements to the IB margin, the distance among them became consistent with growing elements. The thylakoidal membranes that were adjacent to the IBs were related spatially to the elements in both cell types. The new elements of the growing IBs were probably derived from the thylakoidal membranes located next to the IB (Fig. 2, 3). On the basis of the plastid IB formation in the cotyledons and shoot apical meristem, it is suggested that their development initiated quite early during the C-4 Salsola cellular differentiation.
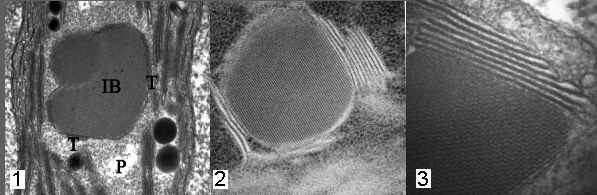 Fig. 1. The IB formed within the mesophyll plastid. A higher magnification of the mesophyll (Fig. 2) and epidermal IB (Fig. 3) showing the element origin from the thylakodal membranes. |
13.Ultra-structural Analysis of the Brain in a Drosophila model of Alzheimer’sdisease
Se Jin Park, Sung Sik Han (Laboratory of cell engineering and 3D structure,
School of Life Sciences and Biotechnology, Korea University, Seoul, Korea)
The mushroom body (MB) is one of the most clearly distinguishable neuropil structures in the insect brain. Many studies have suggested that the MB is important for olfactory learning in Drosophila. In Drosophila, mushroom bodies consist of a calyx neuropil, located postero-dorsally in the protocerebrum, which is assemble with a forward projecting pedunculus that, anteriorly, divides into an dorsal lobe extending upwards, and into medial lobe that extend towards the midline. Structural mutants of the MB disrupt the establishment of short and long term memories.
In brain, neurons are the cells of chemical communication and have many size, lengths, shapes, which determine their functions. Therefore, it is necessary the structural study of brain as a basis for brain research. To elucidate the anatomical basis underlying its function, we studied how the MB of Drosophila is organized by its intrinsic and extrinsic neurons. And to further advance understand the structure of MB, we analyzed the three-dimensional (3D) architecture of the calyx which one of MB region using a high voltage electron microscopy (HVEM), which has been effectively applied to study three-dimensional structure. We have attempted to make a 3D-reconstruction of testis structure in mip40 mutant using IMOD software. This research might the basis of understand neural structure of MB may underlie that how MB effect the brain function.
 Fully elongated Wild-type (A) and mutant (B,C,D) spermatids. (C,D) showing reconstruction and rendering image respectively. major mitochondria derivative is mostly filled with dark material in wild-type (A) Whereas in mutant showing mitochondria is sometimes lacking. scale bar; 500nm, in panel A, B |