シナプス蛋白質PSD-95の局在を調節する酵素の同定
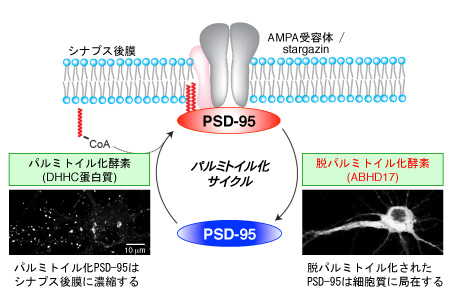
神経細胞間のつなぎ目であるシナプスは、記憶や学習を支える情報処理の場と考えられています。このシナプスが正しく機能するためには、様々な蛋白質が秩序だってシナプスに集積する必要があります。中でもPSD-95という蛋白質は、シナプスの大黒柱としてはたらき、シナプス形成やシナプス伝達を制御しています。このPSD-95がシナプス膜に局在するためには、パルミチン酸という脂肪酸(油の一種)がPSD-95に付加されることが必要です(パルミトイル化脂質修飾)。これまでに私共は、PSD-95をパルミトイル化する酵素としてDHHC蛋白質を同定してきました。また、PSD-95がシナプス膜に濃縮するには、単にPSD-95がパルミトイル化修飾を受けるだけでなく、持続的にパルミトイル化と脱パルミトイル化(パルミチン酸が蛋白質から外れる反応)が繰り返される必要があることを明らかにしてきました(パルミトイル化サイクル)。しかし、パルミトイル化サイクルのもう一翼を担う脱パルミトイル化酵素は不明でした。
今回私共は、機能があまり解明されていないセリン加水分解酵素群の中から、PSD-95を脱パルミトイル化する活性を有するABHD17酵素を見出しました。また、パルミトイル化された蛋白質の量比を検出することができる新しい手法(APEGS法と命名)を開発し、神経細胞におけるABHD17の効果を検討しました。そして、ABHD17を海馬培養神経細胞に過剰発現させると、パルミトイル化されたPSD-95の量が大幅に減少し、PSD-95とPSD-95に裏打ちされるAMPA受容体(神経伝達物質受容体)のシナプス局在が激減することを見出しました。逆に、ABHD17酵素の発現を抑制すると、PSD-95の脱パルミトイル化反応が大きく遅延することを見出しました。このように、私共はPSD-95脱パルミトイル化酵素の同定に成功し、新たなシナプス形成およびシナプス伝達の制御因子候補を見出しました。
今回は、ABHD17の機能を主に培養神経細胞を用いて解析しましたが、今後は動物個体レベルでの解析が待たれます。近い将来、ABHD17酵素を標的とした新たなシナプス伝達修飾薬剤の開発が期待されます。
用語説明
科研費・助成金情報
MEXT grants (15H04279, 15H01299, 26291045, 15H01570, 16H01371, 16K14560)
MHLW NCNP grant (H27-7)
武田科学振興財団、上原記念生命科学財団、小野医学研究財団、内藤記念科学振興財団、第一三共生命科学研究振興財団リリース元
Title: Identification of PSD-95 depalmitoylating enzymes
Authors: Norihiko Yokoi*, Yuko Fukata*‡, Atsushi Sekiya, Tatsuro Murakami, Kenta Kobayashi, Masaki Fukata‡
*N.Y. and Y.F. contributed equally to this work.
‡Corresponding authors (Y.F. and M.F.)
Journal of Neuroscience 36:6431-6444 (2016)
URL (abstract): http://www.jneurosci.org/content/36/24/6431.full
DOI: DOI:10.1523/JNEUROSCI.0419-16.2016

