Gタンパク質のアデノシンA1受容体活性型構造を安定化する作用はGタンパク質の種類により異なる
Gタンパク質共役型受容体(GPCR)は細胞膜に存在し、細胞外における生理活性物質を感知して細胞内に情報を伝えます。GPCRには多くの種類があり、多様な神経伝達物質やホルモンなどをそれぞれ選択的に感知できることから、薬剤の標的タンパク質としても捉えられています。
私たちの研究グループは、GPCRの構造変化を捉えるために、受容体の細胞内第3ループとC末端に異なる色の蛍光タンパク質を付加し、両者の間で起こるForster resonance energy transfer (FRET)の効率を経時的に計測しました。FRET効率は、蛍光タンパク質間の距離(10-8 m以内)に強く依存するため、その変化はGPCRの構造変化に対応するものと考えられます(下図参照)。
今回、アデノシン受容体1型(A1受容体)について解析したところ、作用薬であるNECAとの結合のみでは細胞内領域における顕著な構造変化は起きないが、Gタンパク質が結合することで大きな構造変化が起こることが明らかとなりました。この結果は、Gタンパク質との結合によりA1受容体の活性型構造が安定化するということを示します。さらに、結合するGタンパク質の種類により受容体の活性型構造の安定化作用の程度が異なることも明らかになりました。
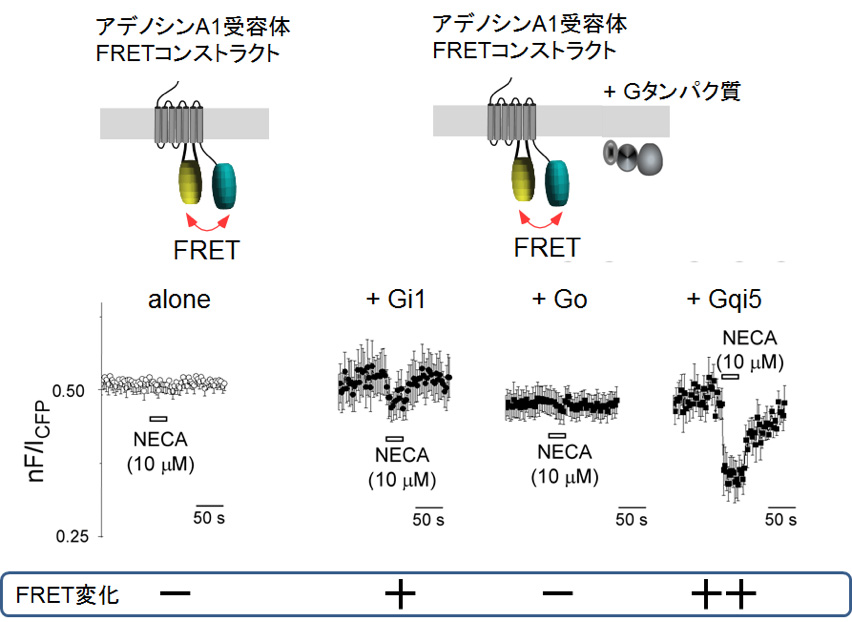
<図説明>
Gi/o共役型アデノシン受容体1型の細胞内第3ループとC末端に色の異なる蛍光タンパク質を付加したコンストラクト(アデノシンA1受容体FRETコンストラクト)を細胞膜上に発現させ、Gタンパク質との結合ができない条件下(左 のalone)と結合しうる条件下(右の +Gx)にて蛍光共鳴エネルギー転移(FRET)効率の計測を行いました。トレースは作用薬NECAの投与によるFRET効率の経時変化、すなわち構造変化を示します。Gタンパク質との結合がない条件下では、FRET効率の変化は認められませんでした。一方、Gタンパク質と結合しうる条件下では、結合するGタンパク質の種類に依存して大きさの異なるFRET効率の減少が観察されました。以上の結果から、A1受容体の活性型構造は、作用薬との結合だけでは安定せずGタンパク質とも結合することで安定となること、また、Gタンパク質の種類により安定化作用の程度が異なることが明らかになりました。
リリース元
Michihiro Tateyama, Yoshihiro Kubo
Stabilizing effects of G protein on the active conformation of adenosine A1 receptor differ depending on G protein type.
Eur J Pharmacol. 788:122-131, 2016
doi: 10.1016/j.ejphar.2016.06.025.

