タンパク質の品質管理酵素UGGTの柔軟な構造をクライオ電顕で可視化
細胞内の小胞体では日々沢山のタンパク質が製造され、細胞の必要な場所へと運ばれていきます。この小胞体には同時にタンパク質の品質管理をするシステムが存在し、うまく完成しなかった不良なタンパク質の折り畳み(フォールディング)や除去を行っています。この機能の一端を担っているのがUGGTと呼ばれる酵素タンパク質です。UGGTはフォールディングしなかったタンパク質を識別してこれに糖(グルコース)でできたラベルをつけていきます。この糖を目印としてシャペロンタンパク質(分子の介添え役)がタンパク質の折り畳みを助けます。
本共同研究では、このUGGTの構造をクライオ電子顕微鏡(クライオ電顕)で調べました。クライオ電顕で約2万粒子のUGGTの写真を撮影し、そこからUGGTの立体構造を再構築しました(図)。UGGTは4つのチオレドキシン様ドメイン(Tx1〜Tx4)とβドメイン(β-rich)からなる大きなセンサー部分とこれにつながった小さな触媒ドメインからなります。クライオ電顕構造からは、これらのドメインからなるセンサー部分がC字状に配置され、いく通りかの柔軟な構造をとることがわかりました。さらに高速AFM(原子間力顕微鏡)によるUGGT分子のリアルタイム観察から、本酵素の触媒ドメインはセンサー部分の近傍でダイナミックに動いていることがわかりました(論文参照)。
本結果から、タンパク質品質管理酵素UGGTは柔軟なC字型のセンサー部分でタンパク質のフォールディング状態をチェックし、不良であればセンサーに繋がった触媒ドメインでこれに糖をラベルする、その仕組みが明らかとなりました。本成果により、細胞内におけるタンパク質の品質管理の仕組みが解明され、これに関連する細胞疾患の治療法の開発に役立てるものと期待されます。
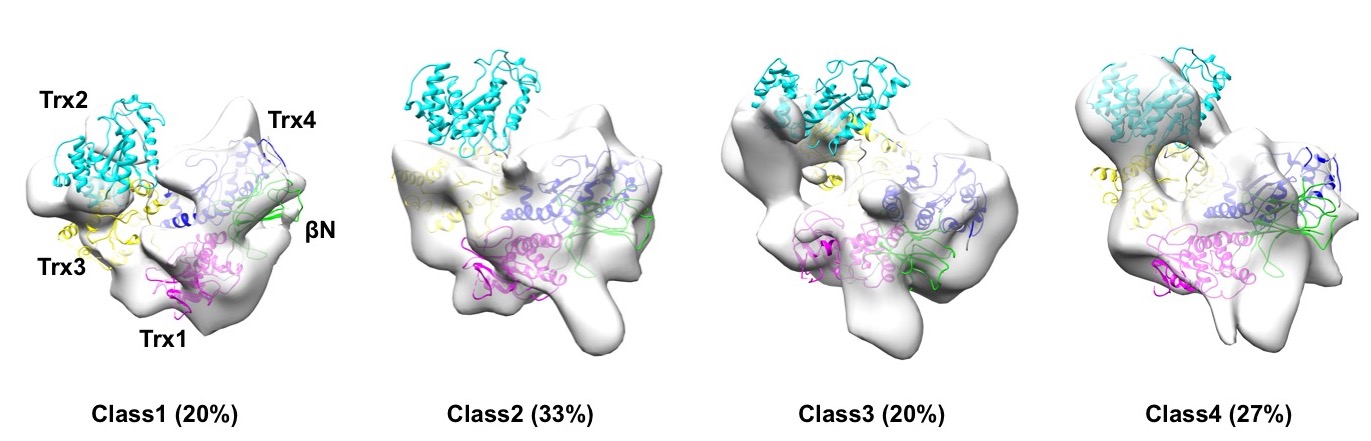
図:UGGTのクライオ電顕単粒子構造解析。クラス分けされた4つの三次元構造はC字型をしたセンサー部分が多様な基質を認識するために柔軟な構造をとることを示す。
共同研究者情報
佐藤匡史(名古屋市立大学)
加藤晃一(岡崎統合バイオサイエンスセンター)
ソンチホン、村田和義(生理学研究所)
科研費・補助金、助成金情報
戦略的創造研究推進事業(さきがけ)、科研費(新学術領域)、岡崎オリオンプロジェクト、創薬等ライフサイエンス研究支援基盤事業、先端バイオイメージング支援プラットフォーム、生理研共同研究、名古屋市立大学特別研究奨励費
リリース元
Title: Visualisation of a flexible modular structure of the ER folding-sensor enzyme UGGT
Authors: Satoh T, Song C, Zhu T, Toshimori T, Murata K, Hayashi Y, Kamikubo H, Uchihashi T, Kato K
Journal: Scientific Reports
Issue: 7:12142
Date: Sep. 22, 2017
URL: http://www.nature.com/articles/s41598-017-12283-w
DOI: 10.1038/s41598-017-12283-w

