凝集したタンパク質を再生するタンパク質ClpBの動的な構造変化を可視化
タンパク質は多数のアミノ酸がつながったできた分子で、それが複雑な立体構造を形成することで酵素として働きます。タンパク質の立体構造は熱などのストレスに弱く、構造が壊れたタンパク質はお互いに絡まって凝集してしまいます。例えば、ゆで卵の白身はタンパク質が凝集した例です。凝集したタンパク質は機能を失うだけでなく、生体にも悪影響を与えます。ClpBは、この凝集してしまったタンパク質を脱凝集して再生する特殊な機能を持つタンパク質です。
ClpBはリング状の6量体を形成して働きます。これまでの研究から、ClpBはATPの化学エネルギーを利用し、リング中央の孔に凝集したタンパク質をほぐしながら通すことで脱凝集すると考えられていました。しかし、ATPの結合と分解によって、ClpBの構造がどのように変化し、それがどのように変性したタンパク質を脱凝集させるのかなど、分子レベルの仕組みは分かっていませんでした。
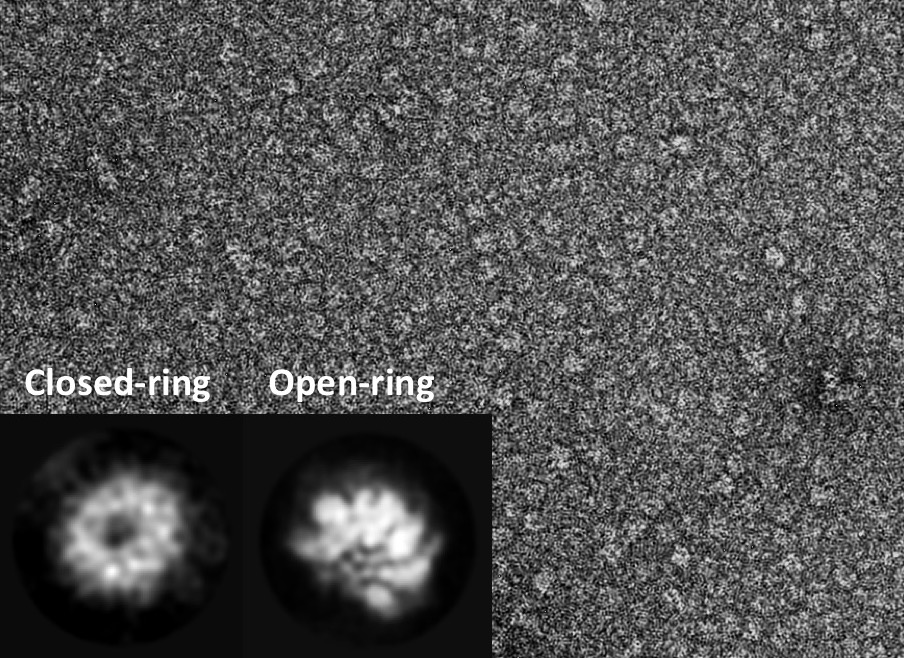
本研究では高速原子間力顕微鏡(AFM)という装置を用いてClpBの構造変化を100ミリ秒の時間分解能で観察することに成功しました。ATP存在下で観察したところ、6量体の「閉じたリング」と、リングの一部切れた「開いたリング」が観察されました。そして、本共同研究では、電子顕微鏡で個々のClpBの粒子像を分類して平均化することにより、確かに閉じたリングと開いたリングの両方のリングが存在することを確認しました。高速AFMの観察では、この閉じたリングと開いたリングは観察中に何度も行き来しており、ATPの濃度が高いほど閉じたリングの割合が増加しました。これらの結果から、ClpBはATPの結合によってその中心の孔に凝集したタンパク質を取り込んで閉じたリングを形成し、ATPを分解することにより脱凝集することが明らかになりました。
タンパク質の凝集は、ヒトではアルツハイマー病をはじめとする様々な疾患と深く関連しています。また酵素タンパク質の産業応用においても、タンパク質の凝集は大きな問題になります。本研究の成果は、こうした疾患の治療や酵素タンパク質の品質維持に貢献する可能性を秘めています。
共同研究者情報
飯野亮太(分子科学研究所)
内橋貴之、渡辺大輝(名古屋大学)
渡辺洋平、中崎洋介、山崎孝(甲南大学)
内山進、丸野孝浩(大阪大学)
石井健太郎(自然科学研究機構生命創成探究センター)
安藤敏夫(金沢大学)
ソン チホン、村田 和義(生理学研究所)
科研費や補助金、助成金などの情報
科学研究費補助金
自然科学研究機構岡崎統合バイオサイエンスセンターBIONEXT project
JST/CREST
リリース元
Title: Dynamic Structural States of ClpB Involved in Its Disaggregation Function
Authors: Takayuki Uchihashi, Yo-hei Watanabe, Yosuke Nakazaki, Takashi Yamasaki, Hiroki Watanabe, Takahiro Maruno, Kentaro Ishii, Susumu Uchiyama, Chihong Song, Kazuyoshi Murata, Ryota Iino & Toshio Ando
Journal: Nature Communications
Issue: 9, 2147
Date: 2018.6.10 publish & online
URL (abstract): https://www.nature.com/articles/s41467-018-04587-w
DOI: 10.1038/s41467-018-04587-w

