タンパク質分解酵素複合体プロテアソームの形成、解離のメカニズムに迫る
プロテアソームは細胞の中で不要なタンパク質を分解する酵素タンパク質複合体です。細菌からヒトまで類似のカゴ型構造を示し、その中に不要なタンパク質を閉じ込めて分解します。ヒトのプロテアソームでは、それぞれわずかに異なる7種類のタンパク質からなるαリングとβリングが、α-β-β-αのように連なってカゴを作っています。この7種類のタンパク質はそれぞれ順番にα1-7、β1-7と番号が付けられており、ヒトのプロテアソームは合計14種類のタンパク質から構成されることになります。では、なぜこのように14種類もの異なるタンパク質がミスなく綺麗に配列して4重のリングからかるカゴ構造を形成することができるのでしょうか?本研究では、生命創成探究センターの加藤晃一教授を中心とする共同研究チームが、分子生物学、物理化学の手法を用いて、そのプロテアソームのカゴ形成機構の一旦を明らかにしました。
同チームのこれまでの研究から、α7は、その7つが会合してリングを形成し、さらにこれが二つ重なった二重リング構造を取ることがわかっていました。さらに、これにα6を加えると二重リングが一重リングになることもわかっていました。本研究では、α4も同様にα7二重リングを一重リングにすることがわかりました。また、α7タンパク質の中で二重リングの内側に位置するアミノ酸を分子生物学の手法を用いて別のアミノ酸に置換することで、会合せず単独で存在するα7(以降α7*)を作製することに成功しました。さらに面白いことには、これにα6を加えると、14個のパーツが集まった二重リングになることを見出しました。α4でも同様の作用が見られました。生理研との共同研究では、電子顕微鏡による解析で、α4の添加によってα7が二重リングになることを示しました(図)。以上の結果から、プロテアソームのサブユニットは、その組み合わせによって様々な複合体をつくることがわかりました。
本成果は、生命進化の中で獲得されたヒトプロテアソームの形成、解離の分子メカニズムとその機能の解明に知見を与えるとともに、タンパク質の構造ブロックを使った分子機械の設計にも大きく役立つと期待されます。
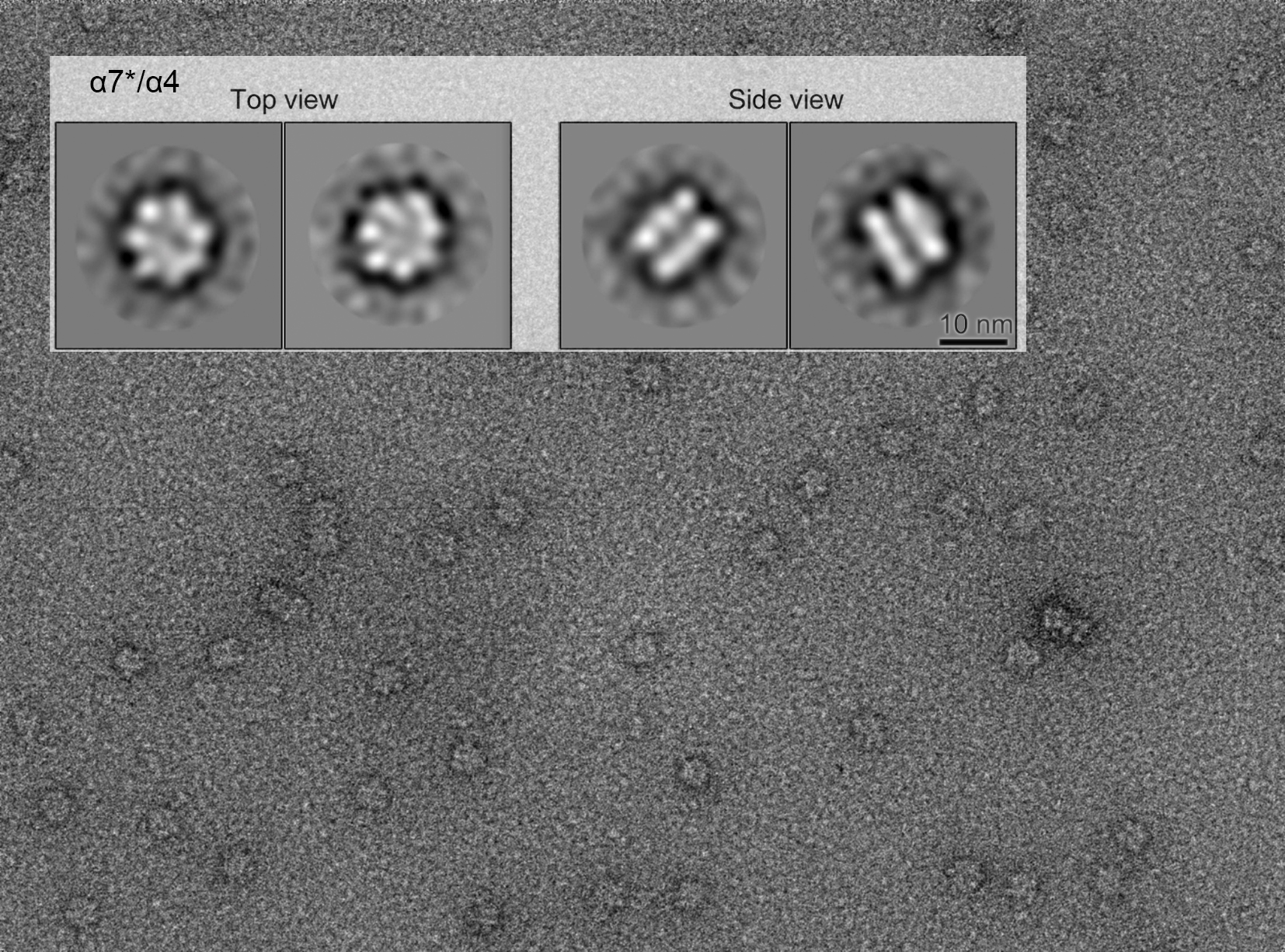 図 単独で存在するように遺伝子改変したヒトプロテアソームα7(α7*)は、α4の添加によって二重リングを形成した。
図 単独で存在するように遺伝子改変したヒトプロテアソームα7(α7*)は、α4の添加によって二重リングを形成した。
共同研究者情報
佐藤匡史、矢木宏和(名古屋市立大学)
谷中冴子、加藤晃一(生命創成探究センター・分子科学研究所)
ソン・チホン、村田和義(生理学研究所)
科研費や補助金、助成金などの情報
科研費、生命創成探究センター、総合研究大学院大学
リリース元
Title: Mutational and Combinatorial Control of Self-Assembling and Disassembling of Human ProteasomeαSubunits
Authors: Taichiro Sekiguchi, Tadashi Satoh, Eiji Kurimoto, Chihong Song, Toshiya Kozai, Hiroki Watanabe, Kentaro Ishii, Hirokazu Yagi, Saeko Yanaka, Susumu Uchiyama, Takayuki Uchihashi, Kazuyoshi Murata and Koichi Kato
Journal: International Journal of Molecular Sciences
Issue: 20(9), 2308
Date: 2019, May 9 Published
URL: https://doi.org/10.3390/ijms20092308
DOI: 10.3390/ijms20092308.

