栄養不足や抗がん剤投与によって心筋が衰弱(萎縮)するメカニズムを解明
生理研の西田基宏教授(九州大学教授兼務)と田中智弘特任助教(新分野創成センター兼任)は、マレーシア・サバ大学、タイ・マヒドール大学と共同研究を行ない、栄養不足で心臓の筋肉が衰弱(萎縮)するメカニズムを明らかにしました。心筋萎縮の引き金となる「TRPC3チャネルとNADPH酸化酵素(Nox2)とのタンパク質間相互作用」を阻害する薬を処置することで培養心筋細胞の萎縮が強く軽減できたことから、心筋の衰弱(萎縮)を軽減する新たな治療法の開発に貢献することが期待されます。
食欲減退や運動不足で生じる筋肉量の減少(廃用性筋萎縮)は、加齢や事故・病気の予後を悪くする原因になります。生まれてから死ぬまで働き続ける心臓の筋肉(心筋)も決して例外ではなく、栄養不足や虚血(低酸素)、抗がん剤投与によって萎縮が起こり、心筋萎縮が心臓のポンプ機能低下の原因につながると考えられます。しかし、心筋が萎縮するメカニズムはよくわかっていませんでした。私たちは心筋細胞を用いて、低酸素や栄養飢餓、抗がん剤処置によってエネルギー通貨であるアデノシン三リン酸(ATP)が細胞外に分泌され、細胞外のATPが心筋萎縮を誘導する引き金となることを見出しました。細胞外ATPは多くの細胞にとって「危険信号」であり、炎症や細胞死など様々な細胞応答を引き起こすことが知られています。私たちは、心筋細胞膜に発現するTRPC3チャネルとNOX2とのタンパク質間相互作用が細胞外ATPにより増大すること、TRPC3との結合により分解されなくなったNOX2が過剰に活性酸素を生成することで、心筋細胞の萎縮を誘導することを明らかにしました。反対に、TRPC3、NOX2いずれかの機能を薬理学的に阻害すると、細胞外ATPや栄養飢餓ストレスで惹起される心筋細胞の萎縮が顕著に抑制されました。以上の結果は、栄養飢餓ストレスによるTRPC3-NOX2タンパク質複合体形成が心筋萎縮の引き金となることを強く示唆しており、細胞外ATP受容体またはTRPC3-NOX2タンパク質間相互作用の直接的な阻害が心筋衰弱(萎縮)や廃用性筋萎縮の予防・緩和につながる可能性が期待されます。
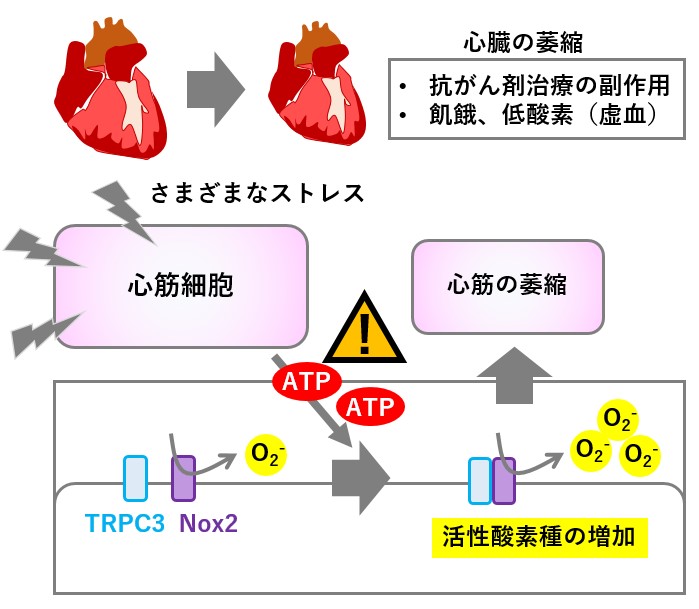
栄養不足や抗がん剤投与によって心筋が衰弱(萎縮)するメカニズム。様々なストレスにより細胞の重要なエネルギー通貨であるATPが細胞外に放出されると、細胞外ATPが危険信号として心筋細胞に作用し、病態特異的なTRPC3-Nox2タンパク質間相互作用を誘発します。TRPC3-Nox2相互作用はNox2を安定化し、活性酸素の生成量を増加させることで、心筋細胞を萎縮させます。
共同研究者情報
Suhaini Sudi (Universiti Malaysia Sabah)
Caroline Sunggip (Universiti Malaysia Sabah)
Supachoke Mangmool (Mahidol University)
冨田拓郎 (信州大学)
科研費や補助金、助成金などの情報
本研究は日本学術振興会の科学研究費補助金、文部科学省の新学術領域「酸素生物学」・「宇宙に生きる」、小野医学研究財団などの研究助成による支援を受けて行われました。
リリース元
Title: TRPC3-Nox2 axis mediates nutritional deficiency-induced cardiomyocyte atrophy
Authors: Suhaini Sudi, Tomohiro Tanaka, Sayaka Oda, Kazuhiro Nishiyama, Akiyuki Nishimura, Caroline Sunggip, Supachoke Mangmool, Takuro Numaga-Tomita, and Motohiro Nishida
Journal: Scientific Reports
Date: 2019 July 5
URL (abstract):https://www.nature.com/articles/s41598-019-46252-2
DOI:10.1038/s41598-019-46252-2.

