ホスホイノシチドはTPC3チャネルの2番目のリピートにあるS4電位センサーの動的構造変化を制御する
2021年11月30日
研究報告
細胞は主に脂質分子で構成される細胞膜によって区切られています。静止状態の細胞は、内側が外側に対して負の電位を帯びて分極しており、この分極の度合いを膜電位と呼びます。刺激によってこの膜電位が変化し、様々なシグナルを細胞に引き起こします。Two-pore型Na+チャネル(TPC)は、細胞膜に存在する膜タンパク質の1種であり、膜電位変化とともにホスホイノシチド(PI)という細胞膜に存在する特殊な脂質分子によっても制御されるイオンチャネルです。中でもTPC3は、PIが結合することで膜電位依存性が強く亢進されるという特徴を持ちます。
これまで、どのようにしてPIがTPC3の活性を制御しているのかについての詳細なメカニズムはよくわかっていませんでした。これを明らかにすべく、私たちはTPC3の分子内にある膜電位センサーである2nd S4に注目しました(図)。2nd S4は膜電位の変化に応じてその立体構造を変化させ、TPC3のチャネル活性を制御します。したがって、「PIは2nd S4の構造変化を制御しているのではないか」という仮説が考えられます。これを証明するためには、極めて小さな2nd S4の動きを検出しなくてはなりません。私たちは、PIが2nd S4の構造変化に与える影響を複数の手法を用いて検証しました。細胞膜の外側から投与した試薬が2nd S4に結合する速度の解析を行ったほか、2nd S4に蛍光分子を付与することで、その動きを検出し、構造変化を調べました。また、これと同じ実験を、PIに結合することができなくなる変異体TPC3や、PIの量を変化させる酵素の存在下で行いました。これらの実験の比較から、PIの存在に依存して2nd S4の動き方が変化することがわかりました (図)。
この研究の特徴の一つは、一般的な電気生理学的手法では検出することが難しい2nd S4自体の構造変化を、蛍光分子でラベルすることで検出できるようにすることで、それがPIの作用点であることを明確にした点です。TPC3と同様、他の多くのイオンチャネルは2nd S4によく似た膜電位センサーを持っており、今回得られた結果は将来これらのイオンチャネルに共通する作動メカニズムの解明に寄与することが期待されます。
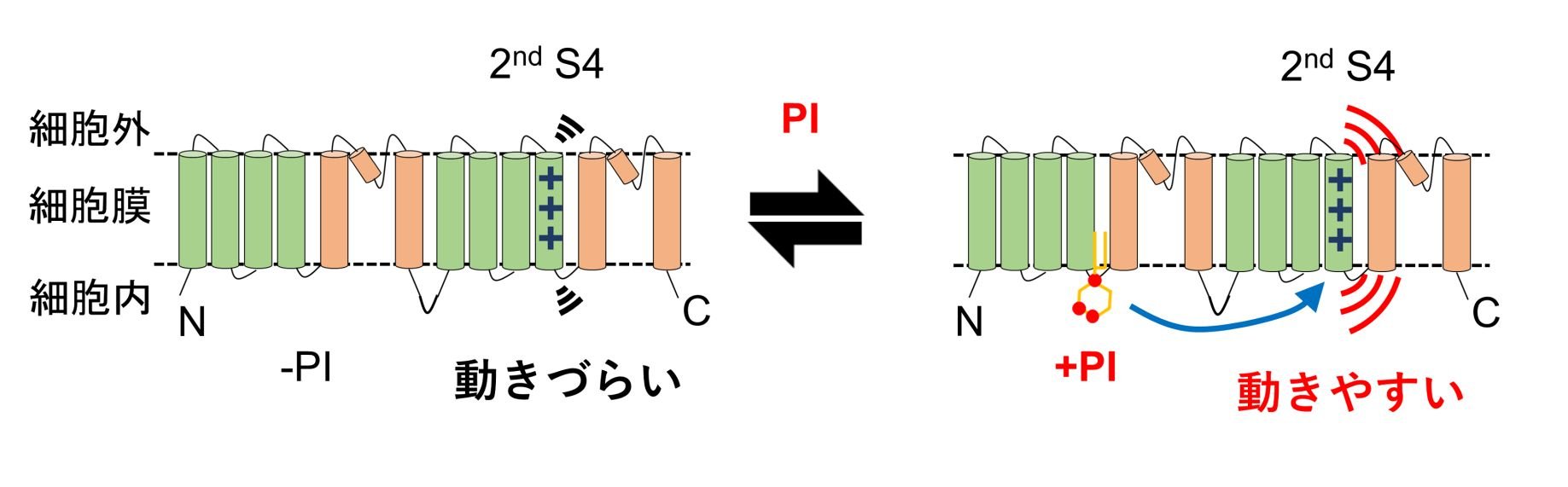
図 TPC3の分子構造ノモデル
科研費や補助金、助成金などの情報
科研費
リリース元
Title: Phosphoinositide regulates dynamic movement of the S4 voltage sensor in the 2nd repeat in Two-pore channel 3Authors: Ki-ichi Hirazawa, Michihiro Tateyama, Yoshihiro Kubo, Takushi Shimomura.
Journal: Journal of Biological Chemistry
Issue: [Online ahead of print]
Date: 2021 Nov 17
URL (abstract): https://www.sciencedirect.com/science/article/pii/S0021925821012345?via%3Dihub
DOI: 10.1016/j.jbc.2021.101425

