M2ムスカリン性アセチルコリン受容体のシグマ-1 受容体による抑制の構造基盤
2024年12月16日
研究報告
概要
シグマ-1 受容体 (S1R) は、薬物中毒、アルツハイマー病、筋萎縮性側索硬化症 (ALS) などのさまざまな病態に関与する多機能性シャペロンタンパク質である。 S1R は、主として小胞体の膜上に局在し、形質膜 (PM) 上の種々のイオンチャネルおよび受容体と相互作用する例が報告されている。 S1R は運動ニューロンにおいて M2ムスカリン性アセチルコリン受容体 (M2R) と近接局在することが報告されているが、これら 2 つのタンパク質間の機能的相互作用は知られていない。
本研究では、HEK293T細胞を in vitro発現系として用い、S1R によるM2R シグナル伝達の制御を、リガンドであるOxo-M投与によるM2R受容体活性化の指標として、GIRKチャネル電流の増加を電気生理学的に記録することにより、解析した。我々は、S1Rが、M2Rの活性化を介したGIRK1/2電流の増加を強く抑制するが、ALSに関連するS1Rの疾患変異体であるS1R E102Qは、抑制しないことを観察した(図1)。S1Rによる、活性化の抑制効果はM2Rに対して選択的であり、S1Rを、M4R、GABABR、mGluR2等の他のGi/o共役型受容体と共発現した場合には見られなかった。
活性化の抑制の構造基盤を明らかにする目的で、抑制を受けるM2Rと抑制を受けない M4R のキメラを用いて候補領域を絞り込み、さらに点変異体を用いて解析を行った。その結果、M2R の第6膜貫通ドメイン (TM6) の Ala401 および M2R の第2細胞外ループの Glu172 および Glu175 が、S1R による阻害に必須であることが明らかになった。Ala401については、M4RにM2R型となるT413A変異を導入することにより、活性化の抑制が獲得されることも観察された(図2)。
免疫共沈降実験により、M2R と S1R の間の物理的相互作用が確認された。HeLa細胞、HEK293T細胞、および培養海馬ニューロンに発現させた tag付きのM2RおよびS1Rの免疫細胞化学的解析により、M2RのPM上の発現が観察された。さらに、生状態でM2Rの細胞外tag に対する抗体を結合させた後に固定する方法により、PM上のM2Rの発現のみを定量的に解析した。その結果、S1Rとの共発現によって減少するが、依然としてPM上に明確に発現しており、活性化の強い抑制を説明することはできないことが明らかになった。また、M2Rの活性化の抑制を示さないS1R E102Q変異体を共発現させた場合でも、M2RのPM上の発現の低下はみられることが観察された。
以上より、S1Rとの相互作用により、M2RのPM上の発現が抑制され、さらにそれに加えてPM上に発現するM2Rの分子機能が強く抑制されること、その抑制にはM2RのTM6のAla401、および細胞外第2ループのGlu172とGlu175が関与していることが明らかになった。
本研究では、HEK293T細胞を in vitro発現系として用い、S1R によるM2R シグナル伝達の制御を、リガンドであるOxo-M投与によるM2R受容体活性化の指標として、GIRKチャネル電流の増加を電気生理学的に記録することにより、解析した。我々は、S1Rが、M2Rの活性化を介したGIRK1/2電流の増加を強く抑制するが、ALSに関連するS1Rの疾患変異体であるS1R E102Qは、抑制しないことを観察した(図1)。S1Rによる、活性化の抑制効果はM2Rに対して選択的であり、S1Rを、M4R、GABABR、mGluR2等の他のGi/o共役型受容体と共発現した場合には見られなかった。
活性化の抑制の構造基盤を明らかにする目的で、抑制を受けるM2Rと抑制を受けない M4R のキメラを用いて候補領域を絞り込み、さらに点変異体を用いて解析を行った。その結果、M2R の第6膜貫通ドメイン (TM6) の Ala401 および M2R の第2細胞外ループの Glu172 および Glu175 が、S1R による阻害に必須であることが明らかになった。Ala401については、M4RにM2R型となるT413A変異を導入することにより、活性化の抑制が獲得されることも観察された(図2)。
免疫共沈降実験により、M2R と S1R の間の物理的相互作用が確認された。HeLa細胞、HEK293T細胞、および培養海馬ニューロンに発現させた tag付きのM2RおよびS1Rの免疫細胞化学的解析により、M2RのPM上の発現が観察された。さらに、生状態でM2Rの細胞外tag に対する抗体を結合させた後に固定する方法により、PM上のM2Rの発現のみを定量的に解析した。その結果、S1Rとの共発現によって減少するが、依然としてPM上に明確に発現しており、活性化の強い抑制を説明することはできないことが明らかになった。また、M2Rの活性化の抑制を示さないS1R E102Q変異体を共発現させた場合でも、M2RのPM上の発現の低下はみられることが観察された。
以上より、S1Rとの相互作用により、M2RのPM上の発現が抑制され、さらにそれに加えてPM上に発現するM2Rの分子機能が強く抑制されること、その抑制にはM2RのTM6のAla401、および細胞外第2ループのGlu172とGlu175が関与していることが明らかになった。
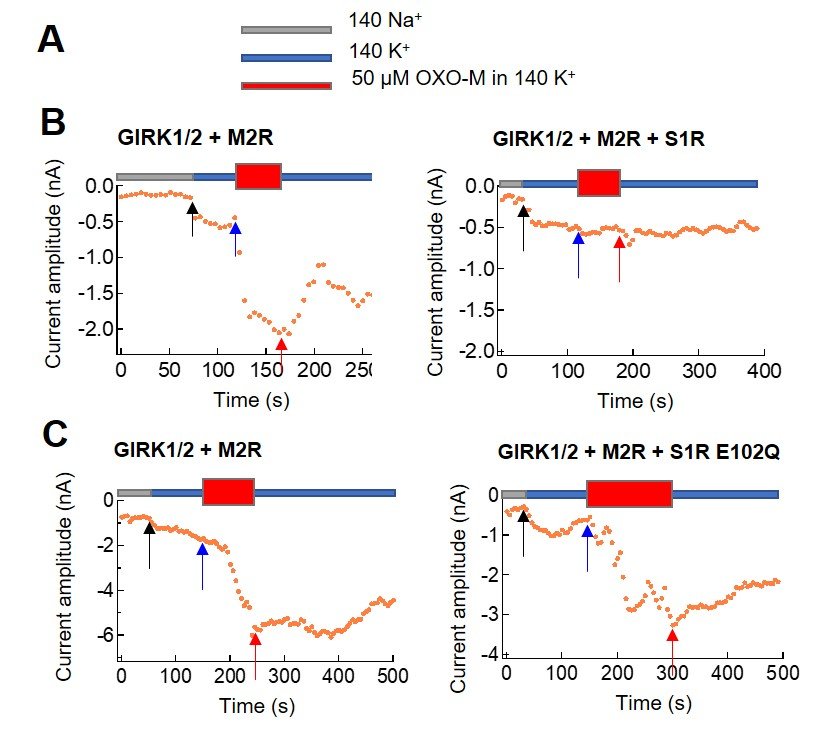
図1: S1R wtおよび変異体による、M2Rの活性化の抑制の、GIRK電流変化を指標とした解析 (A) 用いた外液の説明。Oxo-Mは、M2Rを活性化するリガンドである。 (B) S1R wt の共発現(右)により、Oxo-M投与時のM2R活性化によるGIRK電流の増加は抑制された。(C) S1R E102Q変異体の共発現(右)によっては、抑制されなかった。
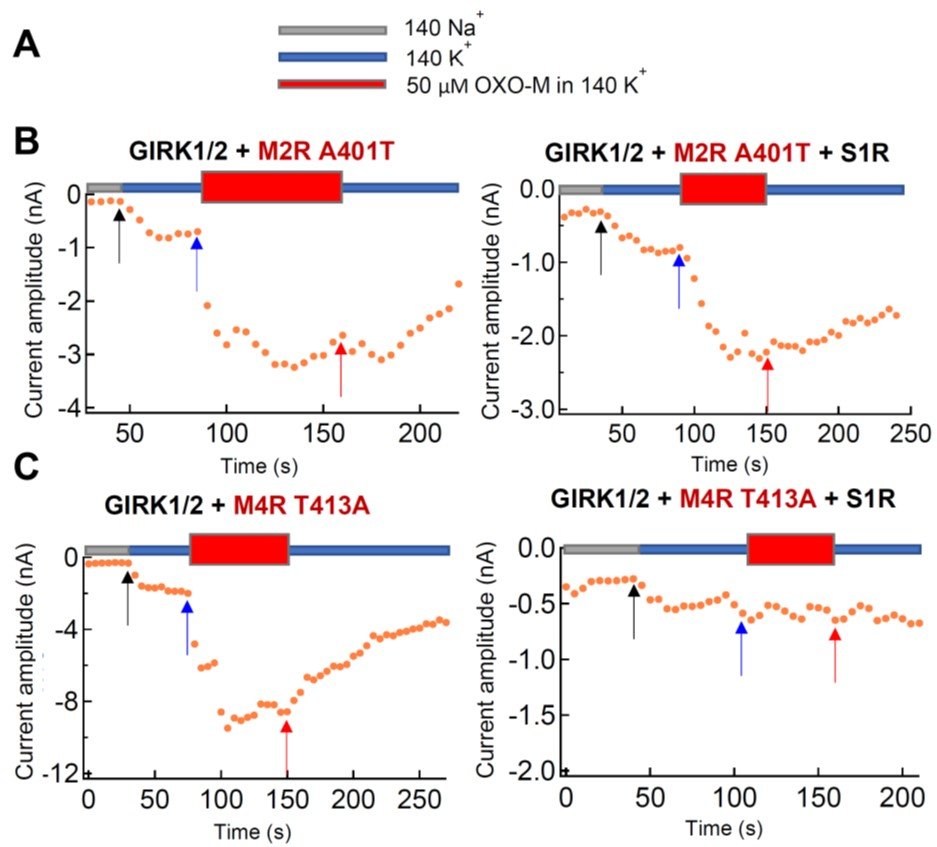
図2: S1Rによる、M2RおよびM4R変異体の活性化の抑制の、GIRK電流変化を指標とした解析 (A) 用いた外液の説明。Oxo-Mは、M2Rを活性化するリガンドである。 (B) M2Rの膜貫通第6 ドメイン (TM6) の A401T変異体では、 S1R wt の共発現(右)により、Oxo-M投与時のM2R活性化によるGIRK電流増加の抑制が失われた。(C) M4RT413変異体 (M2RのA401Tに対応する逆変異)では、S1R wt の共発現(右)による、Oxo-M投与時のM4R活性化によるGIRK電流増加の抑制が獲得された。
担当研究者情報
Chang Liu (NIPS Research Fellow)Yoshihiro Kubo (Professor)
論文情報
Journal of Biological Chemistry (2024) 300(12):108006Structural determinants of M2R involved in inhibition by Sigma-1R
Liu C, Chen IS, Barri M, Murrell-Lagnado R, Kubo Y.
PMID: 39551139
DOI: 10.1016/j.jbc.2024.108006.

