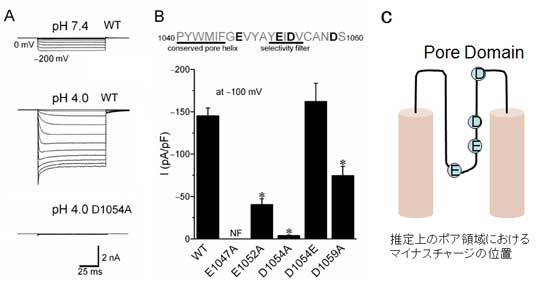
TRPM7のプロトン電流とその分子基盤
(A)hTRPM7を発現したHEK293T細胞で記録したプロトン電流。酸によってプロトン電流の増大が見られた。D1054A変異ではプロトン電流が見られなくなった。
(B)ポア領域の負電荷アミノ酸の中性化点変異によるプロトン電流の抑制。負電荷を維持したD1054E変異では影響を受けない。
(C)TRPM7のS5-S6間の推定上のポア領域を示す模式図。
Proton Conductivity via TRPM7: Its Molecular Determinants
TRPM7 is a divalent cation-permeable channel which is ubiquitously expressed.
Here, we demonstrated that human TRPM7 expressed either heterologously or endogenously exhibits proton conductivity. The gene silencing of TRPM7 by siRNA suppressed H+ currents in human cervical epithelial HeLa cells. In HEK293T cells transfected with human TRPM7, the inward proton conductance was suppressed by extracellular Mg2+ and Ca2+ with the IC50 values of 0.5 and 1.9 mM, respectively. Anomalous mole fraction behavior of H+ currents in the presence of Mg2+ or Ca2+ indicated that these divalent cations compete with protons for binding sites. Systematic mutation of negatively charged amino acid residues within the putative pore-forming region of human TRPM7 into the neutral amino acid alanine was then tested. E1047A resulted in non-functional channels and D1054A abolished proton conductance, whereas E1052A and D1059A only partially reduced proton conductivity. Thus, it is concluded that D1054 is an essential determinant of the proton conductivity, whereas E1047 might be required for channel formation; and the remaining negatively charged amino acids in the pore region (E1052 and D1059) may play a facilitating role in the proton conductivity of human TRPM7. It is suggested that proton conductivity of endogenous human TRPM7 plays a role in physiologically/pathologically acidic situations.
Copyright(C) 2008 National Institute for Physiological Sciences All rights reserved.
Last modified: 2008.4.17