1.イオンチャネル・受容体の動的構造機能連関
柳(石原)圭子,市島久仁彦(佐賀大学医学部)
久保義弘(生理学研究所)
内向き整流性Kチャネルは筋や神経細胞などの興奮性細胞のみならず,様々な非興奮性細胞において多くの重要な生理機能を担っている。内向き整流性K+チャネルのポアを形成するaサブユニットには多くの異なる種類のサブファミリーに属するものが存在し,それらが形成するチャネルは,電流の膜電位依存性のみならず,チャネルの活性を制御する機構において違いがみられることが知られている。われわれはこれまで膜のホスファチジルイノシトールリン脂質 (PIP2) に対する親和性が高く,常に高い活性を示すチャネルを形成するKir2.1とPIP2に対する親和性が比較的低くG蛋白質による活性調節受けるチャネルを形成するKir3.1やKir3.4の組み合わせがヘテロ多量体を形成することを示す証拠を集積してきた。本年度は新たに詳細な免疫共沈実験データの解析を行い,特にKir2.1とKir3.1サブユニットが会合を行う証拠として,Kir2.1との共発現によってKir3.1に糖鎖が付加されたサブユニットが出現することを見出した。また,その他の内向き整流性Kチャネルサブユニットについても同様の免疫共沈実験と解析を行い,Kir2.2やKir2.3サブユニットもKir3.1と会合するが,Kir4.1とKir3.1の組み合わせは会合しないことを示唆する結果を得た。以上の事から,Kir2サブファミリーのサブユニットとKir3.1やKir3.4サブユニットとの会合が,様々な組織の細胞にみられる内向き整流性Kチャネル電流の空間的・時間的多様性に寄与している可能性が示された。
2.G蛋白質共役応答の調節に関する分子生物学的研究
齊藤 修,藤井聖司,清原啓史,黒木麻湖
(長浜バイオサイエンス大学バイオサイエンス学部)
久保義弘(生理学研究所)
RGSタンパクは,Ga のGAP能をもつG蛋白質共役受容体系の調節因子である。そのうち,最もプロトタイプ的なRGSが,B/R4ファミリーである。最近の研究からこのB/R4RGSは,GaGAPでありながら何らかの機構で特定の受容体系を識別・選択して作用するファミリーであることが分かってきた。これまでに我々は,B/R4メンバーのRGS8が,Gaiタンパクに親和性の高いGAPであることを明らかにし,一方Gq系の機能解析を行うと,同じGq受容体でもムスカリン受容体のM1にM3より高い選択性で調節能を示すことを見出した。そして,この受容体選択性の機構の一つとして,RGS8とM1受容体が直接結合することを明らかにした。更に,昨年,Two hybridスクリーニングにより,RGS8結合蛋白質として見出した足場タンパクspinophilin (SPL) が,RGS8の間接受容体認識に寄与する因子であることを見出した。即ち,M1-RGS8複合体にSPLが共存すると,新たにM1-SPL-RGS8複合体に移行し,より効率的にM1系をRGS8が制御出来るようになったのである。それでは,SPLは他のムスカリン受容体にも結合できるのだろうか? もしそうであれば,本来RGS8の選択性の弱いM3受容体系に対しても,SPLの存在で調節能が獲得されるかもしれない。本年度は,M3Gq受容体系に注目して,RGS8とSPLがどのような効果をもつのか検討を行った。まず第一に組換え蛋白質を用いたプルダウン実験を行い,SPLがM3受容体に結合しうることを明らかにした。そして次にRGS8の弱いM3系調節能がSPL存在下でどう変化するか,カエル卵母細胞の発現系を用いた電気生理学的解析を行った。結果,RGS8はやはり単独では弱いM3系の抑制能しか示さないこと,しかしRGS8にSPLが共存すると,非常に強くM3系が抑制されることが明らかになった。また,RGS8の発現レベルをウエスタン法で解析するとSPLの有無での発現変化は検出されなかった。これらのことから,RGS8のGq受容体調節の選択性は,SPL非存在下ではM1優先的であるが,SPL存在下ではM1とM3どちらに対しても十分な作用を示せるようになることが明らかになり,SPLにはB/R4RGSの作業効率だけでなく新たな受容体選択性に変える機能があることが明らかになってきた。
3.比較ゲノムにもとづく哺乳類神経系機能素子の解析
岡村康司,藤原祐一郎(大阪大学大学院医学系研究科・生命機能研究科)
髙橋國太郎(東京大学名誉教授)
田中資子(鈴鹿医療科学大学薬学部)
西野敦雄(大阪大学大学院理学研究科生物科学専攻)
岡戸晴生(財団法人東京都医学研究機構東京都神経科学総合研究所分子神経生理)
平井志伸(東京医科歯科大学大学院生体支持組織学系専攻
支持分子制御学講座病態代謝解析学分野)
久保義弘(生理学研究所)
電位依存性イオンチャネル,電位センサー蛋白,受容体チャネルの機能を,尾索動物ホヤと哺乳類の間で比較することを目的として以下の実験を行った。
1.ベニボヤ2細胞胚から分離し,細胞分裂を抑制した全能性で等価でかつ同期して発生した2個の2細胞胚半側細胞を初期の8細胞期にいたる時点で,2個の細胞の細胞分裂を抑制しながら,それぞれ別の中胚葉誘導物質を作用させたのち接着し,ダブレットを作成し培養する実験系を確立した。パッチクランプ法により電流を計測し,Ca2+電流とdelayed K+電流が確認され,筋細胞様の分化が誘導されることが明らかになった。
2.以前ゲノムの網羅解析により明らかにしたカタユウレボヤ由来のグルタミン酸受容体のうち,AMPA型グルタミン酸受容体Ci-GluR1をアフリカツメガエル卵母細胞に発現させ,機能解析を行った。それ単独では電流を確認できないが,哺乳類GluRとのキメラを作成すると電流活性が確認された。発現系との相性の問題があり理由は明らかでないが,Ci-GluR1は機能的な受容体チャネルであると考えられる。In situ hybridization法により遺伝子発現の解析を行ったところ,脳胞の一部の細胞に発現が確認され,神経回路の限局した領域で使われている可能性が示唆された。
3.カタユウレイボヤのアセチルコリン受容体のうち,神経筋接合部に局在するアセチルコリン受容体チャネル(Ci-nAChR-A1,-BGDE3,-B2/4の複合体)は,脊椎動物の神経型ニコチン受容体のグループに含まれるサブユニットであるCi-nAChR-B2/4を含んでおり,ツメガエル卵母細胞においてこれらの複合体を発現させると,哺乳類の神経型ニコチン受容体と類似のCa2+透過性と内向き整流性を示す。ホヤにおいてこのCa2+透過性の生物的意義を明らかにするため,Ca2+透過性を持たないBGDEサブユニットの変異体を作成した。この変異体をアクチンpromoterを用いてホヤ幼生の筋細胞に強制発現させたところ,なめらかな遊泳運動ができず,断続的で唐突な筋収縮を示した。このことから,Ca透過性はホヤの神経筋接合部において円滑な遊泳をとるための筋細胞のCa2+ シグナル形成に必要であることが示唆された。
4.高次脳神経機能構築を支えるニューロン移動と神経軸索投射の制御基盤
鹿川哲史,清水健史,渡辺啓介(熊本大学)
増田知之(福島県立医科大学)
脊椎動物の中枢神経系発生期に見られるニューロン配置と神経投射は脳神経系回路形成の基礎過程であり,成体脳の高次機能発現に極めて重要である。細胞の動きは細胞外刺激及び,これに応答した細胞内シグナル伝達の活性化が細胞骨格の重合と脱重合を引き起こすことにより調節されている。後根神経節ニューロンから脊髄への投射は脊髄背側から進入することが知られていたが,その分子基盤はわかっていなかった。我々は脊髄腹側に発現するNetrin-1がDRG神経軸索の伸長を反発させることを見いだした。DRGニューロンはNetrin受容体であるUnc5cを発現しており,netrin-1遺伝子変異マウスやnetrin-1遺伝子を過剰発現させたニワトリのDRG神経軸索は誤投射が見られた (Masuda et al., 2008 published in J. Neurosci)。
また,我々は中枢神経系の初期発生において神経上皮細胞の分裂とニューロン分化という2つの事象が連動することに興味を持ち,両者を連携させる細胞内シグナル経路のクロストーク分子としてGSK3b(glycogensynthase kinase3b)を報告した(Shimizuetat.,2008published in MCB)。培養神経上皮細胞に恒常活性化型GSK3bを強制発現させると細胞は増殖を停止し,ニューロン分化が有意に亢進された。細胞増殖因子非存在下においても,神経上皮細胞の培養にGSK3bの特異的アンタゴニストであるSB216763を添加すると,BrdU陽性の分裂細胞が増加し,Tuj1陽性ニューロンの数が減少した。興味深いことに子宮内エレクトロポレーション法を用いて大脳皮質神経上皮細胞のGSK3bをノックダウンすると,正常ではニューロンへの分化が始まると同時に見られる脳室から脳の外層に向かう細胞移動も阻害された。以上の結果から,神経上皮細胞に内在するGSK3b及びその下流エフェクターであるbカテニンが神経上皮細胞の増殖・分化・細胞移動を連動させる重要な機能分子であることが考察された。
5.脱髄後のミエリン再生過程におけるミクログリアの解析
馬場広子,山口宜秀,石橋智子,大谷嘉典(東京薬科大学薬学部)
ミエリンの形成や再生の調節機序は未だ不明な点が多い。我々はこれまでに,中枢神経系のミエリン形成時期に一致して一時的に白質のミクログリアが活性化し,特異的な遺伝子発現をすることを見出している。この活性化ミクログリア自体あるいはそれに特異的に発現する遺伝子(ホスフォリパーゼD4; PLD4)が,ミエリンの形成や脱髄後の再生にどのように関与するかを明らかにする目的で,脱髄モデルマウスのミエリン再生時におけるミクログリアの変化を解析した。生理学研究所池中一裕教授が所有するPLPトランスジェニックマウスのヘテロ接合体は,生後いったんミエリンが形成された後,徐々に脱髄が進行する。そこで,これを脱髄モデルマウスとして使用した。
生後4.5ヶ月齢のPLPトランスジェニックマウスを灌流固定し,小脳のパラフィン切片を作製した。ミエリン塩基性タンパク質 (MBP) 抗体による染色の結果,小脳白質に多数の脱髄部位が認められた。ミクログリアのマーカーであるIba1の染色から脱髄部位中心に活性化ミクログリアが多数出現し,それらの細胞体にはPLD4が強染色されていた。一方,野生型では,ラミファイドミクログリアのみが観察され,PLD4抗体では核がうすく染色された。この結果から,PLD4は正常な発達期以外に脱髄・再生といった白質の病的状態で活性化するミクログリアにも発現が増加することがわかった。
培養ミクログリア細胞株の解析結果から,PLD4はLPS刺激後に核内で増加し,さらに活性化して貪食を開始すると食胞に集積することがわかった。また,SiRNAを用いた発現抑制実験からはPLD4が貪食に関わることが示唆された。
以上の結果から,生後の発達期や脱髄時に活性化したミクログリアが,増加したPLD4などの働きによって死んだオリゴデンドロサイトを処理し,髄鞘形成を促すのに関与する可能性が考えられた。PLPトランスジェニックマウスでは,生後4ヶ月齢頃までは脱髄と再生のバランスが保たれるが,その後髄鞘再生能力は低下すると言われている。今後,培養系でPLD4自体の機能解析を継続すると共に,髄鞘再生能の変化とミクログリアでのPLD4自体の発現変化との関連性を見ていく必要があると考える。
6.ニューロン樹状突起の維持・管理を担う分子基盤の解明
榎本和生(国立遺伝学研究所・新分野創造センター・神経形態研究室)
深田優子,深田正紀
私どもはショウジョウバエ感覚ニューロンをモデルとしてニューロン樹状突起形成を規定する分子機構の網羅的同定を行っている。これまでに,ショウジョウバエの遺伝学的手法により樹状突起の受容領域の維持・管理に中心的役割を果たしている遺伝子としてNdrキナーゼを世界に先駆けて同定した (Emoto et al, Nature 2006, Cell 2004)。Ndrキナーゼは,脳神経系に強く発現するリン酸化酵素であるが,その制御機構や基質特性については殆ど情報が無い。本研究では,主として生化学的手法を用いて,Ndrキナーゼの上流,または下流に位置する分子群を同定し,シグナル伝達系の全容解明を目指す。今年度は,樹状突起形成に重要な役割を果たすNdrキナーゼ複合体をショウジョウバエ脳より免疫沈降し,複数の共沈降分子をゲル内消化法と高感度質量分析法により同定することに成功した。さらに,ゲル内消化法では同定が困難な微量な複合体構成蛋白質の同定をshot gun法にて検討している。これらの解析を基に,樹状突起の維持・管理を分子基盤の全容が解明されることが大いに期待される。
7.海馬長期抑圧におけるAMPA受容体細胞内移行動態の生化学的,
細胞生物学的解析
向井秀幸,西本明正(神戸大学自然科学系先端融合研究環バイオシグナル研究センター)
深田優子,深田正紀
長期抑圧 (Long-term depression, LTD) についは,記憶・学習などの高次神経機能を細胞レベルで解き明かすためのモデル系として活発な研究がなされており,そのメカニズムとしてAMPA受容体とくにGluR1およびGluR2の細胞内移行が示唆されている。本研究では,種々の条件下におけるGuR1, GluR2の細胞内移行を定量的に,またダイナミックにとらえるための実験系の構築を目的とした。
まず,ラット海馬より初代神経培養細胞を採取し,長期にわたって安定に培養することができる培養条件を確立した。次に,pH感受性GFPとGluR1, GluR2との融合タンパク質 (SEP-GluR1, GluR2) を初代培養神経細胞に効率よく発現させ,細胞表面上のGluR1, GluR2の動態を可視化することを試みた。詳細な条件検討の結果,細胞表面に発現するGluR1および,GluR2の動態を生細胞レベルで可視化するための条件を構築することができた。今後はこれらの実験系を基盤に,神経細胞に種々の処理を施した際に(例えばNMDAをバスアプライしてケミカルLTDを誘発する等),GluR1, GluR2の動態がどのように変化するかについて検討を進めていく予定である。さらに,種々の遺伝子改変マウスに対しても応用していく予定である。
8.脂肪細胞の細胞容積・肥大化をモニターする分子機構の解析
河田照雄,高橋信之,後藤 剛(京都大学大学院農学研究科 食品生物科学専攻)
岡田泰伸(生理学研究所)
脂肪細胞では,その容積が約1~2万倍まで肥大化し,しかも可逆的に維持される。近年,脂肪細胞の肥大化が生活習慣病を将来する主要因となっていることが明らかにされ,脂肪細胞における容積制御機構は,細胞生理学的のみならず,病態生理学的にきわめて重要である。そこで本研究では,脂肪細胞が,自身でその発達度合いをどのようにモニターして,その形態形成・容積維持・肥大化制御を行っているかを分子細胞生物学的に解明することを目指した。
申請者らは,これまでの共同研究において,脂肪細胞におけるカルシウムシグナルが分化抑制に作用することを明らかにした。本年度の共同研究では,その分子メカニズムを明らかにするため,脂肪細胞分化に必須である核内受容体PPARg(ペルオキシゾーム増殖剤応答性受容体g )の活性化に着目し,そのゲルシフトアッセイを実施した。その結果,細胞内カルシウムイオンの上昇により,有意にPPARgの活性化が抑制される結果を得た。さらに,このカルシウムイオンによる活性化抑制作用は,脂肪細胞内でのPPARg標的遺伝子誘導を抑制するに十分であることをリアルタイムPCR法によるPPARg標的遺伝子の発現解析で明らかにした。このPPARg活性化抑制に関与する細胞内カルシウムイオン濃度の上昇は,生理学研究所におけるカルシウムイメージングによって観察を行った(論文投稿準備中)。
また,細胞の大きさをモニターするセンサー分子として,脂肪細胞の分化に伴い発現が上昇する非選択性カチオンチャネルであるTRPV2に着目し,研究を進めている。このTRPV2は機械刺激に応答することが報告されているが,脂肪細胞を用いたカルシウムイメージング法では,低浸透圧刺激によるTRPV2の活性化は観察されなかった。TRPV2の機械的刺激に対する応答には,他の調節タンパク質が必要であることが報告されており,今後,そうした調節タンパク質の脂肪細胞における発現を検討する必要があると考えられる。
9.色の情報処理に関連するサル大脳皮質領域の線維結合の研究
一戸紀孝(弘前大学 医学研究科 神経解剖・細胞組織学講座)
Kathleen S. Rockland,黒谷 亨(理化学研究所 脳科学総合研究センター
脳皮質機能構造研究チーム)
小松英彦,坂野 拓(生理学研究所 感覚認知情報研究部門)
近年,生理研小松研究室グループはじめとして,世界のいろいろな研究グループによりヒトを含む霊長類の脳内に色の選択性の高い領域の報告が相次いでいる。本研究は,この色関連領野のうち,小松グループの見いだしたサルTE野とTEO野にある色関連領野(以下それぞれTEcolourとTEOcolour)への入力および相互的結合を明らかにし、これらの領域の色に対する選択性の高さの機能構造的基盤を検討することを目的とする。これまで,合計4頭(以下サルA-D)のニホンザルを用いてこの目的に沿った実験を行った。サルAにおいては,TEcolourが存在すると考えられる前中側側頭溝の尾側端外側に逆行性のトレーサーCTB-Alexa 488を注入したところ,TEOcolourが存在すると考えられる後内側側頭溝周囲に強い標識が見られた。サルBにおいては,電気生理学的にTEOcolourを同定し,その一部にCTB-Alexa 488を注入したところ,やはりTEcolourがあると想定される前中側側頭溝後端領域に強いラベルが見られた。サルCにおいては,TEcolourおよびTEOcolourを電気生理的に同定し,TEcolourにCTB-Alexa 488を,その近傍であるが色の選択性の低い場所に別な蛍光色素をタグしたCTB-Alexa 555を注入したところ,CTB-Alexa 488標識細胞は,電気生理学的にmappingした領域の範囲内においてTEOcolour内に多く見られ,CTB-Alexa 555標識細胞は,色選択性の低い場所に多く見られた。サルDにおいては,やはりTEcolourおよびTEOcolourを電気生理学的に同定し,TEOcolourに今度は順行性のトレーサーを注入したところ,現在まだ解析中であるが,すくなくともTEcolour内に標識が見られるようである。これらの,データはTEcolourとTEOcolourに直接の投射があることを示唆している。また,本研究により標識が下側頭葉,前頭葉,V4の上で述べた領域以外の部位でも見いだされた。これらのデータと過去,現在の小松グループや他のグループの脳機能解析の手法で得られた知見をあわせて解析し,色認知のネットワークを検討したいと考えている。
10.X11/X11L ダブルノックアウトマウスの電気生理学的解析
齋藤有紀,中矢 正,鈴木利治(北海道大学大学院薬学研究院)
井上 剛,井本敬二(生理学研究所)
提案代表者によって単離されたX11L分子,およびその関連遺伝子であるX11分子は,神経系におけるアダプター分子として広く知られている。これらの分子の生理機能を明らかにするため,提案代表者はこの両分子のダブルノックアウトマウスを作成してきた。そこで本共同研究では,このダブルノックアウトマウスおよび両シングルノックアウトマウスにおける海馬 (hippocampus) と嗅内皮質 (entorhinal cortex) の電気生理学的解析を行った。カレントクランプ法を用いて,海馬歯状回 (dentate gyrus) の顆粒細胞 (granule cell) および嗅内皮質第二層の細胞を調べた結果,ダブルノックアウトマウスでは嗅内皮質細胞の膜特性に異常があることを突き止めた。この膜特性の異常の原因に関してボルテージクランプ法を用いて調べた結果,ある種のチャネル電流の減少が原因であることが判明した。さらにこの減少は,両シングルノックアウトマウスでは観察されなかったことから,ダブルノックアウト選択的な異常であることも判明した。すなわち,これらの分子は膜特性を制御することにより,神経電気活動を制御する新規因子であることが明らかとなった。
11.視床神経回路網におけるシナプス伝達修飾機構の電気生理学的解析
南雲康行,宮田麻理子,川上順子(東京女子医科大学・医学部・第一生理)
視床腹側基底核群(VB核)は体性感覚入力の中継核である。VB核へは,アセチルコリン(ACh)やセロトニンなどの入力があり,活動性を修飾していることが知られているが,シナプス伝達における詳細な作用は不明である。そこで本研究では,末梢からVB核へ感覚情報を伝達する内側毛帯シナプスと大脳皮質体性感覚野6層からVB核へのフィードバックシナプス(皮質視床投射シナプス)の2つの興奮性シナプスに着目しAchによるシナプス伝達の修飾機構をホールセルパッチクランプ法で解析した。
まず,内側毛帯シナプスにおけるACh (1 mM, 5 min) の影響を検討したところ,AChのバス内処置は内側毛帯シナプスでの興奮性シナプス後電流 (EPSC) の振幅に対して全く影響を及ぼさなかった。しかしながら,皮質視床投射シナプスでのEPSCの振幅は,AChの処置により著明に減弱した。また,皮質視床投射シナプスにおけるpaired-pulse ratio (PPR) およびcoefficient valuation (CV)を算出したところ,PPRおよびCV値はAChの処置により有意に増加した。これらのことから,AChによる皮質視床シナプス伝達の減弱は,プレシナプスからの神経伝達物質の放出抑制に基づく可能性が示唆される。こうしたAChによるシナプス伝達抑制は,選択的a4b2型ニコチン性ACh受容体拮抗薬 (DHbE: 10 mM, 5min) の前処置により部分的であるものの有意に抑制された。一方,選択的a7受容体拮抗薬 (metyllycaconitine: 10 nM, 5 min) の前処置は,AChの作用に対してほとんど影響を及ぼさなかった。これらのことから,AChによる皮質視床シナプス伝達の修飾には,a4b2受容体の関与が示唆される。a4b2受容体は,subunitの組合せにより (a4b2)2b2および (a4b2)2a5型に大別される。また,大脳皮質6層には,a5 subunit mRNAの発現が確認されており,皮質視床投射細胞に (a4b2)2a5型受容体が発現する可能性が考えられる。そこで,a5 subunit混成型受容体のallosteric modulatorであるgalanthamineを用いて,皮質視床シナプス伝達における (a4b2)2a5受容体の関与を検討した。その結果,低濃度ACh (1mM) による皮質視床シナプス伝達の減弱作用は,galanthamine (1 mM, 10 min) の前処置により有意に増強した。以上の事から,視床VB核シナプスにおけるAChは,皮質視床シナプス選択的な修飾作用を示し,プレシナプスにおける情報伝達は主に (a4b2)2a5受容体を介して,シナプス伝達を制御している可能性が明らかとなった。
12.大脳基底核の多角的研究-生理学的・解剖学的・工学的アプローチ-
高田昌彦(東京都医学研究機構東京都神経科学総合研究所)
泰羅雅登(日本大学 医学部)
深井朋樹(理化学研究所脳化学総合研究センター)
北野勝則(立命館大学 情報工学部)
南部 篤
神経回路の数理モデルを作成し,シミュレーションを通して神経回路の機能を明らかにするという計算理論的アプローチが進んできている。本共同研究では,従来の生理学的・解剖学的方法に工学的手法を加え,大脳基底核の機能や大脳基底核疾患の病態を明らかにすることを目指している。
正常サルの淡蒼球外節・内節の発射パターンとこれまで知られているイオンチャネルのパラメータを基に,これらの発射活動をシミュレートするような数理モデルを構築した。また,パーキンソン病などにおいて,これらのニューロンがバースト発射や発振活動などの異常活動を示すことが知られているので,どのような条件下で数理モデルにおいても異常発射が起こるか検討した。
13.選択的投射破壊法を用いた大脳基底核の情報処理機構の解明
宮地重弘,纐纈大輔(京都大学 霊長類研究所)
知見聡美,南部 篤
これまで大脳基底核が運動制御に果たす役割を考える場合には主に「直接路」と「間接路」について論じられてきたが,近年,皮質から直接に視床下核(Stn)へ入力し,大脳基底核の出力部である淡蒼球内節(GPi)と黒質網様部(SNr)へと至る「ハイパー直接路」が重要な役割を担っていることを示唆する報告が為されており,その生理学的データから運動が発現する前に運動野内の不必要なニューロンの活動を抑制する役割があることが推測されている。本研究ではマウスの運動皮質→Stn投射を選択的に破壊することで「ハイパー直接路」だけを遮断し,生理学的,行動学的なレベルでの変化を調べた。
まず運動皮質→Stn投射を破壊したマウスのGPeとSNrで皮質電気刺激に対する細胞活動を記録した。正常なマウスのGPeとSNrは皮質刺激に対して早い興奮-抑制-遅い興奮の三相性の反応を示す。しかし皮質→Stn破壊マウスでは早い興奮だけが抑えられた。これは早い興奮は「ハイパー直接路」由来だとするこれまでのデータと一致する。
次に,両側の運動皮質→Stn破壊マウスの運動量を測定すると,正常マウスに比べて運動量が有意に増加していた。これは皮質→Stn投射を破壊したことで大脳基底核の出力部であるGPi/SNrの活動が弱まり,GPi/SNrから視床への抑制性の出力の程度が小さくなり,視床の活動が強くなったと考えられる。続いて視床から皮質への興奮性の出力が大きくなり,結果として運動皮質の活動を増強することによるものと考えられる。これは細胞活動のデータとも一致する。
また,片半球の運動皮質→Stnを破壊したマウスの回転傾向の測定も行った。破壊に加えてドーバミン受容体のアゴニストであるアポモルフィンを腹腔内投与し,皮質の活動を強制的に増加させた。するとマウスは破壊した側と同じ方向に有意に回転傾向を示した。これは選択的破壊により破壊半球側で皮質の抑制の程度が弱まり,左右の皮質の活動のバランスが崩れ,それがアポモルフィンの効果により顕著になり,破壊側に回転する傾向が強まったと考えられる。
以上から,「ハイパー直接路」は神経活動のデータより大脳基底核の出力部位であるSNrで起こる早いタイミングの興奮反応を引き起こし,また運動解析データより皮質の活動を抑制することから,運動皮質の不必要なニューロン活動を抑制する機能を持つと考えられる。
14.脳の左右差に関する統合的研究-体軸形成に異常を示す
変異マウスを用いたアプローチ
伊藤 功(九州大学大学院理学研究院)
成獣マウス海馬神経回路にはNMDA受容体NR2Bサブユニットの非対称なシナプス配置に基づく機能的・構造的左右非対称性が存在していることを我々は明らかにした。本研究はこの発見をさらに発展させ,脳の左右差の形成時期とこれに関与する遺伝子の解明。脳の左右差の行動学的意義の解明。および左右非対称な神経回路の形成に関与する細胞外シグナルの解明,をめざして総合的な検討を行うことを目的とする。
本年度は,海馬神経回路の左右非対称性が消失し,左右の海馬がともに右海馬の特性(右側異性)を示すことが明らかになったivマウスを用い,その行動を解析した。長期および短期の空間記憶の検討に,乾燥型迷路課題および空間遅延非見本合わせ課題を用いた。これらはいずれもマウスにおいて海馬が重要な役割を担っていることがよく知られた学習課題である。その結果,ivマウスはどちらの課題においても対照群に劣ることが明らかになった。従って海馬神経回路の左右非対称性の消失により,場所に関する記憶が定着しにくくなり,作動記憶の保持時間が短くなると考えられる。
15.情動関連神経回路における慢性痛誘発
シナプス可塑性固定化機構の解明
加藤総夫(東京慈恵会医科大学医学部)
脊髄神経結紮神経因性疼痛モデルを用いて,約1週間持続する慢性痛が腕傍核‐扁桃体中心核シナプスの興奮性シナプス伝達を増強させる事実をすでに報告した。このシナプス伝達可塑性の固定化機構を解明するために,シナプス応答および形態を解析し,情動関連行動に及ぼす影響の評価を試みた。
術後1週間後の同モデルを用いた詳細な電気生理学的解析によって,腕傍核‐扁桃体中心核シナプス伝達増強は,プレシナプスにおける同期的放出部位数の著明な増加とポストシナプス応答のわずかな増大を伴うことが示された。また,同モデル腕傍核へのトレーサー注入による腕傍核‐扁桃体中心核シナプスの微細形態観察において,対照群に比しシャフトシナプスPSD面積の拡大およびPSD形態の複雑化,ならびにポストシナプスAMPA受容体密度の増加が認められた。これら電気生理学的シナプス応答と電子顕微鏡による微細構造の変化は一貫しており,神経因性疼痛によって扁桃体中心核シナプスに誘導された可塑的変化が,機能的かつ形態的に固定化された事実が証明された。さらに,同モデルでは場所嗜好性試験において不安様行動が増加していた。
今後,微量注入法によるトレーサー注入と神経核選択的破壊を組み合わせて,痛み関連情動関連行動発現におけるこれらの可塑的変化の意義を評価する。
16.遺伝子改変動物を利用した大脳皮質抑制性ニューロンにおける
神経活動の解明
柳川右千夫(群馬大学)
Victoria Puig,牛丸弥香,川口泰雄(大脳神経回路論研究部門)
大脳皮質は興奮性の錐体細胞と抑制性の介在細胞からできているが,in vivo標本での細胞外記録では両者を区別するのは必ずしも容易ではない。大脳皮質GABA作働性細胞が選択的に蛍光(Venus)標識されたラット(VGAT-Venusラット)を作成することができたので,この遺伝子改変動物を細胞外記録したニューロンのタイプ同定に利用することを試みた。麻酔したラットの前頭皮質から局所電場電位と細胞外ユニット活動をガラス電極で同時記録した。ガラス電極には記録細胞染色のためにニューロビオチンを加えた。ユニットのスパイク波形や,徐波・脱同期化における発火頻度,振動現象における発火位相などを記録した後,電極をさらに記録細胞に近づけ(傍細胞記録法),細胞外から脱分極電流パルスをかけユニット発火を引き起こし,ニューロビオチンを細胞内に注入した。電気生理実験の後に灌流固定し,記録細胞をVenusとは異なる蛍光標識し,Venus発現の有無から抑制性と興奮性細胞に分類した。その結果,短いスパイク幅,高い自発頻度,脱分極通電による発火の順応が弱く,連続発火中にスパイク振幅の減少がみられないという特徴を合わせてもつニューロンが,抑制性のFS細胞と考えられた。このタイプの一部の細胞ではカルシウム結合蛋白質パルブアルブミンが発現していることを蛍光免疫組織化学で確認した。VGAT-Venusラットはin vivoでのGABA作働性ニューロンの同定にも有用であることがわかった。
17.抑制性神経細胞の電顕計測データを用いた
神経細胞シミュレータの構築と電気伝導特性の解析
野村真樹(京都大学大学院文学研究科行動文化学専攻)
窪田芳之(大脳神経回路論研究部門)
本研究では4種類 (Martinotti cell,FS basket cell,Double bouquet cell,Large basket cell) の皮質非錐体細胞の正確な樹状突起形状を取り入れた神経細胞モデリングを行った。モデリングに用いる樹状突起形状はその断面積や周囲長を,電子顕微鏡を用いて丹念に調べた。計測データを解析したところ,分岐近傍における親樹状突起(細胞体に近い側)の断面積と娘樹状突起の断面積の和が一致している事が分かった。また,樹状突起の断面積はそこより遠位の全樹状突起長と線形関係にある事,樹状突起断面の形状は真円からずれている事が分かった。
我々はこれらの特徴を取り入れた非錐体細胞の数理モデルをNEURONシミュレータ上で構築した。長軸方向の抵抗 (axial-resistance),膜のリークコンダクタンス,膜容量として用いたパラメータはそれぞれ,200 Wcm, 0.04 mS/cm2 and 1 mF/cm2である。また,NEURONは真円の断面しか取り扱う事が出来ないため,膜容量とリークコンダクタンスはコンパートメント毎に(l1+l2)/p/(d1+d2) の補正をかけた。ここで,l1とl2(d1とd2)はコパートメント両端の周囲長(断面積から求めた真円の直径)である。静止膜電位は-72 mV (FS), -58 mV (MA), -62 mV (DB), -63 mV (LB) とした。現在の所モデルにはアクティブな要素の膜電流は取り入れていない。このモデルをaシナプス,gmax×t×exp (-t/t),ここでgmaxは2 nS,t は1 msec,で刺激し,刺激点や細胞体での膜電位応答を調べた。現在は,遠位から細胞体に向かう電流の分岐部での配分や,遠位から細胞体に向かう電流量と樹状突起形態との関係性を調べている。特に細胞体へ向かう電流と樹状突起形態とに興味深い関係を見いだしており,解析を進めている所である。なお,研究成果は論文投稿準備中であるため,本報告書には図の記載を控えている。
18.GABAのシナプス小胞取込みにおける濃度依存性の解明
桂林秀太郎(福岡大学薬学部臨床疾患薬理学教室)
GABAおよびグリシンは中枢神経系における抑制性神経伝達物質として知られており,脊髄や脳幹などの一部の領域では,抑制性シナプス伝達を担う神経伝達物質自体が,発達によってGABAからグリシンへスイッチすることが知られている。そのスイッチングの過程において,GABAおよびグリシンは単一の神経終末部から同時に放出されており,神経伝達物質のスイッチングは単一神経終末部のレベルで起こると考えられている。
研究提案者は19年度から鍋倉研究室との共同研究を開始し,ニューロンが自己に多数のシナプス投射する初代培養単一細胞 (Autapse cultured single neuron) の作製方法を鍋倉研にて確立した。本標本は島状に培養したアストロサイト上で単一ニューロンが自身にシナプスを形成し成長する初代培養であり,例えば記録電極に様々なリガンドを注入することでシナプスまで到達させることができる。
本研究では,GABA放出とグリシン放出のスイッチングの詳細な機構を明らかにするため,マウスの海馬オータプス培養細胞に電気生理学的手法を適用して,抑制性シナプス伝達を担う神経伝達物質とその放出メカニズムを検討した。
海馬オータプス培養細胞にホールセルパッチクランプ法を適用し,細胞体を電気刺激することにより誘発される抑制性シナプス後電流 (IPSC) を記録した。ホールセルパッチ直後のIPSCはGABAA受容体アンタゴニストのSR-95531で完全に抑制された。次に,パッチ電極に100mMグリシンを注入し,シナプス前神経終末部を灌流すると,灌流から60分後にはSR-95531感受性成分が減少し,ストリキニーネで完全に抑制されるIPSCも認められた。このことは本来GABAのみを放出していたシナプスが,神経終末部内グリシンが高濃度になることでシナプス小胞内にグリシンを取り込み,続いてグリシンを放出しだしたことを意味する。また,灌流するGABAおよびグリシンの濃度を変化させることにより,抑制性シナプス前神経終末部から放出される神経伝達物質の種類が変化したことから,抑制性神経伝達物質の放出は神経終末部内の神経伝達物質の濃度に依存することを直接証明できた。今後は,GABAとグリシンが混在した場合に,それぞれの濃度バランスにより共放出様式が変化するのか更なる実験が必要である。
19.GABAB受容体による神経回路の構造的・機能的可塑性の解明
神野尚三(九州大学大学院医学研究院基礎医学部門神経形態学分野)
Lateral superior olive (LSO) は,聴覚路における中継センターとして,同側からの興奮性入力と,対側からの抑制性入力を統合する機能を有していることが知られている。発達の初期段階で,medial nucleus of the trapezoid body (MNTB) からLSOへの抑制性シナプス入力は,GABA作動性からグリシン作動性に変化する。この神経回路の再構成は活動性依存性であり,そのメカニズムには多くの注目が集まっている。
このため我々は,LSOのGABAB受容体に焦点をあて,神経回路の発達における役割の解明を目指した。GABAB受容体はR1とR2 subunitの2つのサブユニットから構成されているGタンパク共役型受容体である。中枢神経系では,GABAB受容体はシナプス前終末からのGABAの放出を抑制するだけでなく,LTPやLTDの誘導に関与することが示されている。近年になり,GABAB受容体が神経可塑性の制御や,神経回路の発達に重要な役割を果たしていることに注目が集まっている。本年度の研究では,発達期ラットを用いて,LSOにおけるGABAB受容体の発現様式の変化を免疫組織化学的に解析し,以下の結果を得た。
1: 3生日のラットのLSOでは,GABAB受容体の強い発現が認められたが,14生日のラットでは発現は減弱していた。
2: ニューロンのマーカーであるNeuNとの蛍光二重染色によって,3生日のラットのLSOでは,GABAB受容体がニューロンに発現していることが示された。一方で,アストロサイトのマーカーであるS100b との二重染色によって,18生日のラットのLSOではGABAB受容体がアストロサイトに発現していることが示された。また,18生日では,GABAB受容体のニューロンにおける発現はほとんど認められなかった。
これらの結果は,発達期のラットのLSOにおいて,GABAB受容体の発現が,ニューロンからアストロサイトへとダイナミックに変化することを示しており,神経回路の発達におけるGABAB受容体の役割を明らかにする上で,重要な知見を与えるものである。
20.摂食行動の調節に関与するニューロンの同定とその機能の研究
福井裕行,堀尾修平(徳島大学大学院ヘルスバイオサイエンス研究部)
箕越靖彦,志内哲也
摂食行動の調節に視床下部が重要な役割を果たしていることは,視床下部の破壊実験などにより古くから知られていた。また,この10年来の研究により,摂食調節に関わるニューロンが視床下部で何種類か見出された。しかしながら,現段階では,視床下部における摂食調節の神経回路が完全に明らかにされたとは言い難い。
本研究では,この神経回路を明らかにすることをめざし,摂食調節に関わるニューロンを新たに見出すことを目的としている。このために,視床下部に存在するヒスタミンH1受容体発現ニューロンに着目した。それは,H1拮抗薬が食欲増進をおこすこと,H1受容体欠損マウスが肥満をおこすことなどからH1受容体が摂食調節に関与すると考えられることによる。そして,このH1受容体発現ニューロンを視床下部で選択的に死滅させ,その時の摂食行動への影響を調べることにより当該ニューロンの機能を明らかにしようと考えた。この目的のために,イムノトキシンを用いた細胞標的法によりH1受容体発現細胞を特異的に死滅させる遺伝子改変マウスの作製に着手し,その作製にはすでに成功した。このマウスではH1受容体の換わりにイムノトキシン感受性であるヒトIL-2Raが発現しており,イムノトキシンの局所投与によりH1受容体発現細胞のみが選択的に死滅する。
マウス視床下部において,H1受容体発現ニューロンが室傍核,腹内側核,弓状核,外側野に存在することを,H1受容体抗体を用いた免疫組織染色により確認した。現在,とくに室傍核と腹内側核についてその分布をさらに詳細に調べている。これらの部位は,H1受容体の摂食調節への関与が予想されている部位であり,現在,それぞれの神経核部位にイムノトキシンを微量注入し選択的ニューロン死滅を生じさせるべく,実験条件の設定を行っている。
目的のニューロンが選択的に死滅することが確認されれば,その操作を行ったマウスを用いて,摂食関連の行動を中心に解析し,当該のH1受容体発現ニューロンの機能を明らかにしたいと考えている。
21.視床下部弓状核,室傍核ニューロンにおける
AMPキナーゼのシグナル伝達と摂食行動制御
矢田俊彦,河野大輔,鳥谷真佐子,前島裕子,須山朝成,吉田なつ,山本早和子,
中田正範,安藤明彦(自治医科大学医学部生理学講座統合生理学部門)
箕越靖彦,岡本士毅
グレリンの摂食促進作用は,主として視床下部弓状核の摂食促進性NPYニューロンの活性化を介している。我々は,昨年度の生理学研究所共同研究において,グレリンによるNPYニューロン活性化は,少なくとも一部AMPキナーゼ活性化を介していることを明らかにした(Kohno D., Sone H., Minokoshi Y., Yada T.: Biochem Biophys Res Commun. 366(2):388-392, 2008)。しかし,AMPキナーゼ活性化からNPYニューロン活性化に至るシグナル伝達,この反応が摂食行動に連関するかは解っていない。一方弓状核の摂食抑制性POMCニューロンの活性調節にもAMPキナーゼが関与するかは解っていない。これらを明らかにする目的で研究を行った。成熟ラットの視床下部弓状核からニューロンを急性単離し,細胞内Ca2+濃度 ([Ca2+]i) をfura-2蛍光画像解析により測定し,その後NPY, POMCに対する免疫染色により各々のニューロンを同定し,それらの[Ca2+]i応答を解析した。また免疫組織化学的にAMPキナーゼ及びその下流シグナル分子であるACCのリン酸化を測定し,AMPキナーゼ活性化の指標とした。
AMPキナーゼ活性化剤AICARの添加は弓状核ニューロンのAMPキナーゼを活性化し[Ca2+]iを増加させた。この[Ca2+]i増加は,外液Ca2+除去およびL型Caチャネル阻害剤添加により有意に抑制されたが,N型Caチャネル阻害剤および小胞体Caポンプ阻害剤は影響しなかった。AICARに対し[Ca2+]i増加を示した細胞の40%はNPYニューロンであり,一方POMCニューロンは[Ca2+]i増加を示さなかった。さらに,AICARの脳室内投与は摂食を促進し,その効果はNPY-Y1受容体拮抗薬により完全に阻害された。以上の結果より,AMPキナーゼ活性化による弓状核ニューロンの活性化は主としてNPYニューロンで起こりPOMCニューロンでは見られないこと,AMPキナーゼによるNPYニューロン活性化はL型Caチャネルを介したCa2+流入により,摂食行動の亢進をもたらすことが明らかとなった。
22.随意運動発現を司る神経機構の研究
美馬達哉(京都大学大学院医学研究科)
島津秀紀(医療法人いちえ会伊月病院)
礒村宜和(理化学研究所)
逵本 徹
脳の運動制御の仕組みを解明する目的で,サルが上肢に力を入れるときの体性感覚野と運動野のフィールド電位と上肢筋電図の関係を,有向伝達関数(directed transfer function,略してDTF)を用いて解析した。DTFは複数の構成要素からなるシステム内での結合の方向性を解析するのに有用な指標である。その結果,大脳皮質と筋電図の間のベータ周波数領域 (14-30 Hz) のDTFは,皮質から筋電図へ向かう方向が逆方向よりも優位で,中心溝の前壁(運動野)で最も大きいことがわかった。皮質皮質間のベータ周波数領域のDTFについては,筋収縮中は中心溝後部(感覚野)から中心溝前部(運動野)への向きが逆向きよりも優位であった。これらの結果は,感覚野のベータ波領域の活動が運動のフィードバック制御に役立っている可能性を示唆する。
23.癌における糖鎖関連新規腫瘍マーカーの開発
出口章広(香川大学医学部消化器神経内科)
本研究では癌患者血清中に存在するN結合型糖鎖の構造解析を行い,癌とN結合型糖鎖の関連を検討するとともに,臨床応用可能な新規腫瘍マーカーの開発を行うことを目的として研究を進めてきた。これまでにBatch1(30検体),Batch2(30検体),Batch3(30検体),Batch4(30検体),Batch5(41検体),追加39検体の合計200検体を収集し,血清のアセトン沈殿前処理を行った後,生理学研究所にこれらの試料を送付した。主に,肝硬変(20検体),肝臓癌(59検体),急性/慢性膵炎と自己免疫性膵炎(18検体),膵臓癌(19検体)それぞれの検体で基定数(各10検体以上)を送付した。また,一部の膵臓癌に関しては術前・術後の検体での解析を行った。生理学研究所においてこれらの検体のアセトン沈殿物にヒドラジン試薬を添加・加熱して蛋白質に結合している糖鎖をすべて遊離させ,次に遊離した糖鎖に標識化合物を結合させたのちに,これらをHPLCにて分離同定した。また,糖タンパクの分析のためにアセトン沈殿後の糖タンパクの状態で,患者の個人情報を匿名化したのちに,試料を前記の医学部附属病院より三菱化学科学技術研究センター・分析事業部門に送付し,LC-MSによる糖ペプチドの分析を行った。これまでのところ肝細胞癌に特異的な糖鎖構造がいくつか見つかっており,現在臨床応用にむけてさらに解析を進めている。また,膵癌においても特異的な糖鎖構造が見つかっており,これらからさらに検討を進めていく予定である。また,肝細胞癌組織での糖鎖解析も同時に行っており,血清との対比を今後行う予定である。
24.ガラス化ブタ卵子の顕微授精後の胚発生
福井 豊,Bhuiyan MMU,渡部浩之,鈴木 遥(帯広畜産大学・畜産学部)
平林真澄
ブタを含めて哺乳動物の未成熟および成熟卵子のガラス化後の胚発生能は胚(受精卵)よりも低く,改善が求められている。本共同研究では,種々のガラス化法でガラス化保存されたブタ未成熟卵子(卵母細胞)を体外成熟(In vitro mauration: IVM)させた後に顕微授精 (Inttracytoplasmic sperm injection: ICSI) を施し,その後の体外培養 (In vitro culture: IVC) による胚盤胞への胚発生を検討する目的で,以下の実験を行った。1) IVM前にBrilliant cresyl blue (BCB) 染色により選抜されたブタ卵子のICSI後の胚発生,2) 顕微授精における精子へのDithiothreitol (DTT) 処理による卵子活性化の促進,である。
実験1: BCB染色(3µM,90分間)を施した後,ブタ卵子をBCB+(青染色)卵子とBCB-(無染色)卵子に選別し,IVM, ICSI, IVCを行った。合計4,985個のブタ未成熟卵子をBCB染色した結果,65.2%がBCB+であり,34.8%がBCB-であった。BCB+卵子のIVM率は77.2%で,BCB-卵子の58.1%より有意に (P<0.05) 高かった。また,体外成熟卵子内のグルタチオン濃度はBCB-卵子(6.80pM/卵子)よりBCB+卵子(9.21pM/卵子)で有意に(P<0.05)高かった。しかし,ICSI後の受精率(各々48.1%と48.8%)および胚盤胞発生率(各々15.2%と20.8%)に有意差は見られなかった。
実験2: DTT処理(5mM,30分間)または無処理のブタ精子を体外成熟卵子にICSIして3時間ごとに12時間目まで核相を観察し,さらに144時間目に胚盤胞発生率を比較した。その結果,精子のDTT処理は雄性前核だけでなく雌雄前核形成率も有意に向上した (P<0.05)。さらに,DTT処理は胚盤胞発生率も有意に向上させた(DTT処理: 56.8%,無処理: 42.6%: P<0.05)。以上の結果から,今後ガラス化保存されたブタ卵子をIVM, ICSI, IVCする際には,BCB染色による選別と精子へのDithiothreitol (DTT) 処理による卵子活性化が有効であると思われた。
25.新規電位感受性蛍光タンパク質を用いた,ゼブラフィッシュ神経回路の解析
宮脇敦史(理化学研究所脳科学センター)
筒井秀和,岡村康司(大阪大学医学系研究科)
東島眞一
膜電位変化は,生体内の重要な情報伝達の手段である。とくに,神経細胞においては,活動電位と呼ばれる動的な膜電位変化が起こる。神経回路の中を駆け巡る活動電位の時空間パターンを可視化するための実用的な光プローブが求められてきた。神経分化部門,岡村(現阪大)らは2005年に,尾索類のゲノム情報から電位依存性チャネルの電位センサーモジュールと酵素モジュールを合わせもつ新規分子,Ci-VSPを同定した。これをふまえて,理研脳科学総合研究センター宮脇チームと自然科学研究機構生理学研究所神経分化研究部門の研究チームは共同で,Ci-VSPの電位センサー領域を利用して蛍光性膜電位プローブを開発を企て,膜電位依存的なタンパク質の微妙な構造変化を蛍光信号の変化に効率よく変換するシステムを目指した。その結果,新規膜電位感受性タンパク質,Mermaidを作製することに成功した (Tsutsui et al., 2008)。本研究では,このMermaidを用いて,生体内での膜電位イメージングの可能性を追求した。実験動物としては,体が透明でイメージングに適したゼブラフィッシュを用いた。究極の目標は,神経細胞での空間的なイメージングであるが,予備実験として,より細胞が大きく,また,膜電位変化の時間経過がより緩やかでイメージングが容易な心筋細胞をターゲットにして研究を進めた。心筋細胞特異的プロモーターを用いてゼブラフィッシュに強制発現させた系統を複数作成した。この中から,蛍光強度の強いラインを選別し,高速CCDカメラによるイメージング計測を行って,心筋細胞での膜電位シグナルの計測を行った。その結果,心筋の拍動に同期した心筋細胞の膜電位変化が,波のように空間的に伝播していく様子を捉えることに成功した。今後に期待を抱かせるポジティブな結果である。現在,心筋細胞でより詳しいイメージングを進めるとともに,神経細胞でのイメージングの準備を進めている。
26.ゼブラフィッシュを用いた脳脊髄神経回路の成熟過程の
生理学的・分子生物学的研究
小田洋一,小橋常彦(名古屋大学理学系研究科)
佐藤千恵,東島眞一
ゼブラフィッシュを用いて,逃避運動を司る神経回路の発生過程,および神経回路の機能を調べることを目的とする。ゼブラフィッシュの逃避運動は後脳に左右1対存在するマウスナー細胞によって駆動される。本年度は主に,マウスナー細胞の下流で働く脊髄神経回路に焦点をあてて解析を進めた。特に,マウスナー細胞から電気シナプス入力を受け,脊髄の反対側へ素早い抑制を送る神経細胞,CoLo(Commissural local;軸索が比較的短いためこのように名付けられた)ニューロンについて詳しい解析を進めた。まず,エンハンサートラップラインのスクリーニングにより,CoLoニューロンが特異的にGFPでラベルされているゼブラフィッシュ系統を見いだした。ついで,CoLoニューロンの行動レベルでの機能を調べるため,レーザー照射によりCoLoニューロンを除去し,その幼魚の逃避運動を調べた。音・振動刺激により逃避運動を引き起こすと,コントロール幼魚は左右どちらかへスムーズに逃避運動を行うが,CoLoを除去した幼魚は,しばしば硬直してどちらにも動けない,という表現型を示した。CoLoを除去するのと同時に,左右のマウスナー細胞のどちらか一方をレーザー除去しておくと,このような表現型はいっさい見られなかった。したがって,硬直の表現型が起きるときは,左右のマウスナー細胞の両方が発火していることを強く示唆している。すなわち今回の研究により,(1) 幼魚が逃避運動を行う際には,左右のマウスナー細胞の両方が発火することが起こりうること,(2) マウスナー細胞の両方が発火してしまっても,CoLo細胞が担う素早い抑制のおかげで,魚は左右のどちらかへ逃避運動を行うことが可能である,の2点が示された。すなわち,逃避運動の際には,脳内の情報処理のみならず,脊髄レベルでの下降性コマンドの取捨選択が非常に重要な役割を果たしていることを示すことに成功した。
27.DNAおよびクロマチンの電子顕微鏡を用いた構造解析
加藤幹男(大阪府立大学大学院・理学系研究科)
細木直樹,永山國昭
生物のゲノム中には,三重鎖構造・四重鎖構造やその他のさまざまな特殊高次構造を形成することができるDNA配列が存在している。これらの配列における立体構造多様性は,in vitro実験によってよく検証されているものの,生体内での立体構造変化やその生理機能については未だ明確でない。本研究では,細胞核内クロマチンを,位相差クライオ電子顕微鏡を用いて,生体内に近い条件下で詳細に観察することで,クロマチン折りたたみやDNA-DNA間相互作用,およびDNA分子内特殊高次構造形成の検出を試みた。
生理的条件下のモデル試料として,今回は培養細胞をデメコルチン処理することによって得られる微小核を用いた。40~48時間デメコルチン処理したマウスNIH3T3細胞およびヒトFLEB14-14細胞から微小核画分を調製し,孔径5mmのフィルターでろ過したものを急速凍結後,ゼルニケ型位相板を装着したJEM2200およびJEM3100電子顕微鏡で観察した。
マグネシウムを含まない低張緩衝液 (10mM HEPES, pH7.3 at 25℃) に懸濁された微小核標品からは,コアヒストン様の粒子が付着したDNA鎖がほぐれ出ている様子が観察された。続いて,微小核内部構造を解析するために,少量の塩を加えた低張緩衝液 (10mM HEPES, 1.5mM MgCl2, 10mM KCl) に懸濁した微小核を連続傾斜撮影して,その画像から立体構造を再構成したところ,内部全体に分布する棒状構造物や繊維状構造物が観察された。今後,観察されたこれら構造物の同定を進め,細胞核内クロマチン構造とDNA立体構造を明らかにしていく。
28.脳機能画像法による自律神経系中枢の研究
森田啓之,安部 力(岐阜大学 大学院医学研究科)
瀬尾芳輝,若松永憲(獨協医科大学 医学部)
荻野孝史(国立精神・神経センター 神経研究所)
鷹股 亮(奈良女子大学 生活環境学部)
吉本寛司(京都府立医科大学 大学院医学研究科)
村上政隆
本研究は,岐阜大学大学院医学系研究科,森田を一般共同研究,「脳機能画像法による自律神経系の研究」の提案代表者として,岐阜大学,安部,獨協医科大学,瀬尾,若松,奈良女子大学,鷹股,国立精神・神経センター神経研究所,荻野,京都府立医科大学大学院医学研究科,吉本が共同研究者として参加し,生理学研究所,村上を所内対応者としての協力の下で行われた。MRI測定には,生理学研究所に設置してある高磁場,動物実験用MR装置 (Bruker Biospec 47/40) を使用したが,使用に際し生理学研究所の要請により,今年度も当該装置の年間消費量の冷媒(液体ヘリウム,液体窒素)代,約160万円を獨協医科大学(瀬尾),奈良女子大学(鷹股),国立精神・神経センター神経研究所(荻野),岐阜大学(森田)の4グループが負担した。
本研究の目的は,脳機能画像 (fMRI) 法を用いて自律神経系中枢における種々の神経活動を空間的・時間的に測定し,解析することである。あわせて自律神経系の神経活動の精密なMRI測定を可能とするプローブや造影剤,測定パルス系列などの測定方法の開発を行う。
1) 従来のMn造影MRI法は,静脈内に投与したMnを標的神経細胞周囲に分布させるため,浸透圧ショックにより血液-脳関門を破壊する必要があった。この方法は,確実に脳実質にMnを到達させることができるが,血液-脳関門破壊によるデメリットも大きい。また,血液-脳関門を破壊した脳の応答が正常脳の応答を反映しているかという疑問もある。従って,血液-脳関門を破壊しない,新たなMn造影MRI法が必要とされていた。Mnは,特異的あるいは非特異的膜透過機構を介して血液-脳関門あるいは血液-脳脊髄液関門を透過し,時間経過とともに血液中(脈絡層)⇒脳室⇒脳実質あるいは脳血管⇒脳実質へと徐々に移行する。我々は,これまで脳室内投与,脳実質内投与,血管内慢性投与,腹腔内投与,皮下投与等の様々なプロトコールを検討した。これらの実験では,投与方によりMnが脳実質へ移行していく時間経過は異なるが,どの投与方法でも確実に脳実質に移行することが確認された。例えば,皮下投与したMnは血液中⇒脳室⇒脳実質へと徐々に移行し,投与後数時間でMn造影MRI法に必要なMn濃度に達することが分かった。この方法を用い,血液-脳関門を破壊しないMn造影MRI法が可能となった。
2) 麻酔下のラットを用いて,糖利用が低下した際の視床下部における神経活動部位とその時間経過をMn造影MRI法により調べた。その結果,視床下部外側野の内側よりの脳弓周囲部位においてMRI信号強度の上昇が確認された。この部位は,免疫組織化学的にFos発現が確認された部位とほぼ同様の部位であった。従って,糖利用低下時の視床下部外側野の活動をin vivoでMRIを用いて測定可能であることが示された。
3) 重力の方向が変化する起立時には,体液の下方移動が起こり,血圧が低下する。この低下は,種々の反射性機序により補正されていると考えられている。その中心となるのが重力の感知機構である前庭系と,圧の感知機構である圧受容器を介する反射である。本実験では,前庭-血圧反射と圧受容器反射の中枢での相互作用を調べるために,前庭電気刺激を行ったラットの中枢でのFos発現とMn造影MRIによる信号強度を比較した。前庭刺激により,前庭神経核,最後野,孤束核,延髄腹外側核にFosの発現が見られ,圧受容器からの投射部位と一致した。MRIでは,前庭神経核の信号強度増加は見られたが,他の部位での変化はとらえきれなかった。従って,両反射の中枢での相互作用をMn造影MRI法で調べるためには,延髄,脳幹部位での感度を増す必要がある。
29.伴侶動物の鼻腔内腫瘍における組織型と生息環境との関連
中山裕之,内田和幸(東京大学大学院農学生命科学研究科 獣医病理学研究室)
木村 透(自然科学研究機構 動物実験センター)
近年,伴侶動物(イヌ,ネコ)で鼻腔内腫瘍の発生が増加している。その原因の一つとして,環境化学物質による大気の汚染が考えられている。伴侶動物はヒトと生息環境を共にしており,ヒト疾患のモニターとしての利用が提案されている。本研究ではイヌとネコの鼻腔内腫瘍を組織学的に検索し,その組織型と生息環境との相関を調べることを目的とする。平成20年度は,東京大学動物医療センターからの生体組織の収集が主に行われた。現段階で,1,100例の生体組織の内,約100件が鼻腔組織の生体組織である。この内,腫瘍と診断された症例は,約20%であり,イヌ・ネコともに腺癌が多く,次いでネコではリンパ腫および扁平上皮癌が収集された。平成21年度も引き続き,症例の収集と組織型の特定を図り,疫学的調査を実施する予定である。本年度の成績については,生理学研究所研究会において報告をした。
30.伴侶動物の樹立腫瘍細胞株における生物学的特性の解明
酒井洋樹,児玉篤史(岐阜大学応用生物科学部獣医学課程獣医病理学分野)
木村 透(自然科学研究機構 動物実験センター)
伴侶動物の腫瘍性疾患の中で,特に悪性腫瘍に関しては,腫瘍化メカニズムの詳細が未だ不明であることが多く,また,有効な治療法もほとんどない。しかし,腫瘍化メカニズムの解明や有効な抗がん剤の開発において,腫瘍細胞株を用いた研究は極めて重要であるにも関わらず,伴侶動物の腫瘍細胞の樹立および特性の解析はほとんど行われていない。本年度は,イヌの脾臓血管肉腫細胞株を4種類樹立し得たので,この腫瘍細胞に的を絞り,本研究を進めた。
In vitroでは継代が可能な4種類の脾臓血管肉腫細胞をスキッドマウスの皮下に移植し,継代する方法を用いた。ヌードマウスでは生着しない腫瘍であるが,スキッドマウスでは継代が可能であった。ヒトの脾臓血管肉腫は発生頻度が少ないため,株の樹立がなされていない。このため,今回用いたイヌの脾臓血管肉腫細胞は貴重な材料であり,転移機序や浸潤状況を探索する上で重要な樹立株となることが期待される。平成21年度に継続して,病理組織学的に細胞の特性を見極めて,ヒトの脾臓血管肉腫との類似点あるいは相違点をまとめ上げ論文とする予定である。
31.伴侶動物における機能性腫瘍の検索および腫瘍細胞の系統保存
丸尾幸嗣,森 崇(岐阜大学応用生物科学部獣医学課程獣医分子病態学分野)
木村 透(自然科学研究機構 動物実験センター)
伴侶動物の高齢化に伴い,小動物臨床において腫瘍性疾患の診断・治療は重要な課題となっている。また,腫瘍細胞自身が産生する生理活性物質が,生体の機能に様々な影響を及ぼすことがわかり,近年この機能性腫瘍細胞が注目されている。しかし,伴侶動物の腫瘍細胞を継代移植し,樹立細胞株として保存する例は極めて少なく,腫瘍細胞自身の特性・機能を解明するには未だ至ってない。本研究の目的は,各種腫瘍細胞を系統保存する腫瘍バンクを作り,必要な腫瘍株を供するシステムを樹立することである。さらに,系統的に保存された腫瘍株の中から興味あるものに注目し,その腫瘍細胞が産生する因子を解明することである。
本年度の研究成果は,次の2点であった。1.腫瘍細胞株の種類を増やし,12株まで樹立できた。ほぼ,腫瘍バンクを確立することができ,他の研究者に分与する段階に達した。2.確立した腫瘍株を用いて,抗腫瘍剤の効果・効能を見極め,その結果を患畜の治療にフィードバックする試みを行った。イヌの肺腫瘍2種を用いて,抗腫瘍剤が腫瘍に及ぼす影響を細胞レベルで確認した。その結果,従来からヒトで用いられている抗腫瘍剤があまり高い効果がなく,また新薬にも目新しい効力がないことが判明した。肺腫瘍の臨床例において,抗腫瘍剤が思うように効力を発揮しない事実を裏付ける結果であった。今後は作用機序の異なる抗腫瘍剤を用いて,検討する予定である。
32.成体脳内におけるOlig2陽性グリア前駆細胞の動態について
和中明生,辰巳晃子,奥田洋明(奈良県立医科大学 第二解剖学講座)
Olig2は胎生期の腹側脊髄のpMNドメインに発現する転写因子であり,当初はオリゴデンドロサイト前駆細胞に特異的に発現しオリゴデンドロサイトの発生に必須の遺伝子として報告された。その後多くの研究により,脊髄や前脳においてニューロン,オリゴデンドロサイト,アストロサイトの産生にも関与する事が明らかにされた。又最近では,Olig2を発現する細胞が胎生期や発生の過程だけではなく成体脳においても存在することが知られるようになった。この細胞の90%以上はNG2プロテオグリカンを共発現すると言われており,この細胞の成体脳における機能については未だ不明な点が多い。我々はOlig2/NG2細胞が成体終脳内においてユビキタスに存在する事を確認している。そしてこれら細胞の成体脳内での動態を知るために,Cre/LoxPシステムを用いた細胞系譜追跡実験を行ってきた。
その結果,正常な成体脳内でNG2を共発現していたOlig2細胞は,大脳皮質に凍結損傷を与えると増殖しその後GFAPやコンドロイチン硫酸を発現する反応性アストロサイトに分化し,損傷部位を取り囲むグリア瘢痕の一部を構成する事を明らかにした。又,銅キレーターであるcuprizoneを用いた急性脱髄モデルマウスの白質では,Olig2細胞はやはり増殖して脱髄場所に集積しオリゴデンドロサイトに分化した。これらの結果からOlig2細胞は成体脳の病態下において増殖活性を高め,脳の場所に応じて違うタイプのグリア細胞に分化することを証明した。
最近我々は,voluntary exerciseにより神経活動の亢進を促すと視床下核においてOlig2細胞由来アストロサイトが集積する事を見出した。このアストロサイトはGFAPを発現せず,グルタミン合成酵素・L-セリン合成酵素・カルシウム結合タンパクなどを発現しており,神経活動とのcorrelationを示唆するものであった。このことは成体脳内においても,Olig2細胞は神経活動に依存して分化しうることを示している。現在は成体脳の神経活動とOlig2細胞の分化について更に検討を進めている。
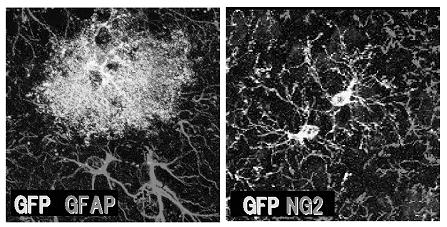 Cre-LoxPシステムによりGFPラベルされたOlig2細胞
|
33.唾液腺分泌終末における細胞間結合の調節機構:
細胞内信号系と神経系による調節
杉谷博士,成田貴則(日本大学・松戸歯学部・生理学講座)
橋本貞充(東京歯科大学・病理額講座)
細井和雄(徳島大学・歯学部・口腔生理学講座)
荻野孝史(国立精神・神経センター神経研究所)
瀬尾芳輝(獨協医科大学・生理学講座)
村上政隆
唾液成分としての水は血漿由来であり,唾液腺腺房部を経由して分泌される。腺房部における水の輸送には2つの経路が存在する。1つは腺房部の細胞を経由する経細胞輸送系であり,もう1つは細胞間を経由する傍細胞輸送系である。傍細胞輸送系には,細胞間結合部構成蛋白質の機能が関わることが報告されている。本研究においては,唾液腺における傍細胞輸送系調節について検討をし,次の結果を得た。
1) ラット顎下腺灌流標本を用いて神経伝達物質の1つであるニューロキニンA (NKA) 刺激を行ったところ,容量依存性の唾液分泌が認められた。灌流液のCa2+を除去すると,NKAは一過性の唾液分泌しか示さなかった。BAPTAで細胞内Ca2+を完全にキレートすると,NKAによる唾液分泌は完全に阻害された。このことから,NKAによる唾液分泌は細胞内Ca2+濃度に依存することが示唆された。さらに,細胞膜非透過性物質であるルシファーイエロー (LY) を灌流液に加え,唾液中に分泌されるLY量を測定したところ,完全に唾液分泌と同様な動態を示した。これらのことから,傍細胞輸送系は細胞内Ca2+に依存した唾液分泌に共役した機能であることが明らかとなった。
2) 唾液腺細胞には成長因子の1つであるInsulin-like growth factor-I (IGF-1) の発現が知られていることから,傍細胞輸送系をもつ培養唾液腺細胞(SMIE細胞)におけるIGF-Iの効果を検討した。IGF-I処理をしたSMIE細胞は,培養10日目においても,有血清 (FCS) 培地とほぼ同様な細胞数を維持していたが,HGF, EGF, TGF-bでは細胞数維持は認められなかった。FCS培地にIGF-I受容体阻害剤,あるいはIGF-Iの細胞内シグナルに関わるとされるPI3キナーゼの阻害剤を加えて培養したところ,FCSによる細胞数の維持は認められなかった。そこで,タイト結合タンパク質の発現,タイト結合タンパク質の局在を確認したが,FCSとIGF-I間で有意な変化は認められなかった。さらに,trasepithelial resistance (TER)およびFITC-dextranの透過性を測定することによりしたが,傍細胞輸送機能において有意な変化は認められなかった。以上の結果より,IGF-Iが傍細胞輸送系を含む唾液腺機能維持に大きくかかわることが示唆された。
34.中枢性エネルギー代謝調節系における分子メカニズム基盤に関する
生理学的研究
中里雅光,山口秀樹,十枝内厚次(宮崎大学医学部内科学講座
神経呼吸内分泌代謝学分野 教授)
箕越靖彦,岡本士毅
国立循環器病センター研究所の南野らは,ヒト甲状腺癌由来TT細胞の培養上清から,2種類のVGF蛋白由来C末端アミド化ペプチドNeuroendocrine Regulatory Peptide (NERP)-1とNERP-2を同定した。VGF蛋白は,視床下部において摂食調節因子の産生ニューロンに発現が多いことから,NERPsによる摂食調節およびエネルギー代謝調節機序を明らかにすることを目的とした。NERPsの分布は,免疫組織学的手法を用いて測定した。ラット脳室内にNERP-1とNERP-2を投与し,神経細胞の活性化の指標であるFos蛋白の発現を観察し,摂食,酸素消費量,体温の変化を測定した。オレキシン,メラニン凝集ホルモン,アグーチ関連蛋白の中和抗体,オレキシン受容体およびニューロペプチドY Y1/Y5受容体拮抗剤を用いてNERPsによって生じる摂食作用の下流シグナルを解析した。オレキシンの直接的関与を解析するため,オレキシン欠損マウスを用いた。NERP-2は,視床下部外側野に発現して覚醒と摂食の調節に機能するオレキシンと共存していた。NERP-2の脳室内投与は,オレキシンニューロンのFos発現を増加させた。摂食およびエネルギー代謝は,NERP-2のラットとマウス脳室内投与により亢進し,中和抗体の投与による内因性NERP-2の遮断により抑制された。抗オレキシンIgG前処理ラットやオレキシン欠損マウスでは,NERP-2による摂食亢進およびエネルギー代謝亢進作用が消失した。NERP-2は,オレキシン系の調節を介して,摂食とエネルギー代謝亢進に機能する内因性ペプチドであった。一方,アグーチ関連蛋白やメラニン凝集ホルモンの中和抗体は,NERP-2の摂食亢進を抑制しなかった。またニューロペプチドY Y1/Y5受容体拮抗剤はNERP-2による摂食亢進作用を抑制した。NERP-2の投与は,視床下部弓状核にあるニューロペプチドYニューロンのFos発現を増大させないことから,NERP-2は,オレキシン-ニューロペプチドY情報伝達系により摂食亢進に機能していることが推察された。NERP-2による摂食亢進作用の発見は,視床下部における摂食調節の詳細な機序の解明に貢献する。
35.糖尿病関連ヘパトカインセレノプロテインPの作用機構の解析
御簾博文,篁 俊成(金沢大学医薬保健研究域医学系恒常性制御学)
箕越靖彦
2型糖尿病は世界中でその罹患患者数が急増しており,その発症メカニズム解明と新規治療法の開発は急務である。肝臓は生体内最大の生理活性物質産生臓器であり,肝由来分泌タンパクヘパトカインの産生異常は2型糖尿病発症の一因となりうる可能性がある。我々は,ヒト肝発現遺伝子の包括的な解析から,微量元素セレンの輸送タンパクとされるセレノプロテインP(以下SeP)が肝臓,筋肉といった末梢組織にインスリン抵抗性を誘導し,高血糖の発症に寄与するヘパトカインであることを発見した。そこで,SePの作用機構の解明をこころみた。
精製SePタンパクをH4IIEC肝細胞に投与すると,細胞内エネルギーセンサーとして機能するとされるAMP activate protein kinase (AMPK) のリン酸化の減弱が認められ,AMPKの下流で制御されるとされるACCリン酸化および脂肪酸酸化関連遺伝子発現の減弱が認められた。そこで,dominant negative AMPKをアデノウイルスベクターを用いて細胞に遺伝子導入し細胞内AMPK活性を低下させたところ,SeP投与によるインスリン抵抗性誘導作用は消失した。さらに,constitutive active AMPKを導入した実験でも同様の結果が認められた。これらの結果からSePの肝細胞に対するインスリン抵抗性誘導作用は細胞内AMPKパスウェイを介することが明らかとなった。
AMPKは中枢神経系においてもエネルギーセンサーとして機能しうることが報告されており,AMPK活性を低下させるSePは中枢神経に対しても作用を有する可能性が高い。今後,精製SePタンパクを脳室内に投与する実験により,SePの中枢神経作用の確認実験を行う。さらに,SeP投与後の脳組織を抽出し,SePの中枢作用が脳内,あるいは脳細胞内のどのようなパスウェイを介したものであるかを明らかにしたい。