脳血流計測法としてのPETとMRI
コンピュータを用いた断層画像法は、1972年のHounsfieldによるX線コンピュータ断層撮影法(CT)の発明 [1] にはじまり、核医学的手法に適用されてポジトロン断層画像撮影法(PET)に結実し、また核磁気共鳴現象を利用した核磁気共鳴断層画像法(MRI)へと進展した。これら2つの画像法の成り立ちと画像の特徴を論じ、脳血流というパラメータを画像化する場合の比較を行う。
1.断層画像法の原理
1-1 コンピュータ断層画像(CT)の原理
レントゲンのX線発見(1895)以来、X線診断技術(X線投影技術)はフィルムに影として記録(投影)して観察する方向で発達してきた。これはX線ビー ムの経路に沿った物質の吸収の差をコントラストとして、体内の情報を得るものであるが、全ての対象物が前後に重なるため、利用しうる情報の多くが失われ、 内部構造の観察は困難であった。
1972年にHounsfieldにより始められ発展してきたコンピュータ断層画像再構成法は、歴史的にまずX線投影技術を基礎として発展したが、断層画 像再構成(あるいは立体再構成)の原理はフーリエ変換にあり、PET、MRIに応用されてきた。すなわち、実空間とフーリエ空間はフーリエ変換により等価 であるので、実空間を再構成するためには、フーリエ空間のデータをサンプルすればよい。X線CTの場合は、実空間において得られた投影データから、フーリ エ空間のデータを得ることになる。
で与えられる。 v=0のとき
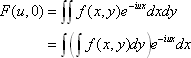
で計算される。実際のCTにおいては、上述の方法と数学的に等価なフィルタ変換逆変換法(filtered back projection method)が用いられることが多い。
<*1> ベクトル方式では 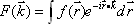 、 ・ は内積をあらわす。
、 ・ は内積をあらわす。
|
X線CT画像再構成の原理 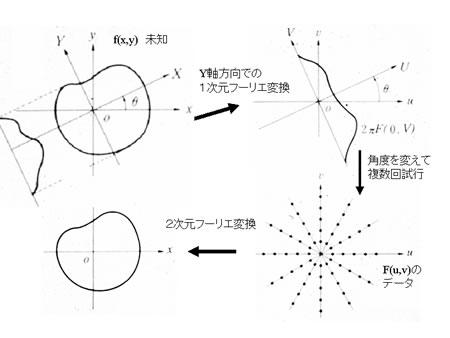 |
1-2 PET
PET(positron emission tomography)とは、陽電子(positron)が消滅するときに放射する消滅ガンマ線を同時計測することにより、生体内の陽電子放射トレーサー の局所濃度分布を算出し、断層画像にする技術である。適切なトレーサーを用いることにより様々な生理的生化学的な計測(たとえばブドウ糖代謝、脳血流、血 液量、酸素代謝や神経受容体など)が可能である。断層画像再構成にはCTと同じくフィルタ変換逆変換法が使われることが一般的であるが、PETにおいて は、  はポジトロンの存在密度であり、投影データは、消滅ガンマ線の同時計数により得られる放射データに (1) 消滅ガンマ線の吸収補正 (2) 偶発同時計数および散乱同時計数の補正 (3) 計数率特性補正などの前処置をなすことにより得られる。これらの補正をうけた投影データを用いて断層画像再構成が行われ、(4) 絶対値測定のための感度相互補正を経て標識物質の局所濃度が定量化される(詳細は [3] - [5] を参照のこと)。
はポジトロンの存在密度であり、投影データは、消滅ガンマ線の同時計数により得られる放射データに (1) 消滅ガンマ線の吸収補正 (2) 偶発同時計数および散乱同時計数の補正 (3) 計数率特性補正などの前処置をなすことにより得られる。これらの補正をうけた投影データを用いて断層画像再構成が行われ、(4) 絶対値測定のための感度相互補正を経て標識物質の局所濃度が定量化される(詳細は [3] - [5] を参照のこと)。
(1) 消滅ガンマ線の減弱補正
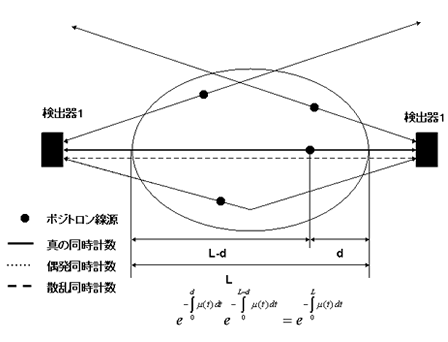
同時計測においては、被験体内での消滅ガンマ線の減弱がポジトロン線源の位置に拠らず、減弱補正が性格に出来る。被験体内のある深さ d にある線源から放射された消滅ガンマ線は体内で吸収されるが、両方のガンマ線とも吸収されずに透過して、両検出器ともに到達する確率はおのおののガンマ線が透過する確率の積となる をガンマ線が通過する道筋tに沿った組織の、511keVのガンマ線に対する減弱計数とすると
をガンマ線が通過する道筋tに沿った組織の、511keVのガンマ線に対する減弱計数とすると
即ち、消滅ガンマ線の体内での減弱は線源の位置に関係なく、両ガンマ線が被験体を横切る全距離 L と のみによってきまってくる。つまり断面の減弱係数分布
のみによってきまってくる。つまり断面の減弱係数分布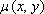 がわかればよく、これは透過スキャンによって別個に得ることが出来る。
がわかればよく、これは透過スキャンによって別個に得ることが出来る。
(2) 偶発、散乱同時計数
別々の場所から放射された2組の消滅ガンマ線の片方がたまたま同時に1対の検出器で検出され、カウントされる場合を偶発同時計数といい、1対の消滅ガンマ 線が被験体内で散乱し、それらが同時に検出される場合を散乱同時計数という。偶発同時計数の補正は、遅延回路を用いる方法と、2つの検出器のシングル計数 率から偶発同時計数率を計算する方法の2通りがある。散乱同時計数は解析的には補正出来ないため、被験体の近傍の値から外挿される値を散乱同時計数と想定 して差し引くなど近似的な方法が用いられる。
(3) 計数の数え落とし補正(計数率特性補正)
計数数え落としは、システム各部における不感時間のために起こる。これは検出器や後続の電気回路の設計に依存するため、その補正は機種ごとに異なる。
(4) 絶対値測定のための感度相互補正
放射能既知のファントムを用いて、PET画像の画素値を放射能に換算する。
|
PETにおける消滅ガンマ線の同時計測 |
1-3 MRI
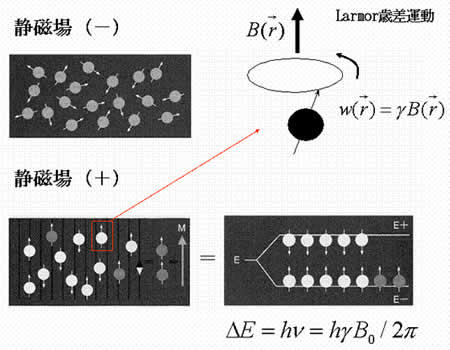
MRI(magnetic resonance imaging)とは、水素原子の核磁気共鳴現象を利用した画像法である。水素原子は固有の回転運動(スピン)による磁場を持つ。磁場の無い状態ではスピ ンはばらばらの方向を向いているが、静磁場下では2つのエネルギーレベル(準位)に分かれる。個々のスピンの方向は熱的に揺らいでいるが、集団としてみる と上向きスピンが常に多い状態がもたらされる。この結果、計測サンプルの小部分<*2>に対応する磁化ベクトル(spin isochromat)が形成される。スピンは静磁場方向を中心軸とする歳差運動(Larmor歳差運動) をする。その角速度(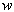 , Larmor frequency)はその場(3次元座標系におけるベクトル表示で
, Larmor frequency)はその場(3次元座標系におけるベクトル表示で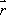 と表記する。)の静磁場
と表記する。)の静磁場 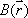 に正比例し、比例係数(磁気回転比 gyromagnetic ratio,
に正比例し、比例係数(磁気回転比 gyromagnetic ratio, 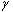 )は水素原子に固有であり、42.6MHz/Tである(図3)。
)は水素原子に固有であり、42.6MHz/Tである(図3)。
これに歳差運動の角速度に等しい励起磁場(電磁波<*3>) を与えると磁化ベクトルはエネルギーを吸収して歳差運動の角度を増し、横磁化が発生する(励起)。励起磁場をとめると磁化ベクトルは元の静磁場方向にもど る(緩和)。これらを核磁気共鳴現象とよぶ。緩和過程は静磁場と平行にコイルをおくことにより、横磁化成分の回転を、徐々に減衰する交流電流として検出で き、MR信号の自由誘導減衰(FID、free induction decay)と呼ばれる(図4)。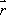 におけるFID
におけるFID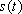 は、プロトン密度を
は、プロトン密度を 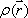 とすると
とすると
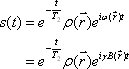
ここで T2 は、横緩和時間である(後述)。
<*2> 小部分とは次の2点を満たすものである。
- 容積が十分小さく、含まれるスピンは均一の静磁場の影響をうける(すなわち同一の周波数をもって歳差運動をする)
- そこに含まれるスピンの数が十分大きくスピン集団の統計的な振る舞いを統計力学により扱うことが出来る。
<*3> FM波の程度の周波数のため、RFパルス(radiofrequency pulse),ラジオ波とも呼ばれる。
 |
|
 |
観測時間がT2に比べて十分に短ければ、信号の減衰項 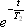 は定数項に繰り入れることが出来るので、以下の議論では
は定数項に繰り入れることが出来るので、以下の議論では
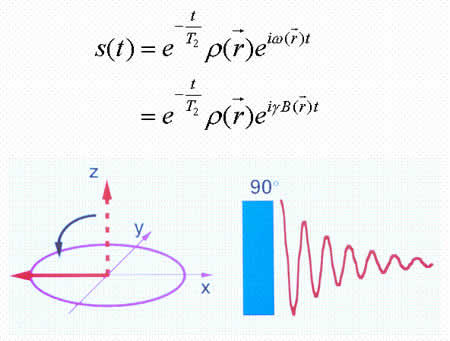
として扱う。観測される信号S(t)は異なる生体組織(体積V)から出るMR信号の総和であるから、
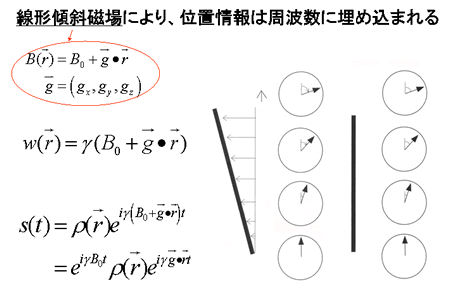
ここで均一静磁場におかれた人体からのMR信号には、位置情報はない。断層画像を作成するためには、生体局所におけるMR信号を分別するための位置情報を付加しなければならない。このために、線形傾斜磁場を用いる。
式から明らかなように、線形傾斜磁場を静磁場に付加することにより、位置の違いが、それぞれの場所における磁場の違いとなる。歳差運動の角速度はその場の磁場に正比例することから、位置の違いは歳差運動の角速度の違いに反映される(図5)。
このため、位置情報が、自由誘導減衰に含まれる、異なる角速度の交流成分として表現される。
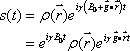
ここで、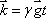 とおく。これは観測中にその場で経験された磁場勾配と励起からの時間と磁気回転比の積で、単位は距離の逆数となる。
とおく。これは観測中にその場で経験された磁場勾配と励起からの時間と磁気回転比の積で、単位は距離の逆数となる。
検波によりキャリアーであるラジオ波 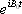 は除去されるので、最終的に観測されるMR信号<*4>は
は除去されるので、最終的に観測されるMR信号<*4>は
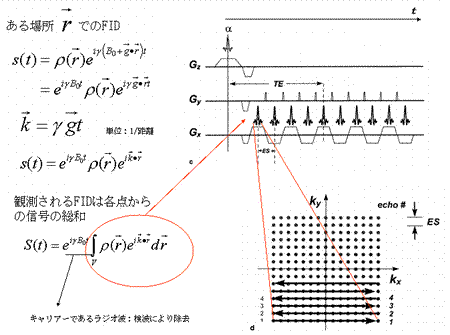
この式は、FIDがプロトン密度分布 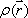 のフーリエ変換であることをしめす。右辺は の関数なので、プロトン密度のフーリエ空間を k-space と呼ぶことがある。すなわち適切な線形傾斜磁場を与えながらFIDを観測することにより k-space を埋めてゆき、データ収集後 k-space にフーリエ逆変換をほどこすことによりプロトン密度をパラメータとする断層画像を作成することが出来る。k-space の埋め方によりさまざまなデータ収集法が存在する。このようにして得られた画像は、生体内組織間の組成の違いに起因する水素原子の分布密度と緩和時間の違 いを反映する(図6)。
のフーリエ変換であることをしめす。右辺は の関数なので、プロトン密度のフーリエ空間を k-space と呼ぶことがある。すなわち適切な線形傾斜磁場を与えながらFIDを観測することにより k-space を埋めてゆき、データ収集後 k-space にフーリエ逆変換をほどこすことによりプロトン密度をパラメータとする断層画像を作成することが出来る。k-space の埋め方によりさまざまなデータ収集法が存在する。このようにして得られた画像は、生体内組織間の組成の違いに起因する水素原子の分布密度と緩和時間の違 いを反映する(図6)。
<*4> その周波数が可聴域にあるため、オーディオ波ともいう。
 |
 |
緩和時間
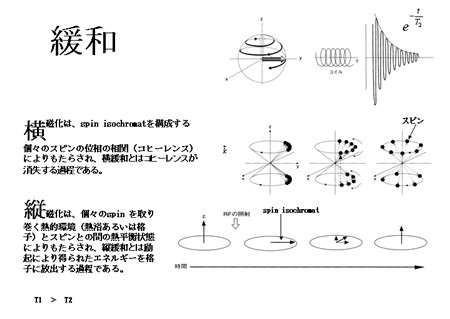
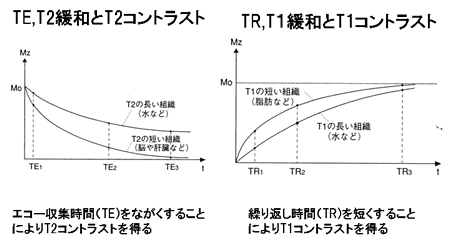
前述のとおり、緩和は励起磁場により励起された磁化ベクトル(spin isochromat)が元の静磁場方向に戻る過程であり、これには縦緩和と横緩和がある。静磁場下で、スピンは静磁場方向を中心軸とする歳差運動 (Larmor歳差運動)をする。磁化ベクトル(spin isochromat)は、静磁場の下で、個々のspinを取り巻く熱的環境(熱浴あるいは格子)とスピンとの間の熱平衡状態によりもたらされる。励起以 前には、スピンの位相の相関(コヒーレンス)が無いために横磁化はなく、縦磁化のみである。励起磁場(電磁波)により、(1)エネルギーが吸収され、エネ ルギー準位(Zeeman準位)の高い、静磁場と反対方向のスピンの数が増える。すなわち縦磁化ベクトルが静磁場と反対方向へ変化する。(2)励起に用い るラジオ波は一定の位相を持つ電磁波であり、位相のそろった電磁波はコヒーレンスを持つ波である。RF磁場によってZeeman準位の間に遷移が起こる際 に、RF磁場が内蔵するコヒーレンスがスピンに移り、その結果、スピンの間にコヒーレンスがもたらされる。このために横磁化が発生する。緩和はこの逆の過 程である。すなわち縦緩和とは励起により得られたエネルギーを格子に放出する過程であり、縦磁化の回復過程(時定数 T1)として観察される。横緩和とはコヒーレンスが消失する過程であり横磁化の消失過程 (時定数 T2)として観察される(図7)(共鳴と緩和に関する量子力学的考察は専門書 [6] を参照されたい)。 T1, T2 は組織の組成によってさまざまな値をとるため、適当な撮像方法を選択することにより、T1 あるいは T2 の違いを強調した画像を撮影することにより、生体内の組織を、コントラストをつけて描出することが可能となる(図8)。この点が、PETの定量性、放射性 薬剤動態に基づく特異性と対照的である。
 |
 |
2.脳血流を用いた脳賦活検査
脳血流を用いた脳賦活検査では、局所脳血流の増加と神経活動によるエネルギー消費の増大が連関している、という事実に基づき、課題遂行中の脳血流と対照と なる状態(多くは課題を遂行していない安静状態)における脳血流と比較して、脳血流の増大している領域の分布を全脳にわたり描出する。血流の有意な増加が 認められた領域が、その課題の遂行に、何らかの役割を負っていると推論することにより、ある課題に関連した神経活動の変化の起こった場所を同定することが できる。
2-1 PETによる脳血流計測
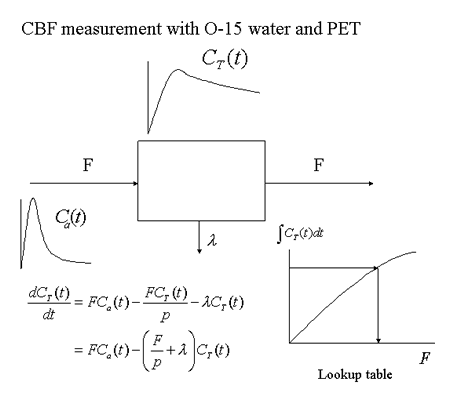
ヒト脳血流測定の手法は、1960年代の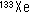 ガ スによる計測 [8] に始まる。1980年代には、ポジトロン断層画像(PET)を用いて局所脳血流を定量する方法が確立した [9] (図9)。O15標識水(半減期2分)をワンショット静注して直後より90-120秒PETカメラで撮影する。同時に動脈血を採血し、動脈血放射能の時間 経過を測定する。1コンパートメントモデルに基づいて微分方程式を作成し、放射能と血流の換算表を作成して脳血流を計算し、局所脳血流の絶対値を画像とし て表示する(図10)。O15標識水は短時間で繰り返し脳血流を計測できるため、高次脳機能研究に頻用されてきた。
ガ スによる計測 [8] に始まる。1980年代には、ポジトロン断層画像(PET)を用いて局所脳血流を定量する方法が確立した [9] (図9)。O15標識水(半減期2分)をワンショット静注して直後より90-120秒PETカメラで撮影する。同時に動脈血を採血し、動脈血放射能の時間 経過を測定する。1コンパートメントモデルに基づいて微分方程式を作成し、放射能と血流の換算表を作成して脳血流を計算し、局所脳血流の絶対値を画像とし て表示する(図10)。O15標識水は短時間で繰り返し脳血流を計測できるため、高次脳機能研究に頻用されてきた。
|
1コンパートメントモデルを用いた、O-15水とPETによる脳血流定量の原理。
脳局所放射能濃度CT(t)はPETにより、入力関数Ca(t)は動脈血採血により得る
|
|
O-15水とPETを用いた脳血流画像
 |
2-2 機能的MRI
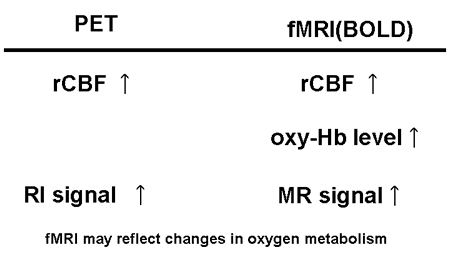
1990年代に入ってMRIの高速化に伴い、血中の酸素を内因性の造影剤とする機能的MRIが開発された。機能的MRIは主に、神経活動亢進時に起こる、 血管内の血液酸素化の局所的変化による、わずかな信号増強をとらえているので、blood oxygen level dependent (BOLD) methodと呼ばれている。酸化ヘモグロビンと還元型ヘモグロビンは、磁性的性質が異なることが古くから知られており [10]、還元型ヘモグロビンが血管内に存在することにより、血管周囲の磁場の局所的不均一が惹起される。局所磁場不均一の存在により、NMR信号は、そ れが存在しない場合より小さくなる。神経活動亢進時には、脳血流の増大により、脳組織の酸素摂取を上回る酸素が供給されるため、局所還元型ヘモグロビンが 減少する。このため、NMR信号が増加する [11]。この方法の利点は、放射線被爆なく数秒間隔で全脳の脳血流変化を記録でき、データ収集量もPETに比べてはるかに大きく出来る点である(図 11)。ただし、脳血流の変動のみを評価出来、絶対値の計測は不可能である。
多数の成人健常者を対象とした脳賦活検査においては、この信号増強が、局所血流増加と神経活動亢進を示すこと、また直接比較により、機能的MRIによる脳 賦活部位とPETによるそれとが良く一致することが確認されてきた。これは、脳血流と酸素代謝のバランスの上に成立していることを念頭におく必要がある (図12)。例えば、ヒト脳はその発生初期において形態機能代謝の各側面から急激な変化をしめす。特にヒトの視覚領でシナプス数は生後2ヶ月から急速に増 大を始め8-9ヶ月でピークになり、その後発達に伴い低下して、出生時とほぼ同じの成人の値に落ち着く [12]。生後2ヶ月を境に、視覚刺激時にMR信号の変化が正から負へ、すなわち大人のパターンとちょうど反対の方向へと変化することが観察された [13, 14]。これはシナプス過形成により、酸素代謝の需給バランスが変化するためであると説明されている。
いずれにせよ、脳血流変化を指標とする脳賦活検査は成人において膨大な研究がなされつつあり、システム神経科学における1つの潮流を作りつつある。PETと機能的MRIの比較を図13に示す。
|
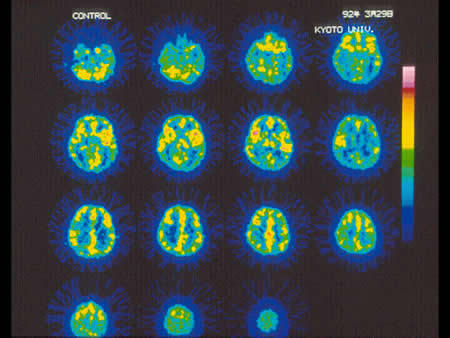
3テスラMRI装置を用いた機能的MRIの1例。 8Hzの光刺激による脳活動の画像化を個人データ解析により行った。外側膝状体と一次視覚野の神経活動が、捉えられている。
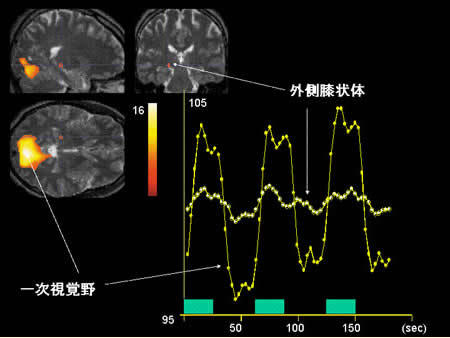 |
 |
 |
参考文献
- Hounsfield GN. Computerized transverse axial scanning (tomography). 1. Description of system. Br J Radiol 1973; 46: 1016-22.
- 英保茂 システム制御情報ライブラリー5 医用画像処理 朝倉書店 1997
- 田中栄一 三次元アイソトープ像の計測と画像再構成 Radioisotopes 39:510-520, 1990
- 村山秀雄 陽電子の科学と計測シリーズ VIII ポジトロン・エミッション・トモグラフィ 3.画像の再構成とデータ補正 Radioisotopes 42+ 244-254 1993.
- 鳥塚莞爾監修 クリニカルPET 先端医療技術研究所 1997
- 荒田洋治 NMRの書 丸善 2000
- Raichle ME. Circulatory and metabolic correlates of brain function in normal humans. Handbook of Physiology. Vol Section 1: The Nervous System. Volume V. Higher Functions of the Brain. Bethesda: Am. Physiol. Soc., 1987: 643-674
- Lassen NA, Ingvar DH. Radioisotope assessment of regional cerebral blood flow. Prog Nucl Med 1972; 1: 376-409.
- Herscovitch P, Markham J and Raichle M. Brain blood flow measured with intravenous H215O I. Theory and error analysis. J Nucl Med 24: 782-789, 1983.
- Pauling L, Coryell C. The magnetic properties of and structure of hemoglobin, oxyhemoglobin and carbonmonoxyhemoglobin. Proc Natl Acad Sci U S A 1936;22:210-216.
- Ogawa S, Lee TM, Kay AR, Tank DW. Brain magnetic resonance imaging with contrast dependent on blood oxygenation. Proc Natl Acad Sci U S A 1990;87 (24):9868-72.
- Huttenlocher P, deCourten C, Gray L, Loos Hvd. Synaptogenesis in human visual cortex- evidence for synapse elimination during normal development. Neurosci Lett 1982;33:247-252.
- Yamada H, Sadato N, Konishi Y, Muramoto S, Kimura K, Tanaka M, et al. A milestone for normal development of the infantile brain detected by functional MRI. Neurology 2000; 55: 218-23.
- Morita T, Kochiyama T, Yamada H, Konishi Y, Yonekura Y, Matsumura M, et al. Difference in the metabolic response to photic stimulation of the lateral geniculate nucleus and the primary visual cortex of infants: a fMRI study. Neurosci Res 2000; 38: 63-70.