概要
我々は、「脳高次機能の基本単位であるシナプス機能を制御する基本原理の解明、と脳病態におけるその破綻機構の理解」に向けて研究を展開しています。
シナプス間の情報伝達の効率は、外界からの入力刺激に依存して柔軟に変化することから(シナプス可塑性)、記憶や学習の分子基盤であると考えられています。脳の興奮性シナプス伝達を司るイオンチャネルにはグルタミン酸受容体、ニコチン型アセチルコリン受容体、セロトニン受容体などがありますが、中でも脳の主要な興奮性神経伝達を司るAMPA型グルタミン酸受容体(AMPA受容体)は、その数や機能の変化がシナプス伝達効率と密接に関わっていることが知られています。
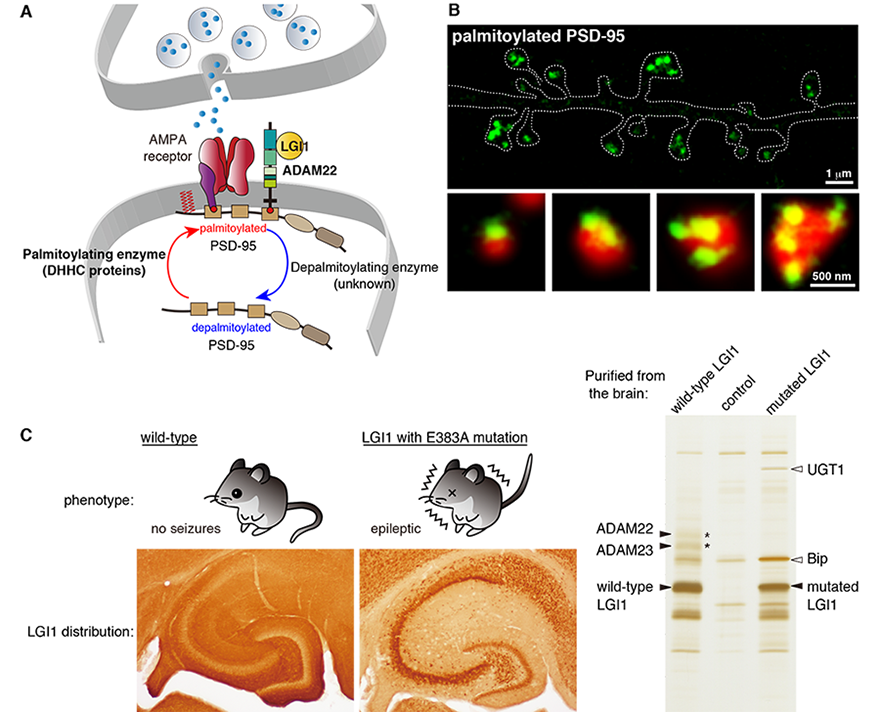
我々は、記憶や学習の分子基盤をなすと考えられているAMPA受容体の制御機構について研究を展開しています(現在の脳科学の最重要課題の一つです)。AMPA受容体は足場蛋白質であるPSD-95に結合することでシナプス後部に局在し、イオンチャネルとして機能します。したがって、シナプスに存在するAMPA受容体量はシナプス後部に存在する足場蛋白質PSD-95の量と機能に依存すると言えます。これまでに、我々は特異性と定量性を重視した生化学的手法に基づいて、2種類のAMPA受容体制御分子を独自に発見しました。一つ目は、PSD-95のシナプス局在を規定するパルミトイル化脂質修飾酵素DHHC、もう一つは、PSD-95の主要な結合蛋白質として同定したてんかん関連リガンド・受容体LGI1・ADAM22です(詳細はそれぞれのページをご覧下さい)。
さらに、パルミトイル化酵素ライブラリースクリーニング法やパルミトイル化蛋白質の可視化プローブなど新しい実験手法を開発してきました。超解像顕微鏡イメージング、質量分析法、電気生理学、マウス遺伝学などを組み合わせて、これらAMPA受容体制御分子の生理機能と脳病態(てんかんや自己免疫性脳炎)における破綻メカニズムの一端を先導的に明らかにしてきました(図B,C)。今後は、これらAMPA受容体制御分子がいかにしてシナプス伝達の可塑的側面、さらにはマウス・ヒトの記憶、学習、認知機能を制御するのかを明らかにします。
本研究部門では、下記のような独自あるいは最先端の手法を用いて研究を進めています。また、これらの手法を国内外の研究室と広く共有して、多くの共同研究を展開しています。
1)脳内シナプス蛋白質複合体の精製と構成分子の同定
2)パルミトイル化酵素ライブラリーを用いた酵素・基質ペアのスクリーニング
3)パルミトイル化基質特異的プローブを用いた生細胞イメージング
4)超解像顕微鏡を用いたシナプス観察
5)LGI1変異体に着目したてんかん病態モデルマウスを用いた解析
6)DHHC酵素、LGI1・ADAM22を標的とした創薬開発に向けた基礎研究
共に興味を分かち合い、世界に情報発信したいと望む若者を募集しています。