膜タンパク質の機能解析法 -アフリカツメガエル卵母細胞を用いた発現系について-
|
| |
【特徴】
アフリカツメガエルは、一年を通して安定して水槽での飼育が可能であり、容易に卵を扱えるため、機能分子の強制発現系として有用です。また、微小電極膜電位固定法、パッチクランプ法、cut-open法など、目的に応じた計測法が選べるのも大きな利点です。ここではIn
vitro transcriptionにより合成したpolyA-RNAをmicroinjectionにより卵細胞の細胞質へ導入し、培養後、微小電極を用いた電気生理学的記録を行なう実験手技について解説します。詳細は、Methods
in Enzymology、207巻などを参照すると良いと思います。
【卵母細胞の単離(カエルの手術)】
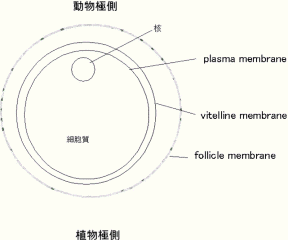 Oocyteは、外側の血管および結合組織からなるfollicle membraneと、その内側の硬い透明な細胞外器質であるvitelline
membraneの、2種類の膜により覆われています。微小電極法で記録するには、外側のfollicle membraneを除去する必要があり、patch
clamp法を適用するには、さらに、vitelline membraneを除去する必要があります。follicle
membraneを除く方法としては、Collagenaseで化学的に消化して単離する方法と、先の細いピンセット(ビガーとかデュモン社など No.5)で剥ぐ方法があります。前者は、大量のoocyteを得るのに適していますが、腹のバッチごとに酵素が効きすぎると細胞にダメージが大きくなり、良い細胞を選別して用いる必要があります。後者は、細胞への侵襲は少ないものの、一度にたくさんの細胞の処理が困難です。複数の実験者が一度に実験する場合、前者は効率が良く、生化学的解析にも適しています。
Oocyteは、外側の血管および結合組織からなるfollicle membraneと、その内側の硬い透明な細胞外器質であるvitelline
membraneの、2種類の膜により覆われています。微小電極法で記録するには、外側のfollicle membraneを除去する必要があり、patch
clamp法を適用するには、さらに、vitelline membraneを除去する必要があります。follicle
membraneを除く方法としては、Collagenaseで化学的に消化して単離する方法と、先の細いピンセット(ビガーとかデュモン社など No.5)で剥ぐ方法があります。前者は、大量のoocyteを得るのに適していますが、腹のバッチごとに酵素が効きすぎると細胞にダメージが大きくなり、良い細胞を選別して用いる必要があります。後者は、細胞への侵襲は少ないものの、一度にたくさんの細胞の処理が困難です。複数の実験者が一度に実験する場合、前者は効率が良く、生化学的解析にも適しています。
 用意するもの
用意するもの
○培養液 ND96+
○組成
○96 mM NaCl
○2 mM KCl
○1.8 mM CaCl2
○1
mM MgCl2
○5 mM HEPES, pH7.5 with NaOH,
○80 microgram/ml Penicillin G
(Sigma)
○100 microgram/ml Streptomycin (Sigma)
○Sodium pyruvate 550
mg/liter)(Wako)
無機塩とHEPESを含む10x
ND96溶液を作りオートクレーブしておいて室温で保存する。また、PenicillinGとStreptomycin、Sodium
pyruvateはfilter滅菌した高濃度溶液を用意しておく。
ND96+を作るときには、10x
ND96を、滅菌蒸留水で薄め、これにPenicillinG,Streptomycin, sodium pyruvateを加えて作る。
 ○酵素 Collagenase S-1 (新田ゼラチン 株式会社生物化学研究所)
○酵素 Collagenase S-1 (新田ゼラチン 株式会社生物化学研究所)
○麻酔薬 3-AminobenzoicAcid
Ethl Ester (Sigma, #A5040)
○酵素処理用Ca-free溶液
(OR2-Ca-free)組成(82.5 mM NaCl, 2mM KCl, 1mM
MgCl2, 5 mM HEPES, pH 7.5, with NaOH)
ND96の時と同様、10x OR2
Ca(-)溶液を作っておき、滅菌蒸留水で薄めて1xを作って、使う。
 ○手術道具一式
○手術道具一式
パスツールピペット(オートクレーブ済み。先端をアンプルカッターなどで折り、バーナーで丸くしておく。小さめから大き目の物と二種類を用意しておく。1回使用したものでも、アルコールにつけて保存しておけば、再利用可能)
手術道具―はさみ(またはメス)、ピンセット二つ(70%エタノールで拭いて置く)、小動物用ナイロン糸、針
ファルコン50
mm径プラスチックシャーレ
50 mlコニカルチューブ
 カエルの麻酔処理
カエルの麻酔処理
カエルは麻酔下で手術を行う。
1)4リットル程度の大きさのバケツかビーカーに1リットルの蒸留水を入れ、2g/Lの3-AminobenzoicAcid Ethl
Esterを溶かす。(すぐ解けるが、一応水をふって完全にとかす)
2)大き目の発泡スチロールの箱に氷をいれ、これに上のバケツを乗せて、冷やしておく。(または、麻酔薬を溶かしたバケツを冷蔵庫かコールドルームに入れて、冷やしておく)
カエルをいれる。ふたをしておく(カエルは、ひとがいないところで簡単に外へ逃げる)。30分程度で麻酔がかかる。ひっくり返してみて、起き上がらなければ、大丈夫。
平らな皿に氷を敷き、その上にカエルを仰向きに置く。乾燥しすぎたり、冷たすぎると、皮膚を損傷するので、ときどき、ミリQ水をかける。
 卵母細胞の採取
卵母細胞の採取
カエルが眠ったのを確認したら腹部を切開して卵母細胞を採り出す。
 3)ハサミまたはメスを用いて、カエル腹部の皮膚、正中線から外側へ1/2程度の箇所に、1cm程度の切開を入れる(外側に向かって前に45度程度の角度になるような感じ。カエルにヘソはないのだが、仮想的な「ヘソ」のあたりから斜め上方向)。筋膜が見えるので、小型のハサミで奥の臓器を傷つけないように1cm程度切る。筋が切れると奥に黒い組織(卵巣)が見える。隙間からピンセットで引っ張りovary
lobeをとりだす。ピンセット二つを使い、まず一つで一端をつかみ、すこし引っ張り出す。ちぎれそうなら、べつの方向に引っ張る。これを繰り返すとちぎれずに取り出せる。無理に引っ張ると卵巣が崩れてしまうので、だましだまし色々な角度に引いてみる。適当な大きさが出たら、ハサミで切り取り、ND96の入ったシャーレへ移す。以前のオペのあとは避ける。(右側に傷があれば、左側をオペする)残った卵巣は、ピンセットの先で、腹部を傷つけないようにして戻し込む。
3)ハサミまたはメスを用いて、カエル腹部の皮膚、正中線から外側へ1/2程度の箇所に、1cm程度の切開を入れる(外側に向かって前に45度程度の角度になるような感じ。カエルにヘソはないのだが、仮想的な「ヘソ」のあたりから斜め上方向)。筋膜が見えるので、小型のハサミで奥の臓器を傷つけないように1cm程度切る。筋が切れると奥に黒い組織(卵巣)が見える。隙間からピンセットで引っ張りovary
lobeをとりだす。ピンセット二つを使い、まず一つで一端をつかみ、すこし引っ張り出す。ちぎれそうなら、べつの方向に引っ張る。これを繰り返すとちぎれずに取り出せる。無理に引っ張ると卵巣が崩れてしまうので、だましだまし色々な角度に引いてみる。適当な大きさが出たら、ハサミで切り取り、ND96の入ったシャーレへ移す。以前のオペのあとは避ける。(右側に傷があれば、左側をオペする)残った卵巣は、ピンセットの先で、腹部を傷つけないようにして戻し込む。

 縫合処理
縫合処理
カエルの腹を縫合して水槽に戻す。
4)筋層、皮膚をそれぞれ3針ずつ程度縫う。
バケツの麻酔薬の入った水を、あたらしい水に交換しカエルを水に戻す。10分程度したら、覚醒するので、カエルを水槽に戻す。手術したカエルは、弱っていると同時に、卵巣の再生には時間がかかる(数ヶ月程度)ので、リカバリー水槽として区別した水槽へ入れて飼育する(オペを行なった日時を記載しておき、決まった時期まで封印する)。
卵は黒と白がはっきり分かれており、黒い部分がはがれていないほうが良い。以前手術してあると、卵が体壁に癒着していたりして、その場合には卵はよくないことが多い。
この時点で卵の調子がよくないようなら、もう1匹さばく。(我々のっ研究室では、2匹を並行してさばくことを心がけている。Oocyteでの実験はバッチの良さによることが多く、腹がわるいと全く発現が見られない場合すらある。もともとの悪いカエルが同定できれば良いが、実験をするまで(記録をとるまで)見かけだけではわからないことがある。)
 卵母細胞をほぐす
卵母細胞をほぐす
採り出した卵を酵素処理によってバラバラにする。
5)Collagenase S-1をOR2-Ca-free溶液に溶かす。1mg/mlの濃度になるように。50 mlのコニカルチューブに約25
mlずつ、二つ用意する(計50 ml)。容量は、単離したovary lobeのサイズによって変える。
 6)ピンセット二つを用いて、卵巣の一番外側にある結合組織をほぐす。卵巣は袋状になっていていわば葡萄の房状態である。ただし、葡萄と違って、卵は、茎についているのではなく、一番外側の結合組織(血管を含む)についているので、外側を引き裂いていくことで房が袋状のものからフラットに変わる(ビニール袋に切開を入れて、1枚のビニールシートにするような感じ)。
6)ピンセット二つを用いて、卵巣の一番外側にある結合組織をほぐす。卵巣は袋状になっていていわば葡萄の房状態である。ただし、葡萄と違って、卵は、茎についているのではなく、一番外側の結合組織(血管を含む)についているので、外側を引き裂いていくことで房が袋状のものからフラットに変わる(ビニール袋に切開を入れて、1枚のビニールシートにするような感じ)。
7)OR2を、50
mmシャーレに、3つ分くらい用意する。卵巣の房の一端をピンセットでもって、新しいOR2へ移す。
これを3回ほど行う。(死んだ卵をあらいおとすステップ)ピンセットで卵塊をつかんで、OR2-collagenase(1.0 mg/ml)入りの50
mlコニカルチューブへ移す。
 8)Nutator(タイテック、MILD MIXER
PR-12など)で、揺らしながら、室温でインキュベートする。30分から40分。nutatorにはチューブを紙テープなどで固定して、落ちないように注意する。
8)Nutator(タイテック、MILD MIXER
PR-12など)で、揺らしながら、室温でインキュベートする。30分から40分。nutatorにはチューブを紙テープなどで固定して、落ちないように注意する。
50 mlコニカルチューブをゆっくり傾けてみて、卵がどの程度バラけているか見る。ほとんど、かたまりになっているようなら、まだ酵素処理がたりない。また、溶液のにごりも見る。かなり不透明なら、酵素をかえる。透明なら、効きがわるいので、さらにincubateする。
9)パスツールピペット(先端を直径5 mmくらいの大き目のサイズ)で、ふわっと数度ピペッティングする。ピペットのなかに卵を入れるというより、ピペットで、溶液をまぜながら、卵に吹きかける感じ。あわを入れないように注意する。これで、かなり酵素が満遍なく効いてくれる。
10)剥きの状態をチェックするため、卵を10個程度、先が大きめのパスツールピペットでとりだし、実体顕微鏡下で、観察して、follicle
membraneが剥けたかどうかチェックする。
すべての卵をバラバラにするのではなく、なるべく多くの卵が平面にくっついているような状態へもっていく。このステップは後での酵素処理の効率と均一なかかりかたに影響するので、卵をあまり傷つけないように丁寧に行なう。
むけ具合:つるっぱげが多い→むきすぎ。
卵の半数以上で、靴下の一部が破れたようにfollicle
membraneがやぶれている感じ(卵の一部がやや突出しているようにみえることもある)→ちょうど良い
ほとんどむけていない。血管などが表面にかなり残っている→足りない
洗っている作業で、かなりむけていくので、チェックする段階でかなりむけているとむけすぎ。細胞の1-3割の数が、むけている程度がちょうど良い。
11)むきがOKと判断したら、50
mlコニカルチューブから、デカントで、上澄みをすてる。あたらしいOR2をくわえ、またデカントする。3,4度くりかえす。上澄みが透明になるまで繰り返す。
12)2-3枚のファルコン50mmシャーレにOR2を分注し、卵をパスツールピペットで順次移す。ピペットで卵を洗いながら、3度繰り返す。この操作により、一旦床に卵がfollicle
membraneでくっつき、ピペットで洗うときに、卵だけが剥がれてくることで、follicle
membraneが剥ける。
13)顕微鏡下で、よい卵を選別し、ND96(50
mmシャーレ)に移す。
4,5時間おいて、さらに悪い卵を除く。
酵素の効きが強かったときは、一晩おいて、良い卵を選別する。
【遺伝子導入(RNAインジェクション)】
 用意するもの
用意するもの
 ○Drummondのinjector(たとえば、Nanoinjector、Drummond製、フナコシ)と中芯のないガラスキャピラリー(径1mm)(例えばDrummond製)
○Drummondのinjector(たとえば、Nanoinjector、Drummond製、フナコシ)と中芯のないガラスキャピラリー(径1mm)(例えばDrummond製)
○White light mineral oil(Sigma)
○パラフィルム
○実体顕微鏡(落射照明付き)
○50 mm径プラスチックシャーレ
○滅菌したガーゼを小さく切ったもの
○ピンセット
RNAは、安定な蛋白であるRNaseにより容易に分解を受けるので、コンタミネーションを起さないように慎重に扱う。(分子生物学の参考書を参照)
 14)mMessage mMachineキット(Ambion)を用いてプロトコール通りRNAを合成する。ただし、合成後のDNase-I処理はRNAのクオリティーを悪くする場合があるので、省く。反応液の一部(10%-5%)を、通常のnon-denaturing
agarose gelで電気泳動して、RNAのクオリティーを確認する。RNAの精製はフェノール抽出により行なう。フェノールは細胞に有害なので、フェノール抽出後、クロロフォルム抽出を最低二度行なう。その後、NH4AcetateとIsopropanolで沈殿させ、20マイクロリットルの手術用の水(大塚)に溶かして、2マイクロリットルずつ10本程度(0.5
mlエッペンドルフチューブ)に分注しておく。ラベルして、Deep freezerに保存しておく。どのくらいの濃度のRNAを用いるかは実験の目的による。例えば、電位依存性Kvチャネル(Shaker
type)やNavチャネルmu1 (Nav1.4)は、1/10希釈でも濃いくらい。一度pilot実験で、様々な濃度のRNA溶液をinjectしてみて、適当な電流量が得られる濃度を調べてみると良い。また、Na
channelなどでは、gating currentの測定などのように、大量に発現させるためにTTXなどを培養液に加えておくこともある。
14)mMessage mMachineキット(Ambion)を用いてプロトコール通りRNAを合成する。ただし、合成後のDNase-I処理はRNAのクオリティーを悪くする場合があるので、省く。反応液の一部(10%-5%)を、通常のnon-denaturing
agarose gelで電気泳動して、RNAのクオリティーを確認する。RNAの精製はフェノール抽出により行なう。フェノールは細胞に有害なので、フェノール抽出後、クロロフォルム抽出を最低二度行なう。その後、NH4AcetateとIsopropanolで沈殿させ、20マイクロリットルの手術用の水(大塚)に溶かして、2マイクロリットルずつ10本程度(0.5
mlエッペンドルフチューブ)に分注しておく。ラベルして、Deep freezerに保存しておく。どのくらいの濃度のRNAを用いるかは実験の目的による。例えば、電位依存性Kvチャネル(Shaker
type)やNavチャネルmu1 (Nav1.4)は、1/10希釈でも濃いくらい。一度pilot実験で、様々な濃度のRNA溶液をinjectしてみて、適当な電流量が得られる濃度を調べてみると良い。また、Na
channelなどでは、gating currentの測定などのように、大量に発現させるためにTTXなどを培養液に加えておくこともある。
 15)1mm径のガラスキャピラリーをプラー(例えばサッターP97)で一段でひく。先のきれいなピンセットで、引いたガラス管の先を直視下で折る。顕微鏡で、先端の径が25-40ミクロン程度になるようになるまで折る。
15)1mm径のガラスキャピラリーをプラー(例えばサッターP97)で一段でひく。先のきれいなピンセットで、引いたガラス管の先を直視下で折る。顕微鏡で、先端の径が25-40ミクロン程度になるようになるまで折る。
キャピラリーにミネラルオイルを詰める(1mlのテルモシリンジと星盛堂医療器工業株式会社の径の細い「吸上針」などを用いる)。ガラスキャピラリーに泡がはいらないように注意する。Injectorの容量の位置が真ん中位になるように、調節しておく。Injectorのプランジャー(中芯の金属棒)に、Oリング、ガラス管、アダプターの順序になるように取り付ける。針先がちゃんとした太さになっていれば、先からオイルが漏れるのがわかる。先端からオイルが漏れてこなくて、プランジャーを挿入していくのに抵抗を感じるようなら、先端の太さが十分でないので、先端を更に折る。
16)適当なサイズに切って滅菌してあるガーゼを用意し、50 mm径のシャーレのふたに、一枚おき、ND96に浸しておく。あまりND96が多くならないように水面を低めにしておく。ガーゼの上に、Injectionする卵を10個程度、ある程度の間隔で並べておく。
 17)実体顕微鏡のステージに、2cm角程度で切ったパラフィルムを十字におり、その真ん中にRNAの溶液を、マイクロピペットを用いて滴下する。パラフィルムは水をはじくので丸い玉になる。実体顕微鏡下で、RNA溶液の玉の中へガラス管の先端を挿入し、泡がないことを確認してから、吸い込む。RNAの溶液は往々にして粘稠であるためガラス管が詰まってしまうことがある。その場合には、一旦RNAの溶液の一部をガラス管から押し出し、また吸い込む。これを繰り返しているうちに全部が吸い込める。吸い込むのに時間をかけすぎるとRNAが壊れたり、蒸発してしまって濃度が不正確になるので注意する。
17)実体顕微鏡のステージに、2cm角程度で切ったパラフィルムを十字におり、その真ん中にRNAの溶液を、マイクロピペットを用いて滴下する。パラフィルムは水をはじくので丸い玉になる。実体顕微鏡下で、RNA溶液の玉の中へガラス管の先端を挿入し、泡がないことを確認してから、吸い込む。RNAの溶液は往々にして粘稠であるためガラス管が詰まってしまうことがある。その場合には、一旦RNAの溶液の一部をガラス管から押し出し、また吸い込む。これを繰り返しているうちに全部が吸い込める。吸い込むのに時間をかけすぎるとRNAが壊れたり、蒸発してしまって濃度が不正確になるので注意する。
18)並べたoocyteにRNAを注入する。マイクロマニピュレーターを操作して針をoocyteの細胞膜におしつけていくとくぼみができる。更に押していくと、細胞膜がポッと戻って、歪むがキャンセルされる。この「戻り」で、針が中に入ったことが感じられる。ここでInjectorの陽圧をかけると卵が膨れるので、RNAが入ることがわかる。膨れるのがわからないときには、針が詰まっているか、針先がちゃんと細胞内に入っていないことが多いので注意する。入る量は、針の先端のサイズが小さいと少なくなる。また、RNAの濃度が濃かったり蛋白の除去が不完全だと粘稠となり、はやりinjectionされる量は少なくなる。従って、注入された量は、microinjectorのメモリや設定よりも、実際に何個の細胞に入ったかで推定した方が、より正確である。実験目的にもよるが、一種類のRNAについて最低10個程度の細胞にinjectする。
19)Injectした卵は、ND96の入った35mmのdishに移し、簡単に洗ったあとで、①ほかのND96+を含む35 mmのdishで培養する、または②48穴などのmultiwellにoocyteを1つずつ入れ、培養する。①は、時間がかからないが、毎日溶液を交換する必要があり、またひとつの細胞が死んだら、ほかの細胞まで死に易くなる(細胞外へKイオンが漏れ、またbacteriaの栄養が増えるためと言われる)。②は、時間がかかるが、2-3日溶液を交換する必要がない上に、細胞が個別の空間に入っているので死んだ細胞がほかの細胞へ悪さする心配がない。
20)別の種類のRNAをinjectするときは、injectionするときの皿のガーゼと溶液を交換し、ガラス針も交換する。
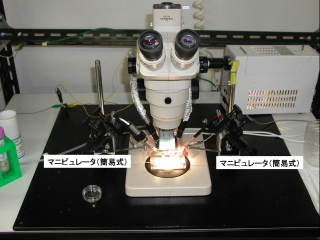
【電気生理学的測定(微小電極を用いた電位固定法によるイオン電流の解析)】
 用意するものおよび装置
用意するものおよび装置

 ○微小電極電位固定記録用アンプ:Oocyte Clamp 725C
(Warner Instruments
Co.)
○微小電極電位固定記録用アンプ:Oocyte Clamp 725C
(Warner Instruments
Co.)
○実体顕微鏡、落射照明装置
○3次元マイクロマニピュレーター(ナリシゲ製M152など。粗動のみで大丈夫)
○還流装置と細胞を置くチャンバー(手製で良い)
○ハート型のアンプルカッター
○中芯入りのガラスキャピラリー(図左、Harvard
GC150-10TFなど)
二本の微小電極を使った膜電位固定法は、最も古典的な膜電位固定法であるがoocyteのように大きい細胞には適用しやすく、パッチクランプのように針を毎回変える必要がないので、短時間に多くの実験が可能である。Warner
Instruments Co.のOocyte
Clampは、大容量、低抵抗の大きな細胞(ツメガエル卵母細胞、イカ巨大軸索など)に合うように設計されたアンプで、電流を流す電極(Current
electrode; Ve)と、膜電位を測るための電極(Potential Electrode;
Vm)の二本で細胞内の電位を固定すると同時に、細胞外を二本の銀線電極を用いて電位固定する。細胞膜をよぎって流れるイオン電流を、抵抗の少ないbath
electrodeを介して記録する。
21)各電極の銀線を通常の方法によって鍍金する。
22)通常oocyteでは、解析するチャネルの種類によって状況は異なるがCurrent
electrodeは、3M濃度の KClを入れた状態で、電極抵抗を1 Mohm
以下、Vm電極は2Mohm以下にする。ガラスキャピラリーを、アンプのホールダーに取り付ける際に、ガラスキャピラリーの端でサッターなどのプラーで中芯入りガラスキャピラリーを引いた後、実体顕微鏡下で先端をハート型アンプルカッターに軽くぶつけて折る。
23)3M
KClを先端から中1/3程度入れる。中芯が入っているため、先端に泡が多少入っていても問題ない。それぞれのガラスキャピラリーをアンプのホールダーにとりつけ、bathの溶液につける。このとき、二つのことを行う。①電極抵抗を測る。適当な電極抵抗が得られるまで、先端を折る(チャンバーの底に押し付けておるのが簡単。時々、もっとも先端に泡やごみが入ってしまい抵抗が下がらないことがある。その場合は、一旦取り出して、指で軽くたたいて、泡を除くと良い)。②ゼロオフセットを合わせる(つまり、針が細胞の外の溶液にあるときに、0
mVになるように設定する)。
 24)マニピュレーターを操作し、二本の針を細胞膜へ直角に当たるように近づける。二本の針の角度はなるべく大きく取ったほうがノイズが小さく、また電位固定が確実になる。RNAのinjectionのときと同じように、細胞膜を突き抜けるときに「戻り」を感じることができる。細胞内に入ると静止電位が出て、ゼロレベルから動き二つの針を入れたときには、VeもVmの計測値もほぼ同じ値になるはずである。
24)マニピュレーターを操作し、二本の針を細胞膜へ直角に当たるように近づける。二本の針の角度はなるべく大きく取ったほうがノイズが小さく、また電位固定が確実になる。RNAのinjectionのときと同じように、細胞膜を突き抜けるときに「戻り」を感じることができる。細胞内に入ると静止電位が出て、ゼロレベルから動き二つの針を入れたときには、VeもVmの計測値もほぼ同じ値になるはずである。
注意すること:
1、
Caを通すチャネルを調べる場合には、内在性Ca依存性Cl電流の活性化が同時に起こってしまうので、これらをブロックする必要がある。(または逆にこれを利用して細胞内Ca濃度の増えをCl電流として検出することもできる)
2、
速い膜電位固定を行なう必要がある場合(A-type potassium currentやsodium
current)では、小さめのoocyteを特に用いると良い。
観察例:
GFPをfusionさせたCaチャネルのRNAを発現させ、数日後に蛍光顕微鏡により観察した例。右下の細胞は、何も注入していない細胞。
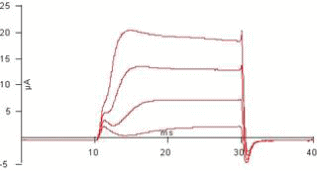
電位依存性Kチャネルを発現させ膜電位固定法により-10
mV, 0 mV, 10 mV, 20
mVへ脱分極パルスを振って膜電流を記録している。1-2ms以内に外向き(トレースで上向き)のゲート電流に続いて、外向きKイオン電流が観察される。

Copyrightc2009 NIPS Technical Division. All Rights Reserved.
 Oocyteは、外側の血管および結合組織からなるfollicle membraneと、その内側の硬い透明な細胞外器質であるvitelline
membraneの、2種類の膜により覆われています。微小電極法で記録するには、外側のfollicle membraneを除去する必要があり、patch
clamp法を適用するには、さらに、vitelline membraneを除去する必要があります。follicle
membraneを除く方法としては、Collagenaseで化学的に消化して単離する方法と、先の細いピンセット(ビガーとかデュモン社など No.5)で剥ぐ方法があります。前者は、大量のoocyteを得るのに適していますが、腹のバッチごとに酵素が効きすぎると細胞にダメージが大きくなり、良い細胞を選別して用いる必要があります。後者は、細胞への侵襲は少ないものの、一度にたくさんの細胞の処理が困難です。複数の実験者が一度に実験する場合、前者は効率が良く、生化学的解析にも適しています。
Oocyteは、外側の血管および結合組織からなるfollicle membraneと、その内側の硬い透明な細胞外器質であるvitelline
membraneの、2種類の膜により覆われています。微小電極法で記録するには、外側のfollicle membraneを除去する必要があり、patch
clamp法を適用するには、さらに、vitelline membraneを除去する必要があります。follicle
membraneを除く方法としては、Collagenaseで化学的に消化して単離する方法と、先の細いピンセット(ビガーとかデュモン社など No.5)で剥ぐ方法があります。前者は、大量のoocyteを得るのに適していますが、腹のバッチごとに酵素が効きすぎると細胞にダメージが大きくなり、良い細胞を選別して用いる必要があります。後者は、細胞への侵襲は少ないものの、一度にたくさんの細胞の処理が困難です。複数の実験者が一度に実験する場合、前者は効率が良く、生化学的解析にも適しています。
 ○酵素 Collagenase S-1 (新田ゼラチン 株式会社生物化学研究所)
○酵素 Collagenase S-1 (新田ゼラチン 株式会社生物化学研究所) ○手術道具一式
○手術道具一式 3)ハサミまたはメスを用いて、カエル腹部の皮膚、正中線から外側へ1/2程度の箇所に、1cm程度の切開を入れる(外側に向かって前に45度程度の角度になるような感じ。カエルにヘソはないのだが、仮想的な「ヘソ」のあたりから斜め上方向)。筋膜が見えるので、小型のハサミで奥の臓器を傷つけないように1cm程度切る。筋が切れると奥に黒い組織(卵巣)が見える。隙間からピンセットで引っ張りovary
lobeをとりだす。ピンセット二つを使い、まず一つで一端をつかみ、すこし引っ張り出す。ちぎれそうなら、べつの方向に引っ張る。これを繰り返すとちぎれずに取り出せる。無理に引っ張ると卵巣が崩れてしまうので、だましだまし色々な角度に引いてみる。適当な大きさが出たら、ハサミで切り取り、ND96の入ったシャーレへ移す。以前のオペのあとは避ける。(右側に傷があれば、左側をオペする)残った卵巣は、ピンセットの先で、腹部を傷つけないようにして戻し込む。
3)ハサミまたはメスを用いて、カエル腹部の皮膚、正中線から外側へ1/2程度の箇所に、1cm程度の切開を入れる(外側に向かって前に45度程度の角度になるような感じ。カエルにヘソはないのだが、仮想的な「ヘソ」のあたりから斜め上方向)。筋膜が見えるので、小型のハサミで奥の臓器を傷つけないように1cm程度切る。筋が切れると奥に黒い組織(卵巣)が見える。隙間からピンセットで引っ張りovary
lobeをとりだす。ピンセット二つを使い、まず一つで一端をつかみ、すこし引っ張り出す。ちぎれそうなら、べつの方向に引っ張る。これを繰り返すとちぎれずに取り出せる。無理に引っ張ると卵巣が崩れてしまうので、だましだまし色々な角度に引いてみる。適当な大きさが出たら、ハサミで切り取り、ND96の入ったシャーレへ移す。以前のオペのあとは避ける。(右側に傷があれば、左側をオペする)残った卵巣は、ピンセットの先で、腹部を傷つけないようにして戻し込む。
 6)ピンセット二つを用いて、卵巣の一番外側にある結合組織をほぐす。卵巣は袋状になっていていわば葡萄の房状態である。ただし、葡萄と違って、卵は、茎についているのではなく、一番外側の結合組織(血管を含む)についているので、外側を引き裂いていくことで房が袋状のものからフラットに変わる(ビニール袋に切開を入れて、1枚のビニールシートにするような感じ)。
6)ピンセット二つを用いて、卵巣の一番外側にある結合組織をほぐす。卵巣は袋状になっていていわば葡萄の房状態である。ただし、葡萄と違って、卵は、茎についているのではなく、一番外側の結合組織(血管を含む)についているので、外側を引き裂いていくことで房が袋状のものからフラットに変わる(ビニール袋に切開を入れて、1枚のビニールシートにするような感じ)。 8)Nutator(タイテック、MILD MIXER
PR-12など)で、揺らしながら、室温でインキュベートする。30分から40分。nutatorにはチューブを紙テープなどで固定して、落ちないように注意する。
8)Nutator(タイテック、MILD MIXER
PR-12など)で、揺らしながら、室温でインキュベートする。30分から40分。nutatorにはチューブを紙テープなどで固定して、落ちないように注意する。 ○Drummondのinjector(たとえば、Nanoinjector、Drummond製、フナコシ)と中芯のないガラスキャピラリー(径1mm)(例えばDrummond製)
○Drummondのinjector(たとえば、Nanoinjector、Drummond製、フナコシ)と中芯のないガラスキャピラリー(径1mm)(例えばDrummond製) 14)mMessage mMachineキット(Ambion)を用いてプロトコール通りRNAを合成する。ただし、合成後のDNase-I処理はRNAのクオリティーを悪くする場合があるので、省く。反応液の一部(10%-5%)を、通常のnon-denaturing
agarose gelで電気泳動して、RNAのクオリティーを確認する。RNAの精製はフェノール抽出により行なう。フェノールは細胞に有害なので、フェノール抽出後、クロロフォルム抽出を最低二度行なう。その後、NH4AcetateとIsopropanolで沈殿させ、20マイクロリットルの手術用の水(大塚)に溶かして、2マイクロリットルずつ10本程度(0.5
mlエッペンドルフチューブ)に分注しておく。ラベルして、Deep freezerに保存しておく。どのくらいの濃度のRNAを用いるかは実験の目的による。例えば、電位依存性Kvチャネル(Shaker
type)やNavチャネルmu1 (Nav1.4)は、1/10希釈でも濃いくらい。一度pilot実験で、様々な濃度のRNA溶液をinjectしてみて、適当な電流量が得られる濃度を調べてみると良い。また、Na
channelなどでは、gating currentの測定などのように、大量に発現させるためにTTXなどを培養液に加えておくこともある。
14)mMessage mMachineキット(Ambion)を用いてプロトコール通りRNAを合成する。ただし、合成後のDNase-I処理はRNAのクオリティーを悪くする場合があるので、省く。反応液の一部(10%-5%)を、通常のnon-denaturing
agarose gelで電気泳動して、RNAのクオリティーを確認する。RNAの精製はフェノール抽出により行なう。フェノールは細胞に有害なので、フェノール抽出後、クロロフォルム抽出を最低二度行なう。その後、NH4AcetateとIsopropanolで沈殿させ、20マイクロリットルの手術用の水(大塚)に溶かして、2マイクロリットルずつ10本程度(0.5
mlエッペンドルフチューブ)に分注しておく。ラベルして、Deep freezerに保存しておく。どのくらいの濃度のRNAを用いるかは実験の目的による。例えば、電位依存性Kvチャネル(Shaker
type)やNavチャネルmu1 (Nav1.4)は、1/10希釈でも濃いくらい。一度pilot実験で、様々な濃度のRNA溶液をinjectしてみて、適当な電流量が得られる濃度を調べてみると良い。また、Na
channelなどでは、gating currentの測定などのように、大量に発現させるためにTTXなどを培養液に加えておくこともある。 15)1mm径のガラスキャピラリーをプラー(例えばサッターP97)で一段でひく。先のきれいなピンセットで、引いたガラス管の先を直視下で折る。顕微鏡で、先端の径が25-40ミクロン程度になるようになるまで折る。
15)1mm径のガラスキャピラリーをプラー(例えばサッターP97)で一段でひく。先のきれいなピンセットで、引いたガラス管の先を直視下で折る。顕微鏡で、先端の径が25-40ミクロン程度になるようになるまで折る。


 ○微小電極電位固定記録用アンプ:Oocyte Clamp 725C
(Warner Instruments
Co.)
○微小電極電位固定記録用アンプ:Oocyte Clamp 725C
(Warner Instruments
Co.) 24)マニピュレーターを操作し、二本の針を細胞膜へ直角に当たるように近づける。二本の針の角度はなるべく大きく取ったほうがノイズが小さく、また電位固定が確実になる。RNAのinjectionのときと同じように、細胞膜を突き抜けるときに「戻り」を感じることができる。細胞内に入ると静止電位が出て、ゼロレベルから動き二つの針を入れたときには、VeもVmの計測値もほぼ同じ値になるはずである。
24)マニピュレーターを操作し、二本の針を細胞膜へ直角に当たるように近づける。二本の針の角度はなるべく大きく取ったほうがノイズが小さく、また電位固定が確実になる。RNAのinjectionのときと同じように、細胞膜を突き抜けるときに「戻り」を感じることができる。細胞内に入ると静止電位が出て、ゼロレベルから動き二つの針を入れたときには、VeもVmの計測値もほぼ同じ値になるはずである。
