研究活動の概要
生理学研究所は、生理学・神経科学の領域における幅広い研究分野において、以下に示すように基盤的学術研究を展開し、脊髄損傷により生じた手の運動障害の機能回復に大脳皮質が深く関与することを発見する等の研究成果をあげた。
(1) 機能分子の働きとその動作・制御メカニズムの解明
電位依存性酵素VSPが脱分極により酵素活性が上昇すること、通常の電位依存性チャネルの動作原理と共通の機構が存在することを見いだした (Murata & Okamura, J Physiol)。
KCNQ チャネルの膜電位センサーの動きが、付加サブユニットKCNQ により、固定されることを明らかにした (Nakajo & Kubo,J Gen Physiol)。
(2) 生体恒常性維持機構と脳神経情報処理機構の解明
容積センサーアニオンチャネル活性化による細胞膨張が、過興奮毒性時における脳ニューロンのネクローシス死の誘導に関与することを明らかにした (Inoue & Okada, J Neurosci)。
温度感受性チャネルTRPV4が海馬神経細胞に発現して体温下で恒常的に活性化し、神経細胞の興奮性に関与することを明らかにした (Shibasaki et al., J Neurosci)。
侵害刺激受容に関わるTRPA1の新たな活性化機構を明らかにした (Dai et al., J Clin Invest)。
レプチンがAMPキナーゼの細胞内局在を変化させることによってその作用を引き起こすこと、並びにその分子機作を明らかにした (Suzuki et al., Mol Cell BIol)。
胎生期に転写因子Dmbx1が脳幹において一過性発現することが成長後の摂食調節に必須であることを明らかにした (Fujimoto et al., Proc Natl Acad Sci USA)。
聴覚中経路核において興奮性入力による抑制性入力の制御機構の発達変化を明らかにした (Nishimaki et al., Eur J Neurosci)。
SDS凍結割断レプリカ標識法により小脳シナプスにおけるAMPA受容体の数と密度を測定した (Masugi-Tokita et al., J Neurosci)。
(3) 認知行動機能の解明
大脳基底核のうち淡蒼球の発射活動が、GABA, グルタミン酸、セロトニンなどにより調節されるメカニズムを明らかにした (Tachibana et al., Eur J Neurosci)。
黒質網様部から中脳上丘の抑制性介在ニューロンへのGABA作動性抑制性投射を明らかにし、大脳基底核の新しい機能を提唱した (Kaneda et al., J Neurosci)。
皮質脊髄路を頚髄レベルで切断したサルにおける手指の精密運動機能の回復過程を、PETイメージング等を用いて解析し、障害された手の反対側の一次運動野の拡大した領域と両側の運動前野腹側部が回復に寄与することを明らかにした (Nishimura et al., Science)。
(4) より高度な認知行動機構の解明
実際の痛み刺激ではなく痛そうな画像を見て感じる「心の痛み」の発生機序を機能的磁気共鳴画像を用いて検討し、帯状回、島などの痛覚認知に特有な部位の血流が増加し、「心の痛み」が本当の痛みと類似の脳内反応をおこすことを明らかにした (Ogino et al., Cereb Cortex)。
対面コミュニケーションをはじめとする社会能力の基盤としての自己認知と自己評価の神経基盤を明らかにした (Morita et al., J Cogn Neurosci)。
(5) 四次元脳・生体分子統合イメージング法の開発
位相差電子顕微鏡により、エンドサイトーシスの膜陥入時に蛋白質ポリマーが紐状に膜に巻きつき絞り込む機構を直接画像として示すことに成功した (Shimada et al., Cell)。
質量顕微鏡(Imaging mass spectrometry)により組織の特定の脂質・蛋白分解物等の分布を定量的に画像化することが可能となった (Shimma et al., Anal Chem)。
(6) 遺伝子改変動物作製技術の開発
長期に保存した凍結乾燥精子を用いて卵細胞質内顕微注入による産仔作出に成功した (Hochi et al., Mol Reprod Dev)。
1分子生理研究系
1.1神経機能素子研究部門
神経機能素子研究部門では、イオンチャネル、受容体、G 蛋白質等の構造と機能に関する研究を展開している。具体的には、(1) 膜電位センサーを持たないATP受容体チャネルの膜電位とATP濃度に依存するゲート機構の解析、(2) 代謝型グルタミン酸受容体の動的構造変化とシグナリングの多様性、および、GABAB受容体との分子会合による機能修飾の解析、(3) KCNQ K+ チャネルの機能調節機構と構造機能連関、(4) 内耳外有毛細胞のモーター蛋白プレスチンの単粒子構造解析、および分子複合体の同定、(5) 細胞膜上に発現するカフェイン受容体の分子同定、(6) 小脳 lobule 10 において特異的に見られるシナプス電流の解析等を主たる研究目標とし、学際的アプローチにより研究を進めている。2007年に発表した論文のうち代表的なもの、Nakajo K & Kubo Y (2007) KCNE1 and KCNE3 stabilize and/or slow voltage sensing S4 segment of KCNQ1 channel. J Gen Physiol 130:269-281.の内容を以下に紹介する。
KCNQ1は電位依存性カリウムチャネルのαサブユニットをコードし、不整脈や難聴の原因遺伝子としても知られている。KCNQ1のユニークな性質として、共発現するβサブユニットKCNEの種類によって電流の性質が著しく変化することが挙げられる。心臓ではKCNE1(KCNQ1と同様に不整脈の原因遺伝子)と複合体を構成してIKsと呼ばれる活性化・不活性化が著しく遅い電流を担い、腸管ではKCNE3と複合体になって常時開状態のカリウムチャネルを構成する。本研究ではKCNQ1チャネルの電位センサードメインに注目し、KCNEサブユニットが電位センサーの動きに与える影響を調べた。脱分極時、すなわち電位センサーが“up state”にあるときのみ細胞膜外に露出する場所である226番目のアラニンにシステイン変異を導入し(A226C)、システイン残基を修飾するMTS試薬を細胞外より投与して、その修飾速度を指標にKCNQ1の電位センサードメインの動きを調べた。その結果、KCNE1存在下ではMTSによる修飾速度が約13倍遅くなることが明らかとなった。それに対してKCNE3とKCNQ1の複合体では修飾速度は膜電位に依存しなかった。以上の結果はKCNE1がKCNQ1の電位センサーを“down state”に、KCNE3が“up state”にそれぞれ安定化していることを示唆している。
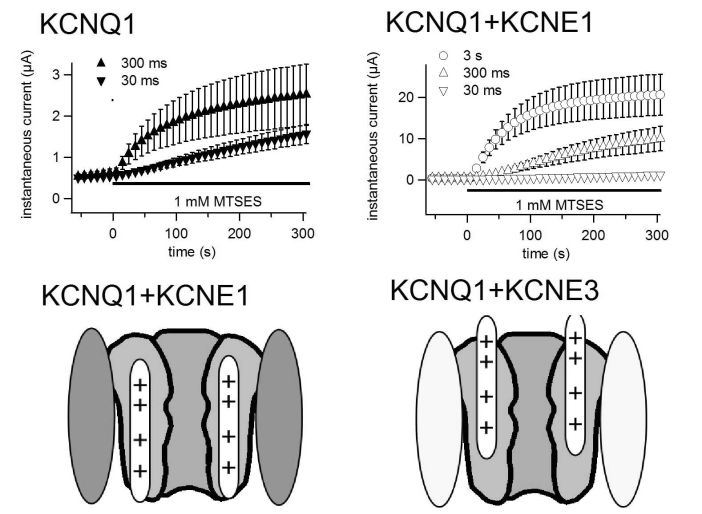
図の説明: (上)MTSES投与によるKCNQ1電流の修飾速度に対するKCNE1の作用。左がKCNQ1のみ、右がKCNQ1とKCNE1の複合体で、30
ms, 300 ms, 3 sの脱分極パルスを与えた際のMTSES投与による電流量増加のグラフ。同じ長さの脱分極パルスで比べた場合、KCNE1存在下では修飾速度が遅くなっている。
(下) KCNE1はKCNQ1の電位センサーを“down state”に、KCNE3は“up state”にそれぞれ安定化する。
1.2分子神経生理研究部門
哺乳類神経系の発生・分化、特に神経上皮細胞(神経幹細胞)から全く機能の異なる細胞種(神経細胞、アストロサイト、オリゴデンドロサイトなど)が分化してくる機構を研究している。近年、成人脳内にも神経幹細胞が存在し、神経細胞を再生する能力を有することが明らかとなった。この成人における神経幹細胞数の維持機構についても研究している。また、得られた新しい概念や技術は臨床研究への応用を視野に入れながら、病態の解析にも努力している。また糖蛋白質糖鎖の解析法を開発し、その生理学的意義について検討している。
1) 神経幹細胞の発生:哺乳類脳において神経幹細胞が発生してくる分子機構の解析を行っている。早期胚から培養下で神経幹細胞を誘導する実験系および種々のノックアウトマウスを用い、 gcm1/2遺伝子の役割を解析中である。 哺乳類脳において神経幹細胞が発生してくる分子機構の解析を行っている。早期胚から培養下で未分化神経幹細胞を単離し、神経幹細胞へと誘導する実験系を開発したので、この系を用いて未分化神経幹細胞から神経幹細胞への分化過程で働いている遺伝子を探索した。その結果、 glial cells missing (gcm)遺伝子がこの段階に重要な役割を担っている可能性が示唆された。 Gcm1および gcm2のノックアウトマウスを用い、 gcm1/2遺伝子の役割をさらに解析中である。
2)中枢神経系の細胞分化:発達期脳内の細胞分化を制御する転写因子Olig2を発現する細胞の分化特性を、タモキシフェン誘導型Cre-loxP系を用いて解析している。その結果、胎生期中期の前脳領域でOlig2を発現する細胞の一部はコリン作動性ニューロンに分化することを明らかにした。胎齢に依存してGABAergicニューロン、ついでアストロサイトに分化することも見い出しており、さらに解析を続けている。
3)神経回路網形成の制御機構:脊髄背側部に由来するニューロン前駆細胞が、腹側方向に移動する際にnetrin1が誘因性に作用することを明らかにした。軸索伸長と細胞移動とが同時に制御されている可能性が示唆された。
4)成体脳における神経幹細胞の維持機構:慢性ストレスや向精神薬投与下での神経幹細胞の維持機構を解析することにより、成体脳における神経幹細胞の存在意義を調べている。Nestin promoter/enhancer-CreERやテトラサイクリンシステムを用いたトランスジェニックマウスを作製し、神経幹細胞の動態や動物の行動変化の解析を行っている。
5)脱髄機構の解析:多発性硬化症(MS)などの脱髄性疾患においては髄鞘の再生不良が大きな問題である。当研究室で作製した plp過剰発現マウスは、非常に良いMSモデルマウスである。このマウスの病態解析により、ミクログリアが髄鞘成分をどん食するとシスタチンFを発現するようになること、また髄鞘の再生が抑制される時にはその発現のなくなることが観察された。以上のことから、活性化ミクログリアは髄鞘再生時に特徴的な遺伝子発現を行っていることが明らかとなった。
6)アストロサイトの機能解析:アストロサイト原発的に発症する病気としてアレキサンダー病が知られている。昨年度作製したモデルマウスを詳細に解析したところ、脳血管関門などは保たれているが、カイニン酸投与により誘発される痙攣の閾値が低くなっていることが明らかとなった。しかし、他の主な神経症状は観察されなかった。
7)脳内の糖鎖解析:平成18年度までに糖蛋白質糖鎖の蛍光標識法および精製法の改良により、脳内糖鎖のシアル酸情報まで簡易に解析する方法を確立した。本年度は脳内でα2-6結合しているシアル酸含有糖鎖構造を解析した。この構造は脳内ではほとんどがGlcNAcの6位に結合している分岐型の構造をしていた。現在この構造の生合成過程および生理的意義を検討中である。
1.3細胞内代謝研究部門
細胞内代謝研究部門(客員部門)では、主として機械刺激受容時や受精時における細胞内シグナリング機構、あるいは細胞のプロトンシグナリングを電気生理学とライブイメージング法を用いて調べています。また機械受容と神経機能を関連づけるシーズ研究として神経ステロイドとシナプス可塑性の研究を行っています。
細胞における機械刺激受容機構の研究
主要課題の一つは、細胞メカノセンサーの代表格である機械受容(MS)チャネルのゲーティング機構の解析です。今年度は細菌のMSチャネルであるMscSのゲーティングにおける膜貫通ドメインと細胞質ドメインの相互作用について解析しました。MscSの開口にはこれら両ドメインの構造変化が必要なことが示唆されていましたが、詳細は不明でした。今回の我々の研究で、両ドメイン間には反対極性の荷電性アミノ酸の静電的相互作用があり、膜張力による細胞ドメインの拡張に続いてこの静電相互作用を介した細胞質ドメインの拡張が生じて、最後に膜貫通ドメインのポアが開口することが示唆されました(Nomura et al, Biophys J, in press)。現在FRET法を用いて、細胞質ドメインがチャネル開口に伴って本当に拡張するのか、またどの程度拡張するのかを解析中です(曽我部)。
接着性細胞は細胞内外の力学環境(細胞が発生する収縮力や基質の硬さなど)に応じて細胞骨格や接着構造を変えて最終的に形態の変化を惹起します。しかしこのときの力学環境の感知機構は不明で、最終応答に至るシグナル機構は謎のままです。我々は、力学的負荷により、接着斑でのアクチンの重合が活性化することを発見しました(Hirata et al, 投稿中)。また、このアクチン重合の活性化には、接着斑タンパク質zyxinの力学的負荷に応答しての接着斑へのリクルートが関わっていることを明らかにしました。現在、zyxinと他の接着斑タンパク質との相互作用を解析しながら、形態変化時おけるメカノシグナリング機構を明らかにしようとしています(平田)。
ウニ卵受精時のNOの増加と受精膜硬化
ウニ受精時には一酸化窒素(NO)増加が見られます。最初は卵活性化シグナルとして注目されましたが、その後否定されて、その役割についは不明でした。卵活性化時の内外イオンの動態とNO増加の関係を調べるために卵活性電流と蛍光色素によるNO増加の同時測定を行いました。その結果NOの増加は細胞内カルシウム増加のピークの直後から増加することがわかりました。 新たなNO増加の役割を調べるためにNO吸収剤(PTIO)を用いてNO増加を阻害した時の酸素消費や代謝の重要な補酵素であるNAD(P)H (NADHおよびNADPH)の変化を測定しました。NO増加の阻害によりNAD(P)Hの増加が抑制されることまた受精膜を硬化させるための過酸化水素の産生も抑制されることおよび硬化そのものも抑制されることを発見しました。結論としてNO増加の役割はNAD(P)Hの増加および受精膜の硬化の促進という事実を見つけました。現在この研究について論文を投稿中です。(毛利)
プロトンシグナリング機構の研究
プロトンは重要なシグナルイオンとして多様な機構によって制御されていますが、組織障害はしばしばpHバランスの異常を伴います。臨床的に良く知られた乳酸アシドーシスに対して神経組織の免疫に関わるマイクログリアがどのように応答するかを、電位依存性プロトンチャネルの持つ内在性pHメータとしての特性を利用して調べました。初期の細胞内アシドーシスに加え、乳酸への持続暴露による細胞容積・膜電位の変化やリン酸化酵素の作用を介してプロトンチャネルが強く活性化されることが明らかになり(Morihata et al, in press)、同時にこのチャネルが細胞pH環境をモニターする上で有効であることも実証されました(久野)。
神経ステロイドによるシナプス可塑性の誘導とメタ可塑性
近年種々のステロイドホルモンが中枢で合成され、様々な機能を発揮することが分ってきました。特に学習記憶行動の促進やアミロイド・脳虚血による神経障害の保護作用が注目を集めていますが、その分子・シナプス機構は不明です。我々は、海馬スライス標本に膜電位イメージングを適用して、代表的神経ステロイドであるエストロゲンやDHEAS, PREGSなどの作用機序を調べています。本年度はPREGSの急性投与による海馬歯状回のLTP誘導を解析しました。その結果PREGSによるLTPは、早期に立ち上がるシナプス前膜由来のSTPと緩慢に立ち上がるシナプス後細胞(顆粒細胞)由来のLTPという独立した2成分からなることが分かりました。このLTPは、Src依存的なNR2B (NMDA受容体のサブユニット)のチロシン燐酸化の促進に基づく増強された細胞内Ca2+流入と、引き続くERK/CREBシグナル系の活性化で導かれることが分かりました(Chen et al, J Neurophysiol, 2007)。またこの状態では活動依存性LTPの誘導が促進され、通常では閾値下の低周波数刺激でLTPが誘導されるとともに、20 - 30 Hzの条件刺激で最大のLTPが誘導されるという帯域特性が現れました。現在このメタ可塑性のシナプス・分子機構を解析しています(曽我部)。