細胞器官研究系
生体膜研究部門
【概要】
脳の主要な興奮性シナプス伝達を司るAMPA型グルタミン酸受容体の動態や機能を制御する機構を以下の2点に着目して解明し,シナプス可塑性およびてんかんなどの脳神経疾患発症のメカニズムの理解を目指す。
(1) シナプス膜蛋白質複合体の同定と機能解析
シナプス膜蛋白質(受容体,イオンチャネル,接着分子など)は足場蛋白質,シグナル蛋白質などと複合体を形成して,その機能を遂行することから,独自に開発した特異性の高い生化学的手法により,脳組織からシナプス蛋白質複合体の精製・同定をおこなう。同定したシナプス蛋白質複合体がシナプス伝達効率を制御する機構を分子細胞生理学的,生化学的,遺伝学的手法を用いて統合的に明らかにする。
(2) パルミトイル化脂質修飾機構の全容解明
翻訳後脂質修飾であるパルミトイル化は,外界刺激に応答してシナプス蛋白質のシナプス膜局在を制御し,シナプス伝達効率や細胞内情報伝達を調節する。我々は独自に発見したパルミトイル化酵素群をツールにシナプス活動に応答したAMPA受容体の動態制御機構およびアゴニスト依存的な3量体G蛋白質・サブユニットの局在制御機構を明らかにする。以下に今年度行った研究課題とその内容の要約を記す。
てんかん関連リガンドLGI1の生理機能の解明
深田優子,横井紀彦,岩永 剛,深田正紀
最近,私どもはシナプス足場蛋白質PSD-95複合体として痙攣・てんかんと関連のあるAMPA受容体附属サブユニットStargazin,膜蛋白質ADAM22,および分泌蛋白質LGI1の3つを同定した。これまでに,私どもはLGI1がADAM22のリガンドとして機能し,AMPA受容体機能を促進することを報告した。今年度はLGI1ノックアウトマウスの作製に成功し,1) 生後2週間後より激しいけいれん発作を示し3週間以内に致死となること,2) AMPA受容体を介したシナプス伝達がLGI1のノックアウトマウスで低下すること,および3) ADAM22とともにADAM23が脳内のLGI1受容体として機能することを報告した。現在,LGIファミリー(LGI2, -3, -4)およびADAM22ファミリー(ADAM22, -23, -11)同士の結合特異性,および機能相補性を明らかにし,新たなシナプス伝達制御機構およびてんかん発症の分子基盤の解明に取り組んでいる。
PSD-95パルミトイル化酵素によるシナプス機能制御
則竹 淳,深田優子,岩永 剛,深田正紀
パルミトイル化脂質修飾は多くの機能蛋白質(シグナル蛋白質や足場蛋白質,膜蛋白質など)にみられる翻訳後脂質修飾で,蛋白質の細胞内局在や機能をダイナミックに制御している。私どもはAMPA型グルタミン酸受容体のシナプスでの機能発現に必須な足場タンパク質,PSD-95のパルミトイル化酵素P-PAT(DHHC2, 3, 7, 15) の活性が神経活動により制御されているか,また,P-PATが何らかのシナプス可塑性を制御しているかを検討している。今年度はP-PATサブファミリーのうちDHHC2がポストシナプスおよび樹状突起に局在し,その局在が神経活動抑制時にポストシナプス膜近傍に移動し,PSD-95のパルミトイル化を促進することを見出した。さらに,このDHHC2による神経活動依存的なPSD-95のパルミトイル化が,神経活動抑制時に誘導されるAMPA受容体のポストシナプスへの集積(AMAP受容体恒常性維持)に必須であることを明らかにした。現在,DHHC2の動態制御メカニズムの解析をおこなっている。
Gaパルミトイル化酵素の同定と性状解析
堤 良平,深田優子,深田正紀
G蛋白質aサブユニット(Ga)は分子スイッチとして細胞内情報伝達の中心分子として機能する。Gaは古くからパルミトイル化を受けることが知られており,パルミトイル化が細胞膜への集積や機能の遂行に重要であることが示唆されてきた。私どもはGaパルミトイル化酵素としてDHHC3およびDHHC7を同定し,アゴニスト依存的なa1Aアドレナリン受容体・Gaqを介した情報伝達系にDHHC3およびDHHC7が必須であることを見出した。さらに,パルミトイル化Gaqの細胞内動態をphotoconversion法やFRAP法を利用し解析をおこなった結果,Gaqが常に細胞膜に静的に局在するのではなく,パルミトイル化依存的にゴルジ−細胞膜間を双方向性に輸送されることを報告した。また,他の基質蛋白質のパルミトイル化酵素の同定といった海外研究者との共同研究も引き続きおこなっている。
分泌蛋白質BDNF,およびLGI1の分泌機構の解明
松田尚人,深田優子,則竹 淳,深田正紀
Mu-ming Poo(カリフォルニア大学バークレー校 分子細胞生物学部)
BDNFは脳の発達や神経活動依存的なシナプス可塑性に必須な分泌タンパク質として知られている。しかし,その分泌機構は,ほとんど明らかになっていない。今年度,私どもは全反射顕微鏡を用いたイメージングにより,樹状突起から分泌されたBDNFの拡散してゆく瞬間を可視化することに成功した。興味深いことに,軸索,樹状突起からの分泌過程は神経活動により,それぞれ異なる様式で制御されていることが明らかとなった。今後は同様の手法を用いて,てんかん関連分泌蛋白質LGI1の分泌制御機構の解明にも取り組んでいく。
神経細胞におけるパルミトイル化酵素ファミリーの制御機構の解明
奧慎一郎,則竹 淳,深田優子,深田正紀
パルミトイル化修飾は外界刺激依存的に可逆的に代謝回転し,生体の恒常性や可塑性を精密に制御していると考えられている。最近,私どもはパルミトイル化脂質修飾酵素(23種類)をゲノムワイドに同定し,次々と新しい酵素-基質ペアを明らかにしている。しかし,パルミトイル化酵素群の活性制御メカニズムに関しては未だ殆ど不明である。最近,私どもは23種類の酵素群がいくつかのサブファミリーに分類されることを見出し,サブファミリー毎に異なる局在,制御を受けることを見出しつつある。そこで,DHHC蛋白質サブファミリー特異的な輸送・局在化メカニズムの解明を試みている。今年度は神経細胞に発現がみられるDHHCサブファミリー特異的な結合蛋白質を網羅的に生化学的に精製,同定をおこなった。今後,これら結合蛋白質の性状解析を通じて新規パルミトイル化酵素群のサブファミリー特異的な制御機構を明らかにする。
機能協関研究部門
【概要】
私達は容積調節や環境情報受容,網膜光受容など最も一般的で基本的な細胞活動のメカニズムを,膜機能分子の働きとして細胞生理学的に解明し,それらの異常と疾病や細胞死との関係についても明らかにしようとしている。主たる研究課題は次の通りである。
(1)「細胞容積調節の分子メカニズムとその生理学的役割」:細胞は(異常浸透圧環境下においても)その容積を正常に維持する能力を持つ。これに関与する容積調節性膜機能分子,特に容積感受性外向整流性クロライドチャネル(VSOR)やそのシグナルの分子同定を行い,その活性メカニズムと生理学的役割を解明する。
(2)「アポトーシス,ネクローシス及び虚血性細胞死の誘導メカニズム」:容積調節能の破綻は持続性の容積変化をもたらして細胞死を誘導する。多くの細胞のアポトーシス,ネクローシス,更には脳神経細胞や心筋細胞の虚血性細胞死の分子メカニズム,特にイオンチャネルの関与とそのメカニズムを明らかにする。
(3)「バイオ分子センサーチャネルの分子メカニズムの解明」:特に,アニオンチャネルやATP放出チャネルやTRPカチオンチャネルの容積センサー機能,メカノセンサー機能およびストレスセンサー機能の分子メカニズムを解明する。
(4)「網膜における視覚情報処理のメカニズム解明」:特に網膜神経節細胞での視覚情報の統合処理について,網膜組織培養法を活用したバイオ分子センサーの遺伝子操作および電気生理学的手法を用いて明らかとする。
マキシアニオンチャネルの活性化へのチロシン脱リン酸化の関与
TOYCHIEV Abduqodir H,SABIROV Ravshan Z,LIU Hongtao,岡田泰伸
新谷隆史,野田昌晴(基礎生物学研究所)
高橋信之(京都大学)
赤塚結子(鈴鹿医療科学大学)
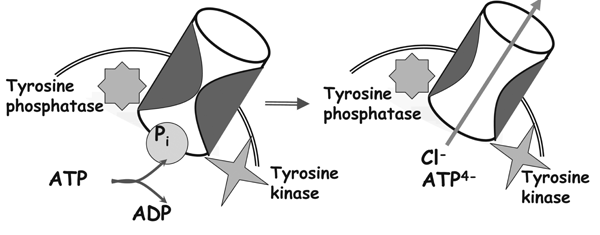
容積センサーの1つであるマキシアニオンチャネルは多くの細胞種に発現し,虚血や細胞膨張などの条件下で活性化し,細胞間シグナルATPの細胞外放出に関与するなど,生理学的に重要な役割を果たしていることを明らかにした。しかしながらこのチャネル分子の本体も未だ不明であり,その活性化メカニズムも不明であった。今回,成熟マウス線維芽細胞(MAF)やマウス乳腺線維芽細胞(C127株)において,その活性化メカニズムにチロシン脱リン酸化が関与していることを明らかにした。また,MAFの場合には,レセプター型チロシン脱リン酸化酵素の1つであるRPTPzが関与することが示唆された。本成果の一部は,機構内連携研究バイオ分子センサープロジェクトのもとでの共同研究により得られた。これらの結果は次の論文に報告:Am J Physiol Cell Physiol 297: C990-C1000, 2009; J Physiol Sci 59: 3-21, 2009。
|
|
図1 チロシン脱リン酸化−チロシンリン酸化によるマキシアニオンチャネルの開閉制御 |
容積感受性外向整流性アニオンチャネル(VSOR)を介する
炎症時のグリアからニューロンへの情報伝達メカニズム
LIU Hongtao,秋田天平,清水貴浩,SABIROV Ravshan Z,岡田泰伸
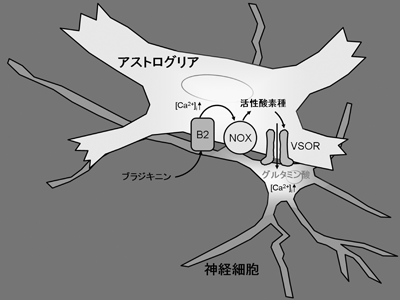
炎症時初期に生成されるブラジキニンが,脳内の主要なグリア細胞であるアストロサイトに作用すると,そこからグルタミン酸放出が誘起され,それが隣接するニューロン上のNMDA受容体を活性化してそのニューロン内にCa2+濃度上昇を引き起こすことを通じて情報伝達に寄与する。最近私達は,マウス大脳皮質由来のグリア・ニューロンにおいて,そのブラジキニンにより誘起されるグルタミン酸放出がアストロサイト上の容積感受性外向整流性アニオンチャネル(VSOR)を通じて行われることを明らかにした。また,このVSOR開口はブラジキニンの作用によりアストロサイト内に生成されたROSが細胞容積変化によらず直接VSORに作用することにより誘導されることが示唆された。この結果は次の論文と総説に報告:J Physiol 587: 2197-2209, 2009; J Physiol 587: 2141-2149, 2009。
|
|
図2 ブラジキニンがアストロサイト上のB2受容体に結合すると,NADPH oxidase(NOX)の活性化を通じてROSが産生される。そのROSによりVSORが開口してグルタミン酸が放出され,ニューロン内にCa2+濃度上昇が起こる。 |
細胞生理研究部門
【概要】
細胞は,それを取り巻く環境の大きな変化の中で,その環境情報を他のシグナルに変換し,細胞質・核や周囲の細胞に伝達することによって環境変化にダイナミックに対応しながら生存応答を行っている。細胞が存在する臓器・組織によって細胞が受け取る環境情報は異なり,従って細胞が持っている環境情報を受信する機能も異なる。それらセンサー蛋白質は環境の変化に応じてダイナミックに感受性や発現等を変化させてセンシング機構の変化からよりよい生存応答を導く機能を有している。これらのセルセンサー蛋白質は種々の化学的,物理的情報を受容し,センサー間の相互作用を行い,多くは最終的に核への情報統合を行う。そして,それは細胞の,組織の,さらには個体の環境適応をもたらす。したがって,これらの細胞環境情報センサーの分子システム連関を解明していくことは,個体適応の理解のための基本単位である「細胞の生存応答」を解明するうえで極めて重要である。この細胞外環境情報を感知するイオンチャネル型のセンサー蛋白質の構造機能解析,活性化制御機構の解析を通して細胞感覚の分子メカニズムの解明を目指している。特に,侵害刺激,温度刺激,機械刺激の受容機構についてTRPチャネルに焦点をあてて解析を進めている。
また,本能機能を司る視床下部ペプチド作動性神経に注目し,摂食行動や睡眠覚醒を制御する神経機構について明らかにする研究を行っている。
膀胱の機械伸展刺激感知に関与するTRPV4
望月 勉,曽我部隆彰,富永真琴
温度感受性TRPチャネルファミリーに属するTRPV4は温かい温度で活性化してCa2+やNa+の流入をもたらす。膀胱移行上皮でのTRPV4の発現を抗TRPV4抗体を用いて検討したところ,野生化型マウスの膀胱上皮でのTRPV4蛋白質の発現が確認され,TRPV4欠損マウスでは発現がなかった。TRPV4の野生型膀胱移行上皮での機能的発現は刺激物質である4a-PDDに対する応答によっても確認された。野生型マウスとTRPV4欠損マウスから調整された膀胱上皮細胞をシリコンチャンバーで培養して機械伸展刺激を加えたところ,野生型マウスから得られた細胞でのみ細胞内Ca2+濃度の上昇が観察された。また,ルシフェリン・ルシフェラーゼ反応を用いて膀胱上皮細胞からのATPの放出を検討したところ,野生型マウスから得られた細胞で機械伸展刺激に対して有意に大きなATPの放出が観察された。これらの実験事実は,膀胱が尿貯留による拡張に対してTRPV4を活性化させてATPを放出することを示しており,ATPによってその伸展情報が感覚神経に伝達される可能性を示唆している。そして,放出されたATPの受容体候補であるP2X3受容体欠損マウスで膀胱機能異常が認められるとする報告と合致する。体温下での膀胱伸展をTRPV4が感知して,その情報をATPを介して感覚神経に伝達するという新しい感覚メカニズムを示したと言える。
皮膚ケラチノサイトでのTRPV3による温度感知メカニズム
Mandadi Sravan,曽我部隆彰,柴崎貢志,富永真琴
温度感受性TRPチャネルファミリーに属するTRPV3, TRPV4は表皮に強く発現し,温かい温度で活性化される。この事実は,皮膚が最初の温度感知組織である可能性を示唆する。そこで,マウス表皮ケラチノサイトと感覚神経細胞の共培養系を確立して,ケラチノサイトに温度刺激を加えてケラチノサイトと感覚神経細胞での細胞内Ca2+濃度変化を検討した。温度刺激に対してケラチノサイト,感覚神経細胞の両方で細胞内Ca2+濃度が上昇したが,感覚神経細胞での細胞内Ca2+濃度上昇が約1.2秒遅延した。これは,ケラチノサイトから感覚神経細胞へ情報が伝達された可能性を示唆する。そこで,2種類のATP受容体阻害剤を用いたところ,感覚神経細胞でのみ温度刺激に対する細胞内Ca2+濃度上昇が消失した。これは,ATPによってケラチノサイトから感覚神経細胞に情報が伝達されたことを示す。そこで,HEK293細胞にイオンチャネル型ATP受容体P2X2を強制発現させたバイオセンサーを用いてケラチノサイトからのATP放出の検出を試みた。バイオセンサーHEK293細胞をケラチノサイトに近づけてから,ケラチノサイトに温度刺激を行ったところ,温度刺激に応じて内向き整流性というP2X2チャネルに特徴的な電圧電流関係を示す電流の活性化が観察された。野生型マウス,TRPV3欠損マウス,TRPV4欠損マウスから調整したケラチノサイトを用いて実験したところ,TRPV3欠損ケラチノサイトを用いたときにP2X2チャネル電流が有意に小さかったことから,温度刺激に応じて主にTRPV3チャネルの活性化によってケラチノサイトからATPが放出されているものと考えられた。そして,このATPがケラチノサイトで感知された温度情報を感覚神経に伝達しているものと推定した。
DIP/WISH欠損マウスの解析
福見-富永知子,松浦敦子,兼子佳子,松井 誠,富永真琴
DIP/WISHを低分子量G蛋白質Rhoの標的蛋白質のDiaとWASPと結合する蛋白質として見出し,Rho, Racの活性制御することによって細胞運動を調節する重要なタンク質であることを明らかにしてきた。そこで,そのメカニズムを検証するためにDIP/WISHを欠損するマウスを作製してその胎仔線維芽細胞を解析した。野生型線維芽細胞はPDGF等の刺激に応じてよく動いたが,DIP/WISH欠損線維芽細胞は,細長い形状をしており,刺激前からRhoの活性が高くて細胞の接着性が悪く,細胞尾の退縮不全によると思われる著しい細胞運動能の低下を示した。DIP/WISH欠損細胞ではRhoの活性化に一致してアクチン線維束の発達が観察された。以上の結果から,DIP/WISHはRhoの陰性制御分子として機能し,細胞接着に関与する分子群を制御することによって細胞接着能をコントロールしていると結論した。
オレキシン神経はオレキシンによって直接活性化される
山中章弘,常松友美
オレキシンは視床下部の少数の神経(オレキシン神経)において産生される神経ペプチドであり,オレキシン神経は,脳のほとんどの領域に軸索を投射している。オレキシン遺伝子欠損マウスの解析から,オレキシンが睡眠覚醒調節に重要な役割を担っていることが明らかになってきた。すなわち,オレキシン神経への入出力系を明らかにすることによって,未だによく分かっていない睡眠覚醒調節に関わる神経回路網の解明が期待された。そこで,オレキシン神経特異的に緑色蛍光タンパク質を発現する遺伝子改変マウスを作成し,スライスパッチクランプによって,入力する神経とその神経伝達物質に対する応答について解析を行った。オレキシンがオレキシン神経を強く活性化することを見いだした。この反応はオレキシンAでもBでも同程度であったことからオレキシン2受容体を介した反応が示唆され,受容体欠損マウスを用いた解析によって2受容体を介することを確認した。さらに電子顕微鏡をもちいた観察から,オレキシン神経同士が直接入力していることを確認した。この神経回路はポジティブフィードバック回路を形成し,オレキシン神経活動を長時間高い状態に保つのに重要であり,この機構によって覚醒を維持できるものと考えられた。
光活性化タンパク質を用いたオレキシン神経活動の光制御による行動制御
常松友美,山中章弘
近年,光によって神経活動の制御を可能にする分子であるチャネルロドプシン2(ChR2)やハロロドプシン(Halo)が報告された。摂食行動や睡眠覚醒などの本能機能は,個体でのみ生じる生理現象のため,それらを調節する神経機構の解明には,個体を用いた解析が欠かせない。そこで,睡眠覚醒調節に重要な視床下部のオレキシン神経特異的に光活性化タンパク質を発現させた遺伝子改変マウスを作成し,インビボにおいてその活動の制御を行い,その結果表出する行動を解析することによって,睡眠覚醒を調節する神経機構の解明を試みている。オレキシン神経特異的ChR2やHaloを発現する遺伝子改変マウスを作成しており,組織化学的手法を用いて特異的発現を確認している。また,スライスパッチクランプなどのインビトロ解析によって,オレキシン神経活動が光で制御できることを確認した。このマウスを用いて意識下行動中のマウスのオレキシン神経活動を任意のタイミングで制御すると,個体の睡眠覚醒を制御出来ることが分かった。光活性化タンパク質を用いた特定神経制御は,睡眠覚醒調節に関わる神経機構の個体を用いた解析に大変強力なツールとなることを証明した。