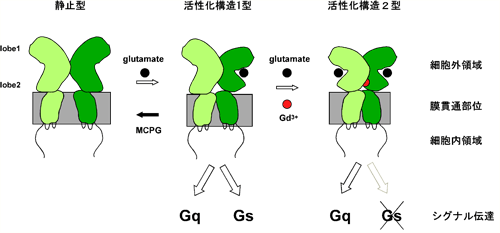
代謝型グルタミン酸受容体は神経の可塑性に関わる膜機能蛋白質であり、複数のG蛋白質(Gq、Gs、Gi)と共役して様々な細胞応答をもたらす。G蛋白質共役型の受容体ではあるが、ホモ2量体を形成すること、および、大きな細胞外領域にリガンド結合部位を有することを特徴としている。また、グルタミン酸のみならず、Ca2+やGd3+ などの多価陽イオンによっても活性化される。特に、Gd3+の結合部位は受容体の二量体境界面にあり、グルタミン酸とは異なる。また、グルタミン酸とGd3+による活性化構造が異なることを示す構造データが報告されている。本研究において、我々は、リガンドのタイプが異なると活性化されるシグナル伝達経路に差異が生ずること、すなわち、グルタミン酸は Gq および Gs 経路を活性化するのに対して、Gd3+はGq経路のみを活性化するということを見いだした(図1)。この実験結果は、代謝型グルタミン酸受容体が、単なるon- / off- スイッチではなく、刺激の種類によって出力の種類を切り換える、マルチパスレギュレーターとして機能しうるということを示唆する。
Tateyama, M. and Kubo, Y. Dual signaling is differentially activated by different active states of the metabotropic glutamate receptor1alpha. Proc. Natl. Acad. Sci. U.S.A. 103, 1124-1128 (2006)