神経細胞が興奮すると脳内の代表的な蛋白質リン酸化酵素であるCa2+⁄カルモジュリン依存性プロテインキナーゼII(CaMKII)の活性化が起こるが、 過剰興奮状態であるけいれん中には逆に不活性化が起こることが知られている。そのメカニズムを調べるため、ラットのカイニン酸けいれんモデルを用いて、 脳内CaMKIIの活性状態を生化学的に検討した。けいれん中には、脳ホモジネート中のCaMKII活性が低下するのみならず、 可溶性画分から沈降画分へとCaMKIIが部分的に移行することがわかった。この沈降画分におけるCaMKIIは活性が大きく低下すると同時に、 Thr-286 (α) ⁄ Thr-287 (β)の自己リン酸化が大きく上昇していた。 一方、可溶性画分においては、このような活性と自己リン酸化の乖離は認められなかった。けいれんから回復後の脳サンプルでは、 このような変化は完全に消失していた。通常の神経活動状態では、Thr-286 (α) ⁄ Thr-287 (β)の自己リン酸化はCaMKIIの活性化と一致するのと対照的に、 細胞内への過剰なCa2+流入を伴う病的状態においては、通常とは異なる活性制御機構が働くことを示唆している。 このような自己リン酸化・不活性化・沈降型のCaMKIIの形成は、神経細胞がCa2+過剰負荷によってCaMKIIの過剰活性化、 基質蛋白の過剰リン酸化を起こすのを防ぐ生体防御機能としての役割を果たしているのではないかと考えられる。
Yamagata, Y., Imoto, K. and Obata, K. A mechanism for the inactivation of Ca2+⁄calmodulin-dependent protein kinase II during prolonged seizure activity and its consequence after the recovery from seizure activity in rats in vivo. Neuroscience 140: 981-992, 2006.
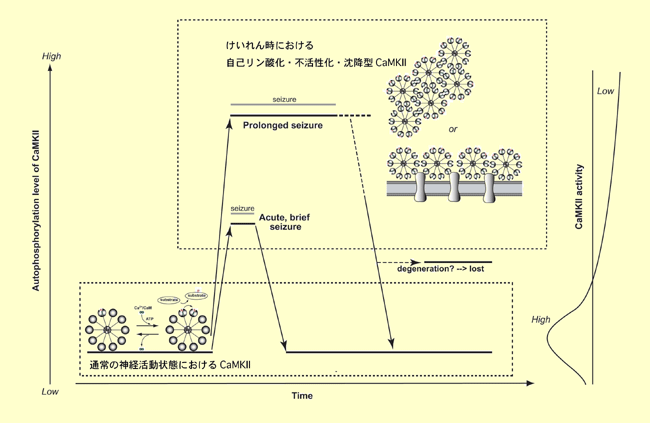
[図の説明] 生体内における神経過剰興奮時のCaMKIIの活性制御機構。
通常の神経活動状態では(図左下)、神経細胞の興奮に伴う細胞内へのCa2+の流入によって、活性化されたカルモジュリン(Ca2+⁄カルモジュリン)がCaMKIIに結合し、CaMKIIの自己リン酸化=活性化が起こり、基質蛋白のリン酸化が進む。一方、神経細胞の過剰興奮状態であるけいれん中には(図右上)、急激に大量のCa2+が細胞内に流入し、大量のCa2+⁄カルモジュリンがCaMKIIに結合することによって、通常とは異なる活性制御機構が働き、自己リン酸化・不活性化・沈降型のCaMKIIが形成され、むしろ基質蛋白のリン酸化が進まなくなる。このような活性制御機構は、病的状態において、過剰なCa2+流入に伴うCaMKIIの過剰活性化を防ぎ、神経細胞をより正常な状態に保つ上で重要な役割を果たしているのではないかと考えられる。