Ci-VSPは、脊椎動物の祖先と関連が深い尾索動物ホヤのゲノムから見つかった、イオンチャネルと同様な電位センサー構造と、イノシトールリン脂質を脱リン酸化する酵素を持ち、膜電位に依存して酵素活性を変化させ、イオンの動きなしに電気信号を細胞内の化学信号に変換する、新しい機能を持つ分子である。この遺伝子はホヤからヒトに到る脊索動物に保存され、細胞増殖や細胞分化過程などでの膜電位変化によるシグナル伝達に関わる可能性がある。
いままでの研究では、CI-VSPが脱分極、過分極のどちらで活性化されるのかは不明であった。この問題を解決するために今回、以下の実験を行った。
イノシトールリン脂質を認識する蛍光プローブを、Ci-VSPとともにアフリカツメガエルの卵母細胞に強制発現させ、膜電位変化による細胞内のPIP2およびPIP3濃度の変化を測定し、PIP2およびPIP3が、脱分極により減少していることを確認した。また、Ci-VSPをPIP2感受性イオンチャネル(IRK1, KCNQ2⁄3)と共発現させ、電流量の変化をモニターすると、いずれのチャネルも、脱分極により、電流量が減少した。これらのことは、脱分極によりCi-VSPのホスファターゼが活性化され、PIP2濃度を減少させた結果と考えられた。以上の結果から、Ci-VSPは、脱分極により酵素活性が活性化される性質があることが示された。
■本研究は、イギリスJournal of Physiology誌を通じてPress Releaseされた。 http://www.blackwellpublishing.com/press/pressitem.asp?ref=1427
Murata Y and Okamura Y (2007) Depolarization activates the phosphoinositide phosphatase Ci-VSP, as detected in Xenopus oocytes coexpressing sensors of PIP2. Journal of Physiology 583: 875-889.
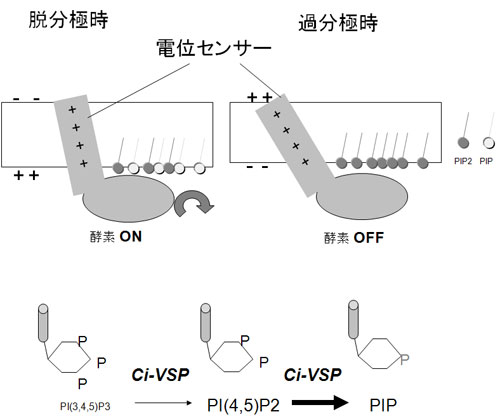
脱分極時に、電位センサーの構造変化がおこり、この情報が細胞内ドメインのホスファターゼに伝わり、脱リン酸化活性(PIP3からPIP2およびPIP2 からPIPへ)がONとなり、PIP3とPIP2の濃度が減少する(上図)。
VSPのホスファターゼは、おそらくこれまで知られてきたPIP3だけでなく PIP2に対しても基質として脱リン酸化を起こすと考えられる(下図)。