—サンゴの蛍光タンパク質とホヤの膜電位センサーを組み合わせて高感度膜電位感受性プローブ開発に成功—
独立行政法人理化学研究所(野依良治理事長)と自然科学研究機構・生理学研究所(岡田泰伸所長)は、サンゴ由来の蛍光タンパク質※1とホヤ由来の膜電位センサー※2とを組み合わせて、純タンパク質性の膜電位感受性蛍光プローブ※3の感度を著しく向上させ、神経細胞や筋肉細胞の興奮現象を可視化することに成功しました。今後、動物個体への適用を通して、脳神経系などにおける速い電気活動のパターンを高精細に観察する蛍光イメージング技術が達成されることが期待できます。理研脳科学総合研究センター(田中啓治センター長代行)細胞機能探索技術開発チームの宮脇敦史チームリーダーと筒井秀和研究員が、自然科学研究機構生理学研究所(岡田泰伸所長)生体情報研究系神経分化研究部門の岡村康司教授、および有限会社アマルガム(西田克彦社長)と共同で得た研究成果です。
研究チームは、ホヤの膜酵素タンパク質から取り出した膜電位センサーに、沖縄で採集したサンゴを材料に開発した2種類の蛍光タンパク質を組み入れて、蛍光性膜電位感受性プローブを開発しました。膜電位センサーも蛍光タンパク質も共に日本で行われた研究の成果で、開発したプローブを「Mermaid(マーメイド)」と命名しました。Mermaidを遺伝的に発現させることで、脳や心臓など、興奮性の細胞から構成される器官、組織における電気活動の光学画像を取得することができると期待されます。
本研究成果は、米国雑誌『Nature Methods』オンライン版(7月11日付け:日本時間7月12日)に掲載されました。
2005年に、自然科学研究機構生理学研究所生体情報研究系神経分化研究部門は、ホヤ(図1左)のゲノム情報を利用し、電位を感じて化学信号に変換することができる新奇タンパク質としてCi-VSP(Ciona voltage-sensor containing phosphatase)を発見しました(図2)。Ci-VSPは、電位センサー領域(膜貫通領域)とホスファターゼ※4領域を併せ持つ膜貫通型の酵素タンパク質です。細胞の膜電位が変わり電位センサー領域に構造変化が誘発される結果、酵素(ホスファターゼ)活性が変わると考えられています。Ci-VSPの発見は、従来はイオンチャネルに組み込まれイオンの透過に特異的にかかわると考えられてきた電位センサーが、独立した機能ユニットとして働き、幅広い生理現象にかかわる可能性を初めて示すこととなりました。
神経細胞においては、活動電位と呼ばれる動的な膜電位変化が起こります。そのため、神経回路の中を駆け巡る活動電位の時空間パターンを可視化するための実用的な光プローブが求められてきました。蛍光性膜電位プローブは、細胞の電気的活動を光学的(蛍光)信号として検出する分子です。
理研脳科学総合研究センター細胞機能探索技術開発チームと自然科学研究機構生理学研究所生体情報研究系神経分化研究部門の研究チームは、2005年以降、Ci-VSPの電位センサー領域を利用して蛍光性膜電位プローブを開発することを企ててきました。開発目標としたプローブは、膜電位依存的なタンパク質の微妙な構造変化を蛍光信号の変化に効率よく変換するシステムを試みてきました。具体的には、Ci-VSPの電位センサー領域に、たとえばオワンクラゲに由来する2種類の蛍光タンパク質(CFP※5とYFP※6)を融合し、純タンパク質性の膜電位感受性蛍光プローブを作製してきました。CFPの発光スペクトルとYFPの吸収スペクトルの間には重なりがあるため、CFPとYFPとの相対的空間配置に依存してCFPの励起エネルギーがYFPへ移動する現象(蛍光共鳴エネルギー移動※7)で発光させます。研究チームは、蛍光共鳴エネルギー移動に基づくさまざまなプローブ遺伝子を構築し、アフリカツメガエルの卵母細胞発現システム※8に導入し、それらの性能を解析しました。同様のアプローチによる蛍光性膜電位プローブの開発は、ほかの研究チームでも精力的になされてきましたが、いずれのプローブも感度が低いことが欠点として指摘されていました。
サンゴやイソギンチャクの仲間には蛍光タンパク質を産生するものがあります。蛍光タンパク質は、サンゴ礁の色彩を豊かにするのに貢献しています。理研脳科学総合研究センター細胞機能探索技術開発チームは有限会社アマルガムと共同で、これら海洋動物から蛍光タンパク質の遺伝子を取り出し、さまざまな応用技術を開発してきました。2002年に沖縄の海で採集した石サンゴの中に、ウミキノコとクサビライシがありました(図1、それぞれ中央、右)。それらを材料に、それぞれmUKGとmKOκという単量体の蛍光タンパク質を開発しました。mUKGは緑色の、mKOκはオレンジ色の蛍光を発します。mUKGの発光スペクトルとmKOκの吸収スペクトルの間に重なりがあるため、CFP⁄YFPと同様にmUKG⁄mKOκもまた蛍光共鳴エネルギー移動を検出するペアとして活用できます。mUKGとmKOκをCi-VSPの電位センサー領域に融合したコンストラクト(図3)を数多く作製して、膜電位変化に対する反応を調べてみました。それらの中から著しい反応を示すものが見つかり、「Mermaid(マーメイド)」と命名しました。Mermaidは、ほかの純タンパク質性の蛍光性膜電位センサーと比べて数倍から10倍の感度を示します。培養細胞に発現させて膜電位変化に伴う蛍光信号を解析したところ、神経細胞で起こる活動電位に相当する変化をリアルタイムに捉えることができました(図4)。さらに、蛍光画像を高速に取得することができる顕微鏡システムを構築して、Mermaidを発現する大脳皮質神経細胞や心筋細胞の電気活動の広がりを直接的に可視化することに成功しました(図5)。
今後、さまざまな動物種を使ってMermaidを興奮性の細胞種※9に発現する形質転換個体が作製されることが期待されます。
脳の神経細胞での発現が実現できると、脳の情報処理の研究に役立つツールとして活躍します。動物にとって、視覚・聴覚・触覚・嗅覚などの感覚情報はパターン情報です。脳の特定の部位で、電気的活動(神経細胞発火)の特徴的な時間的空間的パターンが生まれていると考えられています。動物は、そこから特徴を抽出して識別を行っています。最新コンピュータも苦心するような“パターン認識”をいとも簡単にやってのけます。脳はものごとを意識する以前に、大量の情報を並列的に処理しているのです。さらに、学習や記憶も行うことができます。このため、電気的活動のパターンダイナミクスを解析することは、脳の情報処理獲得の制御を知る上で極めて重要です。
高感度の蛍光性膜電位プローブが、心臓の筋肉細胞での発現することができれば、心臓の電気生理の研究に役立つツールとして活躍します。ほかにも、非興奮性の細胞種※9でも発現することができれば、これまで明らかにされなかった生理的な膜電位変化を解析することができます。実際、Ci-VSPは非興奮性の細胞種にも発現が検出されており、そうした存在の意義に迫ることができます。
さらに、膜電位を指標とするようなドラッグ・スクリーニングに役立つことが期待されます。これらの開発の基になる今回の成果は純国産です。知的財産権などに関わる抵抗もなく、日本の創薬産業界に速やかに普及することが期待されます。
Hidekazu Tsutsui1, Satoshi Karasawa1, 2, Yasushi Okamura3 & Atsushi Miyawaki1

ウミキノコに、青い光をあてると、緑色の光(蛍光)を発した(写真中央)。
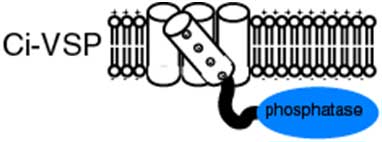
Ci-VSPの発見により、電位センサー(図で、4つの樽型の部分)が、独立した機能ユニットであることが明らかとなった。
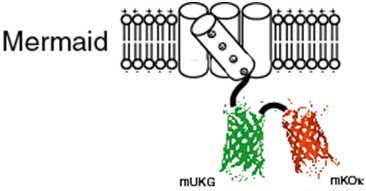
Ci-VSP、mUKG(ウミキノコ由来の蛍光蛋白質)、mKOκ (クサビライシ由来の蛍光蛋白質)を合体させて開発された。
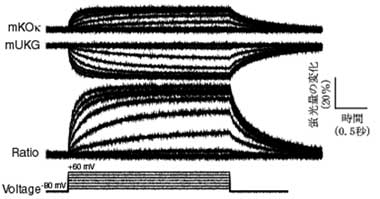
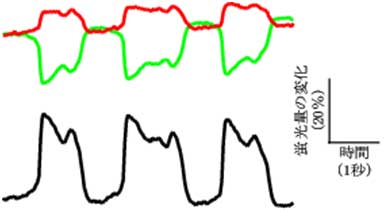
緑、赤、黒のトレースは、それぞれ、mUKG、mKOκの蛍光量変化、および、その比を時間に対して、プロットしたもの。