Family C GPCRに属するGABAB受容体は、X線結晶構造が未だ解かれていないこともあって、その活性化メカニズムの全貌は明らかではない。本研究では、この受容体を構成する2種のサブユニットGB1aおよびGB2の細胞内ドメインに蛍光蛋白を挿入することで、FRETペアを細胞膜上で形成させ、リガンド結合にともなう動的構造変化をFRET変化としてタイムラプスで捉えることを試みた。その結果、サブユニット間のFRETペアでは、アゴニストとしてBaclofenまたはGABAを加えた際、GB1aの細胞内第2ループ(i2)およびGB2の細胞内第2ループ(i2)に蛍光蛋白を持つペアと、GB1a第2ループ(i2)およびGB2第1ループ(i1)に蛍光蛋白を持つペアで、ともに15 %前後のFRET減少が見られた。両ペアからのFRET変化は野性型受容体とほぼ同じEC50値をもち、アンタゴニストによりブロックされてallosteric modulatorにより増強される等、ほかの薬理的性質も同等であった。これに対し、各サブユニット内のFRETペアにおいては、アゴニスト単独およびallosteric modulator共存下での投与ではFRET変化はほとんど見られなかった。以上の知見より、GABAB受容体の活性化時にはサブユニット同士が非対称に離れるという配置変化が起き、その一方で、サブユニット分子内における構造変化はわずかなものであろうと結論付けた。これは、同じくFamily Cに属する代謝型グルタミン酸受容体のサブユニットの配置変化様式とは、質的に大きく異なるものである。
Shinichi Matsushita, Hiroyasu Nakata, Yoshihiro Kubo, and Michihiro Tateyama Ligand-induced rearrangements of the GABAB receptor revealed by fluorescence resonance energy transfer
The Journal of Biological Chemistry, 285(14): 10291-10299 (2010)
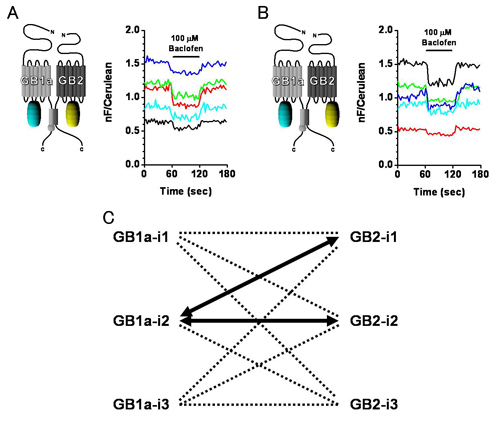
GB1a-i2 & GB2-i2ペア(A)とGB1a-i2 & GB2-i1ペア(B)は、ともにアゴニストであるBaclofenによりFRETの減少を示す。C: アゴニストによりFRET変化が見られた細胞内ループ間の組み合わせ(太い矢印)。
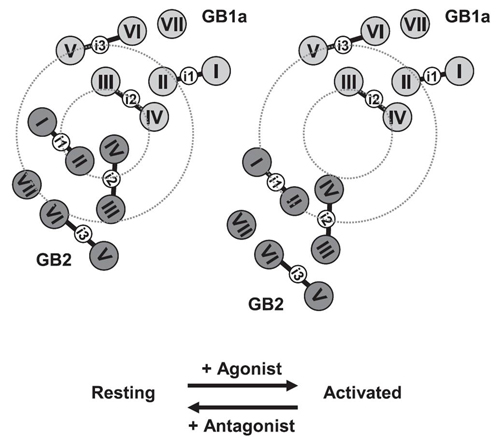
図1の結果を基づくGABAB受容体の活性化モデル。