糖尿病の発症に伴って、発症初期に痛みが増強されることが知られています。これは“糖尿病性神経症に伴う疼痛発生”として知られていますが、これまでどういったメカニズムで糖尿病性神経症が引き起こされるのか、その分子メカニズムは全く知られていませんでした。今回、自然科学研究機構 生理学研究所(岡崎統合バイオサイエンスセンター)の富永真琴教授と柴崎貢志助教(現・群馬大学)の研究チームは、ルーマニアからの招へい研究者ヴィオレタ・リストウさんと共同で、糖尿病の発症初期の痛み感覚の増大に、カプサイシン受容体の一種である痛み分子センサーTRPV1(トリップ・ブイワン)が関与していることを明らかにしました。鎮痛剤開発につながる研究成果です。本研究成果は、痛みを扱うトップレベルの科学専門誌「PAIN(ペイン、痛み)」4月号に掲載され、表紙を飾ります(3月9日電子版掲載)。
研究チームは、糖尿病の発症に伴って、末梢の神経細胞の周囲では微小血管の病変などのため酸素不足になることに注目。ラットの痛みを感じる神経細胞(後根神経節細胞)を取り出して、糖尿病発症の際の低酸素・高血糖と同じ条件(糖尿病様条件)になるように人工的に刺激を与え、このときの痛み分子センサーTRPV1の反応を調べました。すると、糖尿病様条件では、TRPV1がより強く反応することを明らかにしました(図1)。さらに、研究チームは、低酸素と高血糖のどちらがTRPV1をより刺激するのか調べたところ、低酸素が重要な役割をはたしていることをつきとめました。さらに、低酸素によって引き起こされる細胞内での分子メカニズムの詳細を明らかにしました(図2、図3)。
富永教授と柴崎助教は「糖尿病性神経症に伴う疼痛の発症機序を明らかとしたことで、臨床現場での治療が行いやすい土台が出来た。つまり、突き止めた分子メカニズムの途中を阻害すれば、糖尿病性神経症の治療薬開発を行うことが出来、新たな治療法開発に大きな道筋となる」とその意義を語っています。
1.糖尿病発症初期の痛みの増大に、痛み分子センサーであるTRPV1が重要な役割を果たしていることを発見しました。
2.糖尿病発症の際の低酸素・高血糖と同じ条件(糖尿病様条件)では、TRPV1痛み分子センサーの反応が増大していました。特に、低酸素条件が重要でした。
3.糖尿病様条件で活性化される細胞内の分子メカニズムを明らかにしました。
TRPV1痛み分子センサーの電流応答が増大
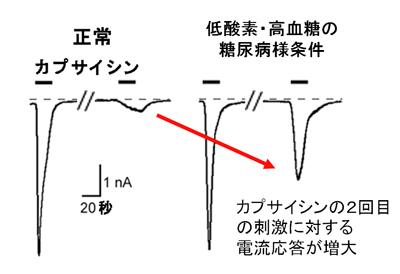
低酸素・高血糖の糖尿病様条件で、TRPV1痛み分子センサーをカプサイシンで2回連続して刺激したときの電流応答の様子。正常に比べて、2回目の電流応答が増大していることが分かる。電流応答が大きいほど、痛みの感覚も増大する。
痛み感覚が増大する仕組み
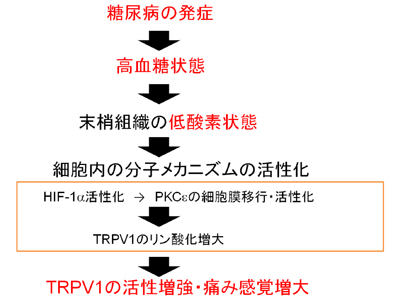
今回の研究成果から考えられた痛み感覚が増大する仕組み。低酸素・高血糖の糖尿病様条件により、細胞内の分子メカニズムが活性化し、それによって、TRPV1の反応も増強。このため、痛みの感覚も増大するものと考えられる。
細胞内で活性化するメカニズム
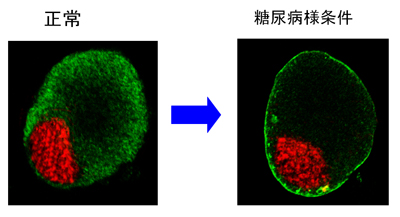
低酸素・高血糖の糖尿病様条件により活性化される細胞内の分子メカニズムの一つ。PKC epsilonと呼ばれる酵素が活性化し、細胞の表面(細胞膜)に移動(緑色)。これによって、細胞膜にあるTRPV1痛み分子センサーの感受性が高まる。
1.糖尿病性神経症に伴う痛み増大の分子メカニズムが明らかに
本研究により、これまで全く不明であった糖尿病発症に伴う痛み感覚増大の分子メカニズムを明らかにすることができました。今回発見された細胞内メカニズムの途中を阻害することができれば、鎮痛剤の開発につながるものと期待されます。
Hypoxia-induced sensitization of transient receptor potential vanilloid 1 involves activation of hypoxia-inducible factor-1 and PKC
Violeta Ristoiu, Koji Shibasaki, Kunitoshi Uchida, Yiming Zhou, Bich-Hoai Thi Ton, Maria-Luiza Flonta and Makoto Tominaga
痛み専門雑誌”PAIN” 4月号掲載。online publication (2011年3月8日電子版)
<研究について>
自然科学研究機構 生理学研究所 細胞生理研究部門
教授 富永真琴 (とみなが まこと)
Tel: 0564-59-5286 FAX: 0564-59-5285
email: tominaga@nips.ac.jp
<広報に関すること>
自然科学研究機構 生理学研究所 広報展開推進室 准教授
小泉 周 (コイズミ アマネ)
TEL 0564-55-7722、FAX 0564-55-7721
pub-adm@nips.ac.jp
カプサイシン受容体TRPV1は1997年に分子実体が初めて明らかとなった侵害刺激受容体であり、現在までに急性疼痛、様々な炎症性疼痛に関与することが明らかとなっている。近年、糖尿病モデル動物で正常時に比べてTRPV1活性が増強することが見いだされ、糖尿病性神経症に伴う疼痛発生へのTRPV1の関与が考察されている。しかしながら、糖尿病の進行に伴って、どのような因子がTRPV1活性の増強を引き起こし、糖尿病性神経症が惹起されるのかは全く不明であった。
我々は、糖尿病に伴う高血糖により生じる末梢血管の障害等により、神経細胞に充分な量の酸素が供給されないことが、TRPV1活性増強の引き金になるのではないかと仮説を立てた。そして、これを立証するために、ラットDRG神経細胞を単離し、糖尿病様条件でTRPV1活性を調べた。その結果、糖尿病様条件によるTRPV1活性の有意な増大を観察した。この結果は、短期間の糖尿病様条件がTRPV1活性の増強を引き起こす主要因であることを強く示唆している。さらに、低酸素と高血糖のどちらがTRPV1活性化を増大させるのかを調べ、低酸素こそが主要な痛み増大要因となっていることを突き止めた。感覚神経細胞が低酸素に暴露された際にどのような分子メカニズムで痛みが増大するのかを調べ、酸素不足 → 低酸素誘導転写因子HIF-1の活性化 → PKCepsilon活性化 → TRPV1のリン酸化(活性化)を引き起こすことで、最終アウトプットとして痛みセンサー(TRPV1)の異常活性化が起こり、痛みが増大するという一連のカスケードを同定した。
以上の結果より、糖尿病性神経症に伴う疼痛の発生機序が明らかとなった。今回見いだしたカスケード(HIF1、PKC、TRPV1)をブロックすることで有効な鎮痛薬の開発につながると考えられる。