生体を構成する各細胞は、その周囲から様々な情報を受けて多様に形態変化を起こしたり、分裂や移動、あるいは自らを細胞死(アポトーシス)に誘導したりする場合がありますが、その時々に応じて細胞の容積は適切に調節されています。細胞容積調節は細胞内外への正味の水及び溶質の移動が調節されることにより達成されますが、その際に陰イオン(アニオン)の移動を調節する主なものとして、細胞容積センサー外向整流性アニオンチャネル(VSOR)があらゆる細胞に備わっていることが知られています。かつて私たちは、脳内の主要なグリア細胞であるアストログリアに炎症化学伝達物質のブラジキニンが作用するとVSORが活性化され、それを通じてCl–イオンのみならず興奮性アミノ酸アニオンのグルタミン酸が放出されることにより、VSORが周囲神経細胞への情報伝達の役割をも担っていることを明らかにしました (Liu et al. (2009) J Physiol 587(10):2197-2209)。最近私たちは、そのVSOR活性化が細胞内Ca2+濃度上昇の供給源となる個々のCa2+チャネル分子の極めて近傍で制御されていることを突き止めました。
ブラジキニンはGq蛋白質共役型のB2受容体への作用を介して、まず細胞内Ca2+ストア上のIP3受容体Ca2+チャネル、続いて細胞膜上のストア作動性ないし受容体作動性Ca2+チャネルの開口を誘起しますが、それぞれのチャネル分子開口部からおよそ20 nm以内に形成される高Ca2+濃度領域「Ca2+ナノドメイン」内で、Ca2+依存性リン酸化酵素PKCの活性化が制御され、それがさらに活性酸素種(ROS)生成酵素NOXの活性化を促すことを通じてVSORが活性化されていることが判明しました(図1)。
このようなCa2+ナノドメインを介するVSOR活性化機構により、たとえブラジキニンが細胞のごく一部にのみ少量作用した場合でも、開口した個々のCa2+チャネルの周囲で確実に活性化シグナルが発生すると同時に、複数の酵素系を介することで細胞内Ca2+濃度上昇終了後もしばらくの間VSOR活性化が維持されるため、この機構は細胞の局所的な容積調節、即ち形態変化や細胞間シグナル伝達の維持に重要な役割を果たしていると考えられます。
Akita T and Okada Y (2011) Regulation of bradykinin-induced activation of volume-sensitive outwardly rectifying anion channels by Ca2+ nanodomains in mouse astrocytes. J Physiol 589(16):3909-3927.
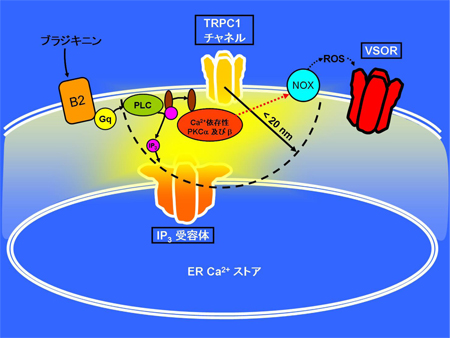
ブラジキニンがアストログリア上のB2受容体に作用すると、Gq蛋白・ホスホリパーゼC(PLC)の活性化によりイノシトール3リン酸(IP3)が細胞内に生成されます。IP3は細胞内小胞体(ER)Ca2+ストア上のIP3受容体Ca2+チャネルを開口させ、それに続いて細胞膜上のストア作動性ないし受容体作動性と呼ばれる各種Ca2+チャネルの開口も誘導されますが、それらのCa2+チャネルの中でもIP3受容体及びTRPC1チャネルの開口部近傍およそ20 nm(1 nmは100万分の1 mm)以内のCa2+ナノドメインで活性化されたCa2+依存性リン酸化酵素PKC及びが、活性酸素種(ROS)生成酵素NOXの活性化を通じて、VSOR活性化に強く関わっていることがわかりました。