KCNQ1チャネルは心臓、腸、胃、腎臓、すい臓など、脳神経系を除く体中のさまざまな器官に発現する電位依存性のカリウムチャネルです。不整脈の原因遺伝子であることから心臓の興奮性を制御する重要な機能を担うことはよく知られていますが、糖尿病の発症に関連していることも最近明らかになり、近年さらに注目を集めています。
KCNQ1チャネルはKCNEと呼ばれる修飾サブユニットによってその機能が大きく変わります。例えばKCNE1はKCNQ1を非常にゆっくりと開閉するチャネルに変化させ、KCNE3はKCNQ1を常時開状態に変化させます。しかし、なぜKCNEの種類によってこれほどまでにKCNQ1の機能が異なっているのか、そのメカニズムはよくわかっていませんでした。
原索動物であるユウレイボヤは、そのゲノム上にKCNQ1遺伝子(Ci-KCNQ1)を持っていますがKCNE遺伝子は持っていません。私達の予想通り、Ci-KCNQ1はKCNEによって修飾される能力を失っていましたので、Ci-KCNQ1とヒトのKCNQ1遺伝子を比較することで、KCNQ1上におけるKCNEによる修飾機構に重要な部位を同定しました。それによると、KCNE1にとってはポアドメイン(S5-S6セグメント)の疎水性アミノ酸(図中黄色のアミノ酸)が重要だとわかったのですが、KCNE3にとってはそれらのアミノ酸は重要ではなく、S1セグメント上の3つのフェニルアラニン (図中オレンジ色のアミノ酸)が重要であることを突き止めました。各KCNE分子はKCNQ1上の異なる部位に作用して機能修飾を行っていることが明らかとなり、これにより、各KCNEが極めて異なる機能を持つことができるのだと考えられます。
本研究は文部科学省研究費補助金の補助を受けて行われました。
本研究は生理学研究所と大阪大学との共同研究です。
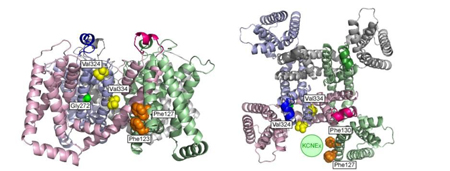
図の説明:KCNQ1上のKCNE1作用部位とKCNE3作用部位のマッピング
四量体KCNQ1を横から見た図(左)と上(細胞外側)から見た図(右)。右図ではKCNE分子が位置すると考えられている場所を緑色の円で示してある。KCNE1分子が作用すると考えられる部位は272番目のグリシン(Gly272; 緑)と324番目と334番目のバリン(Val324, Val334; 黄色)でそれぞれポアドメインに位置する。KCNE3が作用すると考えられる部位は123、127、130番目のフェニルアラニン(Phe123, Phe127, Phe130)で、S1セグメント上の同じ側に並んでいる(左図ではPhe130、右図ではPhe123がそれぞれ隠れて見えていない)。
KCNQ1 subdomains involved in KCNE modulation revealed by an invertebrate KCNQ1 ortholog.
Koichi Nakajo, Atsuo Nishino, Yasushi Okamura and Yoshihiro Kubo.
Journal of General Physiology 138: 521-535, 2011.