古瀬幹夫
タイトジャンクションは、上皮系細胞のシートが体の中の様々なコンパートメントを仕切るにあたり、細胞のすき間を符スeァ由に通り抜けないようシールする細胞間接着構造である。興味深いことに、タイトジャンクションのバリアの働きは、各器官の生理機能に適うかたちで非常に強いものから弱いものまで細胞のタイプにより様々であることが知られている。このようなタイトジャンクションの炊^が、クローディンファミリーに代表されるタイトジャンクションの構成膜タンパクソの同定と機能解析により分子レベルで理解できるようになってきた。そして、細胞生物学から始まったタイトジャンクション研究は、個体レベルの生理学・医学へと広がりを見せている。
1.はじめに
様々な多細胞動物の体のつくりをながめると、進化の過程で多細胞動物が出現して発展を遂げるためには上皮構造の発明が必須であったことがよくわかる。まず上皮でできた閉じた袋を考えたとき、袋の一カ所を深く押し込んで陥入させれば腔腸動物の体とみなすことができるし、この陥入をさらに押し込んで貫通したトンネルを入り組ませて消化管や付随する器官としたのが、より高等な動物の体の基本構築である1)。
ここで上皮構造の第一の役割は、体の内と外を隔てることである。すなわち、極性をもった上皮細胞同士がシート状に接着して形成される上皮構造は、細胞膜上の輸送タンパクソや膜小胞輸送系によって方向性のある符ス輸送を行うと同時に、体の内と外を仕切るバリアの役割を果たすことによって外界とは異なる内部環境をつくりあげる。さらに多細胞動物は、消化管に限らず、腎管系、血管系をはじめとする上皮系の細胞シートによって、体の内にも同様の方法で固有の溶液環境からなる様々なコンパートメントを形成し、そのことによってはじめて単細胞生物では不可能な多くの高度な機能を可能としている。
このような上皮の本ソ的な役割を細胞間接着の観点から考えると、上皮細胞には、お互いが機械的に強く接着してシートをつくること以外に、細胞と細胞の隙間を何らかのかたちでシールして、水溶性分子がこの部分りァ由拡散によって素通りする(漏れる)のを防ぐメカニズムが必要である。タは、多細胞動物の上皮系細胞には細胞間隙のバリアとして機能するための特殊な接着構造が備わっている。脊椎動物においてその役割を担うのが本稿で扱うタイトジャンクションである。
2.タイトジャンクションの形態学と生理学
今から40年以上前、Farquhar とPaladeは、電子顕微鏡観察から脊椎動物の上皮細胞に普遍的に存在する細胞間接着構造の複合体(the junctional complex)を報告した2)。この複合体は、形態的に異なる3種類の接着装置であるタイトジャンクション(以下TJ)、アドヘレンスジャンクション、デスモソームから構成される。アドヘレンスジャンクションとデスモソームでは、隣り合う2枚の細胞膜が約20ナノメートル離れており、それぞれカドヘリン、デスモソームカドヘリンが接着分子として働いて機械的な細胞間接着を担うことが今では知られているが、これら二つの接着装置に比べてTJの形態的特徴は際だっている3)(図1)。すなわち、超薄切片像では、TJにおいて隣り合う細胞膜がところどころで完全に密着して見える。また、凍結割断レプリカ法で観察すると、細胞膜内にTJストランドと呼ばれるひも状の構造のネットワークが見られる。そして、TJは接着複合体の最もアピカル側に存在して細胞周囲を取り巻いている。このような形態より、発見当初からTJは細胞間隙における拡散バリアの役割を担うとみなされ、タ際にFarquharとPaladeは、TJを報告した最初の論文でヘモグロビンをトレーサーとしてこのアイデアを形態学的手法で見事に証明している2)。これがTJのバリア機能であり、先述のように上皮が様々なコンパートメントを仕切るために必須であると考えられている。
しかし、より正確に言えばTJは完全なバリアではない。生理学的手法による研究から、上皮細胞シートを横切る符ス輸送の通り道として、細胞膜上の輸送タンパクソを介するtranscellular
pathwayと、細胞間隙(すなわちTJ)を介するparacellular pathwayがあることが知られている4)(図2)。前メは能動的な輸送を含むのに対して娯qは受動的輸送のみであり、その総和が上皮輸送である。つまり、TJはタンパクソのような巨大分子に対してはきわめて厳しいバリアであるが、無機イオンや水といった小分子を通しうる「穴」("aqueous
pore"とか"paracellular channel"と呼ばれる)を内包すると考えられてきた5)。さらに興味深いことに、paracellular
pathwayの透過性(言い換えればTJバリア機能特性)は上皮の種類によって大きく異なる4)。このことは、漏れると不都合な上皮には強いバリア機能のTJが存在する一方で、漏れやすい上皮ではむしろparacellular
pathwayを介した小分子の受動的輸送が生理的に重要であることを意味するが、長らくその分子メカニズムは不明であった。
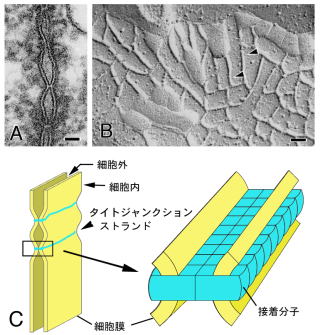
図1タイトジャンクションの構造
(A)TJの超薄切片電子顕微鏡像。 隣り合う2枚の細胞膜がところどころで密着して見える。
(B)TJの凍結割断レプリカ像。 TJストランド(矢頭)のネットワークが観察される。これがベルト状に細胞周囲を取り巻いている。
(C)TJストランドの構造モデル。 接着分子が細胞膜内でひも状に重合することによって細胞膜密着部位およびTJストランドが形成されると考えられてきた。
スケールバー:50 nm
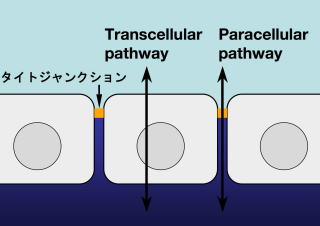
図2 TJのバリア機能と上皮輸送の二つの経路
3.TJの主要接着分子クローディンの同定
細胞間接着構造であるTJのバリア機能vセ体を分子レベルで明らかにするためには、その接着分子の同定が欠かせない。ところが、筆メが月田承一郎研究コで研究を開始した1992年当時、TJの構成分子としてその存在が確タに知られていたのは、TJを認ッするモノクローナル抗体から同定されていたZO-16)、チンギュリン7)という2種類の膜裏打ちタンパクソのみであった。TJを高純度に単離する方法がなく、運良く得られたTJ抗原に対する抗体が当時の唯一の研究手段であった。
これに対し筆メらは、ヒヨコ肝臓より単離したTJを多く含む細胞膜分画を抗原にしてやはりモノクローナル抗体を作製し、局在を指標としたスクリーニングによって、TJに局在するはじめての膜タンパクソであるオクルディンを同定することに成功した8)。当初、4回膜貫通型タンパクソであるオクルディンはTJストランドをつくる接着分子と目されていたのだが、その後、マウスオクルディン遺伝子をノックアウトしてもTJが全く影響を受けないことが判明し9,10)、TJをつくる接着分子が別に存在することe、された。そこで筆メらは、この接着分子を同定するために、再びヒヨコ肝臓から単離した細胞接着膜分画に戻り、この膜からさらに細かい生化学的分画によってTJの濃縮を試みた。その過程でオクルディンと挙動を共にする膜タンパクソのバンドが得られ、新規4回膜貫通型タンパクソがクローニングされた。これが本稿で述べるTJの接着分子クローディンである11)。現在では、クローディンがTJの基本構造である細胞膜密着部位およびTJストランドの主要構成成分であり、かつバリア機能において中心的な役割を果たしていることが明らかになっている。
4.クローディンファミリーによるTJ形成
1)クローディンの構造
クローディンは分子量約23kDaの4回膜貫通タンパクソで、N末端とC末端を細胞ソ側に向け、細胞外に二つのループをもつ11)(図3A)。クローディンは遺伝子ファミリーを形成しており、ヒト、マウスのゲノム上で約24のサブタイプが存在する12,13)。第一細胞外ループにはほとんどのクローディンに共通のモチーフ、GLW(XX)C(8-11X)Cがある14)。これに類似する配列は、より遠縁の4回膜貫通タンパクソであるPMP22,
EMP, MP20, 電位依存性カルシウムチャネルのg5サブユニットなどにも保存されている14)。さらに、クローディンのC末端のほとんどは-YVで終わるPDZドメイン結合モチーフとなっており、タ際にZO-1,
ZO-2, ZO-3, MUPP-1といった、TJの裏打ちタンパクソのPDZドメインと直接結合する15,16)。
2)クローディンのTJ形成能
内在性のクローディンを発現せずTJをもたないマウスL線維芽細胞にクローディンを強制発現させると、クローディンは細胞間接着面に両細胞からひも状に濃縮し、この部分に電子顕微鏡で観察できる細胞膜密着部位、およびTJストランド構造をつくる17)(図3B)。このとき細胞はお互いの接着能を獲得する18)。この結果は、クローディンがTJストランドをつくる主要構成成分かつ接着分子であることり、している。さらに、特定のクローディンの細胞外ドメインに特異的に結合することが知られている腸管感染性細菌毒素Clostridium
perfringens enterotoxinの組換えタンパクソを培養上皮細胞に添加すると、TJが壊れて細胞シートのバリア機能が下がることから、クローディンはTJのバリア機能を直接担う分子であることが証明された19)。
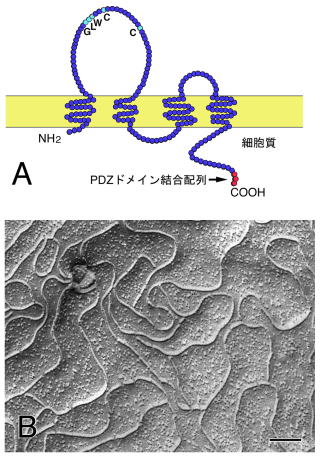
図3 クローディンによるTJ形成
(A)クローディンの構造
(B)クローディン3を導入したマウス線維芽細胞に形成されたTJストランド(凍結割断レプリカ像)
スケールバー:100 nm
3)クローディンファミリーの発現とTJストランドの構造
クローディンファミリーの発現に関して重要なことが二点ある。第一に、各クローディンは特有の組織発現パターンり、す12)。より正確には、組織ごとでなく細胞のタイプによって発現がかなり細かく規定されている20,21)。第二に、ほとんどの細胞では複数のクローディンタイプが1細胞に共発現している21,22)。ではこのとき、異なる複数のクローディンはどのようなかたちでTJに組み込まれているのだろうか。L細胞を用いた一連のTJ再構炊セ験より、TJストランドはこれらの異なるクローディンタイプが共重合してできていることがわかった。すなわち、TJストランドには異なるクローディンが混ざっており、細胞間で見た場合、クローディンタイプはホモにもヘテロにも会合できる22)(図4A)。つまり、TJの構造と機能の単位であるTJストランドは一般に複数のクローディンタイプのモザイクから成り、上皮の種類によってその組み合わせが異なる。したがって、TJストランドは構造的に多様性をもつと言ってよい。さらにクローディン以外のTJの膜タンパクソであるオクルディン、JAMなどがTJに存在するが、これらがTJストランドそのものに組み込まれているのか、そのごく近傍に存在するのかは今のところ不明である。
5.TJのバリア機能の多様性
先述の通り、TJのバリア特性は上皮のタイプによって大きく異なるが、その分子メカニズムを理解することはこの研究分野におけるきわめて重要な課題であった。TJのバリア機能を簡便かつ最も感度よく検出する方法として、経上皮電気抵抗(transepithelial electric resistance: TER)の測定がある。細胞膜の電気抵抗がきわめて高いのに対して、タ際の上皮細胞シートの電気抵抗値はparacellular pathwayの寄与によって低くなる。その程度から、イオンに対するparacellular pathwayの透過性、すなわちTJのバリア機能を見積もることができるが、上皮細胞シートの由来によってTER値は5 ? x cm2程度から5000 ? x cm2以上と様々である4)。タは、上皮のタイプによってTJストランドの形態的な複雑度に多様性があることが知られており、TJストランドの本数とTER値には概ね相関があると報告されてきた5,23)。ところが、中にはTJストランドの発達度が似通った上皮間でもTER値が大きく異なる場合があったり24)、paracellular pathwayの電荷選択性(陽イオンと陰イオンのどちらがより透過しやすいか)が上皮によって異なるという事タから4)、TJには量的な違い以外に何らかvス的な違いが存在することが一方で指摘されていた。
現在、こvス的な違いは、各上皮細胞のTJストランドを構成するクローディンタイプのセットの多様性に起因すると考えられており、ここ4,5年の間にこのアイデアが正しいことが国内外の研究により証明されつつある。具体的には、内在性に複数のクローディンを発現している培養上皮細胞(ほとんどは、この研究分野で歴史的に最もよく用いられてきたイヌ腎臓由来のMDCK 細胞)に外から特定のクローディンを強制発現させることによって、TJのバリア特性が変化する。たとえばクローディン1,4陽性、クローディン2陰性のMDCK細胞にクローディン2を強制発現させると、TJストランドの形態はほとんど影響を受けないにもかかわらず、TERが数十分の一に減少するとともに、paracellular pathwayの陽イオン選択性が高まる25,26)。一方、クローディン4や8を強制発現させると、TERは上昇し、陽イオンに対する透過性が下がるが、陰イオンの透過性にはほとんど影響がない27,28)。さらに、人為的に変異を入れて細胞外領域の構造や荷電の分布を変えたクローディンを強制発現させると、それに応じてTJの電荷選択性も変化する29,30)。
これらvセ験結果は、発現するクローディンの組み合わせや量比によって、TJの「穴」の数あるいは大きさ、さらに電荷選択性が規定されることり、している。そして、この穴の炊^は、TJストランド内でのクローディン分子の細胞外領域の立体構造や荷電に依存するはずである(図4B)。一部のクローディンがTJストランドに「穴」をつくり、他のクローディンは「壁」をつくる炊^をもつという考え方がある一方、相性の悪いクローディン同士が対合した場合に「穴」が生じるという考え方も可能であるが、詳細はまだよくわかっていない。
ただし、このようtセ験には限界がある。特定のクローディンを培養上皮細胞に外から導入しても、観測できるのはあくまで内在性クローディンを含めたセットとしての炊^なので、用いる細胞によって測定結果が異なることがある31)。さらに外来性クローディンの導入が内在性クローディンの局在等に影響を及ぼす場合もある28)。このような理由から、TJのバリア特性の分子論的芽ンには難しい面がある。もし、クローディンを全く発現せずTJも持たない上皮細胞株が存在して、これに思い通りの組み合わせのクローディンを導入してTJをつくらせてその機能を解析できれば、この点についてさらに考察を進めることができるだろう。
現在、TJストランドのさらに微細な構築についてはまだ不明な点が多い。TJストランドにおいてクローディン分子はどのような立体構造をとっているのか。TJストランドの単位はクローディンのモノマーなのかオリゴマーなのか。TJストランドの「穴」はクローディンが細胞間で対合する部分に存在するのか、それとも隣り合うクローディンとの間に存在するのか。これらの疑問に答えるためには構造生物学的研究の成果を待たなければならない。
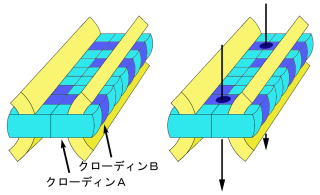
図4 複数のクローディンタイプからなるTJストランドの構造のモデル
(左)簡単化のためクローディンA,B(異なる色)の2種類からできているTJストランドを表す。一般にTJストランドは異なるクローディンタイプのモザイクである。詳細は本文。
(右)クローディンAが「壁」、クローディンBが「穴」を作る炊^のクローディンである場合のモデル。ただし、「穴」eセ際にストランド内のどこに形成されるのかは不明である。もし穴の内部がマイナスに荷電していれば、TJは陽イオンを通しやすくなると予想される。
6.TJストランドのダイナミクス
TJストランドはクローディンがつくる細胞膜内の繊維状ポリマーと考えられる。繊維状のタンパクソポリマーと言えば、重合、脱重合のダイナミクスがその生理機能にきわめて重要な意味をもつ細胞骨格群がすぐに思い浮かぶが、TJストランドは細胞膜内でいったいどのような動態り、すのだろうか。
蛍光タンパクソGFPとクローディン1の融合タンパクソをL細胞に発現させてできるTJ様構造では、上皮細胞のTJよりもTJストランドの集まりが粗である場合が多く、その結果、1本のTJストランドを蛍光顕微鏡下で可視化することができる17,32)。そこでこの細胞を生きたまま観察したところ、たいへん興味深いことに、TJストランドは、端と端あるいは端と側面で切れたりつながったりと、細胞膜内できわめてダイナミックにふるまうことがわかった32)。この現象はあくまでもL細胞による再構成系で観察されたものであり、上皮細胞のTJにそのまま当てはめられるか否かはまだわからない。しかし、このようなTJストランドのダイナミックな再編成が上皮細胞でも起きているとすれば、TJは、全体のバリアを破綻させることなく、しかしながらタンパクソ等の高分子をも含む符スがゆっくりと通るルートになるのではないか(図5)。今後、TJを介する符ス輸送を論じる際には、TJストランド内にある「穴」を介する小分子の輸送に加えて、TJストランドの再編成に起因するこのような遅い符ス輸送の可能性が十分に考慮されるべきであろう。
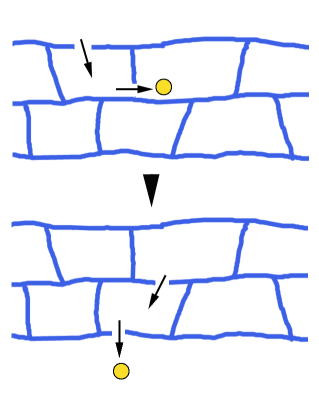
図5 TJストランドのダイナミックな再編成による符ス輸送のモデル
TJストランドが切れたり繋がったりすることによって、符スがTJを超えてゆっくりと受動的に移動することができる。詳細は本文。
7.3細胞結合とトリセルリン:TJ研究の新しい展開
TJは細胞周囲をベルト状に取り巻いており、細胞シートを見渡した場合にどの細胞間隙もシールすることになるので、細胞シートにとって十分なバリアとして機能する、という説明はもっともにきこえる。しかし厳密にはこれでは不十分である。なぜなら、細胞シートでは必ず三つの細胞が接する点(tricellular contact, tricellular junction とよばれる。本稿では「3細胞結合」とよぶ)が多数存在するが、この部分のシーリングはクローディンによって2細胞間で形成されるTJだけでは説明できないからである。上皮のバリア機能を考えた場合、TJシステムの弱点とも言えるこの場所を塞ぐことも重要である。
3細胞結合については、タは1970年代前半に電子顕微鏡によってすでにその特殊な形態が観察されている33,34)。その報告によると、この場所では3方向からTJがぎりぎりまで迫って3細胞が接する部位を絞り込むとともに、最も内側には、どの2細胞間にもapical-basal方向に長く伸びるTJストランドが存在し、結果的にこの部分に細いチューブを形成して符スを透過させにくくしている(図6A)。この一番内側のTJはtricellular TJ(以下tTJ)と呼ばれているが、どのようなメカニズムでtTJの特殊な構造が形成されるかは知られていない。
月田研究コの池ノ内らは、TJを構成する膜タンパクソであるオクルディンやクローディンの遺伝子が、上皮?間充織転換に関わる転ハ因子Snailによって著しく発現抑制を受けることを見出した35)。そこで、TJに関わる未知膜タンパクソをさらに探索する目的で、Snailを導入して上皮細胞の形ソりカわせた細胞で発現の下がる遺伝子群のジーンチップ解析を行った。その結果、ごく最近、tTJに濃縮する新規膜タンパクソを同定することに成功し、これをトリセルリン(tricellulin)と名付けた36) (図6B)。トリセルリンはやはり4回膜貫通型タンパクソで、興味深いことにC末端側細胞ソ領域の約130アミノ酸にわたってオクルディンと高い相同性り、す。また染色体上で両遺伝子が隣り合っていることからも、落ミが進化的に由来を同じくすることは間違いない。しかし免疫電子顕微鏡法で観察したところ、オクルディンがTJストランド全域に局在するのに対し、トリセルリンは上皮細胞のtTJのTJストランドに高度に濃縮していることが明らかになった36)。
トリセルリンの機能を調べるために、RNAi法によってその発現を抑えたマウス上皮細胞を作製したところ、興味深いことに3細胞結合におけるTJの構築に異常が見られた。さらに不思議なことに、トリセルリンが無くなると2細胞間のTJまでもが脆弱になることがわかった36)。tTJ、さらにはTJ全体の構築におけるトリセルリンの役割の解明が、この分野の最新かつ本ソ的な研究課題として浮上してきた。トリセルリンとクローディンの相互作用などについて現在研究が進められている。
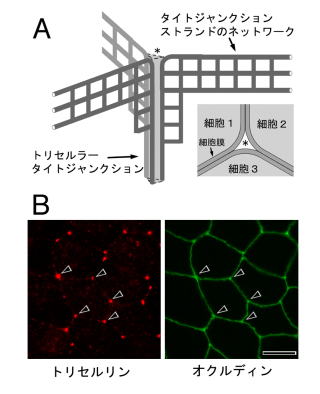
図6 3細胞結合とトリセルリン
(A)3細胞結合とトリセルラータイトジャンクション
3細胞結合(*)におけるTJストランドの様子を沫M的に表す。右下は細胞シートの3細胞結合部分(*)を上から見た図。詳細は本文。
(B)マウス上皮細胞株Eph4細胞におけるトリセルリンとオクルディンの二重蛍光抗体染色像。トリセルリンは3細胞結合部分(矢頭)に強く濃縮する。
スケールバー:10 um
8.個体におけるタイトジャンクションの機能?クローディンノックアウトマウスとクローディン病
従来、TJのバリア機能が個体の発生や様々な器官の生理機能に必須であることwH明とされてきたが、クローディン同定以前にこのことりセ証した例はなかった。なぜなら、TJの機能を個体レベルで人為的に操作する方法がなかったからである。しかし、最近になってクローディン遺伝子ノックアウトマウスが作出され、個体におけるTJのバリア機能の重要性が徐々に明らかになりつつある。乾燥に対する皮膚のバリア、血液脳関門、内ヲのバリア、ミエリンのバリアなど、TJが関与する様々なバリア機能の異常による影響が、軽微な症状から致死まで報告されている37-43)(表1)。
このような研究によって、従来の予想を検証するだけでなく、全く新しい知見が得られることが十分に期待できる。たとえば、クローディン1遺伝子欠クマウスは皮膚からの脱水によって生後1日以内に死亡する。このマウスの解析から、マウス表皮におけるTJの役割が初めて明らかになったが(37)、この結果は、私たちの表皮には機能的なTJが存在しないというこれまでの皮膚科学の通説を覆すものである。
さらに、ノックアウトマウスの解析と前後して、ヒトの遺伝炊]患の原因遺伝子としてもクローディンが見つかっており、その病態がTJのバリア異常によって芽ンされようとしている13,44,45)(表2)。今後の研究によって、バリア異常を伴う種々vシ患におけるTJの関与についてさらに理解が進むだろう。個体レベルで上皮のバリア機能について解析できるようになったことは、クローディンの同定がこの分野にもたらした大きな貢献と言える。
表1.クローディン遺伝子ノックアウトマウス
|
遺伝子 |
表現型(TJが影響を受ける細胞) |
文献 |
|
クローディン1 |
皮膚バリア異常による脱水・致死(表皮細胞) |
(37) |
|
クローディン5 |
血液脳関門不全・致死(脳血管内皮細胞) |
(38) |
|
クローディン11 |
行動異常(オリゴデンドロサイト) |
(42) |
|
|
精子形成不全による雄不妊(セルトリ細胞) |
(42) |
|
|
蝸牛管電位の異常と難聴(内ヲ血管条細胞) |
(40,41) |
|
クローディン14 |
内ヲ有毛細胞変性と難聴(有毛細胞) |
(39) |
|
クローディン19 |
行動異常(シュワン細胞) |
(43) |
表2.クローディン遺伝子の変異が原因のヒト遺伝セ患
|
遺伝子 |
セ患(TJが影響を受ける器官) |
文献 |
|
クローディン1 |
魚梨゚掾i皮膚)・胆管炎(肝臓) |
(45) |
|
クローディン14 |
難聴(内ヲ) |
(13) |
|
クローディン16 |
低マグネシウム血症(腎臓) |
(44) |
9.おわりに
本稿ではTJのバリア機能を担う分子基盤について、クローディンファミリーを中心に解説した。クローディンの同定によってTJ研究は急速に進み、細胞生物学にとどまらず、個体レベルの生理学・医学へと広がりを見せている。一方で、本文中でも述べた通り、クローディンの詳細な分子構造、TJ構築におけるトリセルリンの機能の分子メカニズムの解明など、まだ明らかにすべき本ソ的な課題が数多く残されている。たとえば、クローディン分子が細胞膜上でTJストランドをつくるために重合するメカニズムには不明な点が多い。上皮細胞ではTJは細胞膜側面の最もアピカル領域にだけ作られ、それ以外の細胞膜領域ではたとえクローディンが大量に存在していてもTJストランドが形成されないことから、クローディンの重合を制御するなんらかの機構が存在すると思われる。さらに、上皮細胞の種類によってTJストランドの発達度(量、パターン)が異なる理由もよくわかっていない。本文では触れなかったが、ZO-1などのクローディン細胞ソドメインに結合する膜裏打ちタンパクソがこれらの制御機構の鍵を握る可能性がある。TJに関わるこのような基礎的で重要な問題について今後の研究の成果が期待される。
最後に、あまり知られていない事タとして、系統発生において上皮細胞にTJをもつのは脊椎動物と原索動物(ホヤ)のみであることを付け加えたい46)。一般に無脊椎動物には、TJの代わりにセプテートジャンクション(以下SJ)という、隣り合う細胞の細胞膜が完全に離れた、TJとは形態が全く異なる細胞間接着構造が存在し、これが細胞間隙のバリア機能を担っている46)。ただし、SJと一言で呼ばれる構造にもその形態に多様性があり、それらが系統発生上の種間あるいは組織間で相同分子によって構成されているかどうかは今のところほとんどわかっていない。不思議なことに、ショウジョウバエのSJにクローディンの相同分子が存在し、タ際にバリア機能に関わるという興味深い報告もある47,48)。いずれにしても、マウス個体の生存に必須であることが明らかになったTJが、動物界全体を見渡して共通に見られる細胞構造ではないという事タにはいささか驚かされる。SJもTJも、個体における体液の恒常性というきわめて重要な生理に関わる細胞間接着構造である。一般に、細胞機能の違いが進化におけるボディープランの選択に影響した可能性は十分にあるのではないだろうか。SJとTJの構造と機能を比較することによって、将来、進化における上皮細胞によるTJの獲得と脊椎動物の出現が関係づけられるようになるかもしれない。
哽
私が大学院生のときから13年余にわたり研究の日々を共にし、サイエンスを楽しむことを教えてくださった恩師、故月田承一郎博士に本総説を捧げる。
本文で紹介した研究の多くは、京都大学大学院医学研究科分子細胞情報学講座において、月田承一郎教授の指導のもと、研究コスタッフと多くの大学院生の協力によって生まれたものであることをここに記し、心より滑ムいたします。
(1) 団まりな(1987)動物の系統と個体発生, 東京大学出版会, 東京
(2) Farquhar,
M.G. & Palade, G.E. (1963) J. Cell Biol. 17, 375-412
(3) Alberts,
B., Jonson, A., Lewis, J., Raff, M., Roberts, K., & Walter, P. (2002)
Molecular Biology of the Cell, pp.1066-1080
(4) Powell,
D.W. (1981) Am. J. Physiol. 241, G275-G288
(5) Claude,
P. (1978) J. Memb. Biol. 39, 219-232
(6) Stevenson,
B.R., Siliciano, J.D., Mooseker, M.S., & Goodenough, D.A. (1986) J.
Cell Biol. 103, 755-766
(7) Citi, S.,
Sabanay, H., Jakes, R., Geiger, B., & Kendric-Jones, J. (1988) Nature
333, 272-27
(8) Furuse,
M., Hirase, T., Itoh, M., Nagafuchi, A., Yonemura, S., Tsukita, Sa, &
Tsukita, Sh. (1993) J. Cell Biol. 123, 1777-1788
(9) Saitou,
M., Fujimoto, K., Doi, Y., Itoh, M., Fujimoto, T., Furuse, M., Takano,
H., Noda, T., & Tsukita, Sh. (1998) J. Cell Biol. 141, 397-408
(10) Saitou, M., Furuse, M., Sasaki, H.,
Schulzke, J.D., Fromm, M., Takano, H., Noda, T., & Tsukita, Sh. (2000)
Mol. Biol. Cell 11, 4131-4142
(11) Furuse, M., Fujita, K., Hiiragi, T.,
Fujimoto, K., & Tsukita, Sh. (1998) J. Cell Biol. 141, 1539-1550
(12) Morita, K., Furuse, M., Fujimoto, K.,
& Tsukita, Sh. (1999) Proc. Natl. Acad. Sci. USA 96, 511-516
(13) Wicox, E.R., Burton, Q.L., Naz, S.,
Riazuddin, S., Smith, T.N., Ploplis, B., Belyantseva, I., Ben-Yosef, T.,
Liburd, N.A., Morell, R.J., Kachar, B., Wu, D.K., Griffith, A.J., Riazuddin,
S., & Friedman, T.B. (2001) Cell 104, 165-172
(14) Van Itallie, C.M., & Anderson, J.M.
(2004) Physiology (Bethesda) 19, 331-338.
(15) Itoh, M., Furuse, M., Morita, K., Kubota,
K., Saitou, M., & Tsukita, Sh. (1999) J. Cell Biol. 147, 1351-1363
(16) Hamazaki, Y., Itoh, M., Sasaki, H.,
Furuse, M., & Tsukita, Sh. (2002) J. Biol. Chem. 277, 455-461.
(17) Furuse, M., Sasaki, H., Fujimoto, K.,
& Tsukita, Sh. (1998) J. Cell Biol. 143, 391-401
(18) Kubota, K., Furuse, M., Sasaki, H.,
Sonoda, N., Fujita, K., Nagafuchi, A., & Tsukita, Sh. (1999) Curr.
Biol. 9, 1035-1038
(19) Sonoda, N., Furuse, M., Sasaki, H.,
Yonemura, S., Katahira, J., Horiguchi, Y., & Tsukita, Sh. (1999) J.
Cell Biol. 147,185-194
(20) Rahner, C., Mitic, L.L., & Anderson,
J.M. (2001) Gastroenterology 120, 411-422
(21) Kiuchi-Saishin, Y., Gotoh, S., Furuse,
M., Takasuga, A., Tano, Y., & Tsukita, Sh. (2002) J. Am. Soc. Nephrol.
13, 875-886
(22) Furuse, M., Sasaki, H., & Tsukita,
Sh. (1999) J. Cell Biol. 147, 1351-1363
.(23) Claude, P., & Goodenough, D. (1973)
J. Cell Biol. 58, 390-400
(24) Stevenson, B.R., Anderson, J.M., Goodenough,
D.A., & Moosker, M.S. (1988) J. Cell Biol. 107, 2401-2408
(25) Furuse, M., Furuse, K., Sasaki, H.,
& Tsukita, Sh. (2001) J. Cell Biol. 153, 263-272
.(26) Amasheh, S., Meiri, N., Gitter, A.H.,
Schoneberg, T., Mankerts, J., Schlzke, J.D., & Fromm, M. (2002) J.
Cell Sci. 115, 4946-4976
(27) Van Itallie, C., Rahner, C., & Anderson,
J.M. (2001) J. Clin. Invest. 107, 1319-1327
(28) Yu, A.S., Enck, A.H., Lencer, W.I.,
& Schneeberger, E.E. (2003) J. Biol. Chem. 278, 17350-17359
(29) Colegio, O.R., Van Itallie, C.M., McCrea,
H.J., Rahner, C., & Anderson, J.M. (2002) Am J. Physiol. Cell Physiol.
283, C142-C147
(30) Colegio, O.R., Van Itallie, C.M., Rahner,
C., & Anderson, J.M. (2003) Am J. Physiol. Cell Physiol. 284, C1346-C1354
(31) Van Itallie, C.M., Fanning, A.S., &
Anderson, J.M. (2003) Am J. Physiol. Renal Physiol. 285, F1078-F1084
(32) Sasaki, H., Matsui, C., Furuse, K.,
Mimori-Kiyosue, Y., Furuse, M., & Tsukita, Sh. (2003) Proc. Natl. Acad.
Sci. USA 100, 3971-3976
(33) Staehelin, L.A. (1973) J. Cell Sci.
13, 763-786
(34) Wade, J.B., & Karnovsky, M.J. (1974)
J. Cell Biol. 60, 168-180
(35) Ikenouchi, J., Matsuda, M., Furuse, M., & Tsukita, Sh. (2003) J. Cell. Sci. 116, 1959-1967
(36) Ikenouchi, J., Furuse, M., Furuse, K.,
Sasaki, H., Tsukita, Sa., & Tsukita, Sh. (2005) J. Cell Biol. 171,
939-945
(37) Furuse, M., Hata, M., Furuse, K., Yoshida,
Y., Haratake, A., Sugitani, Y., Noda, T., Kubo, A., & Tsukita, S. (2002)
J. Cell Biol. 156, 1099-1111
(38) Nitta, T., Hata, M., Gotoh, S., Seo,
Y., Sasaki, H., Hashimoto, N., Furuse, M., & Tsukita, Sh. (2003) J.
Cell Biol. 161, 653-660.
(39) Ben-Yosef, T., Belyantseva, I.A., Saunders,
T.L., Hughes, E.D., Kawamoto, K., Van Itallie, C.M., Beyer, L.A., Halsey,
K., Gardner, D.J., Wilcox, E.R., Rasmussen, J., Anderson, J.M., Dolan,
D.F., Forge, A., Raphael, Y., Camper, S.A., & Friedman, T.B. (2003)
Hum. Mol. Genet. 12, 2049-2061
(40) Kitajiri, S., Miyamoto, T., Mineharu,
A., Sonoda, N., Furuse, K., Hata, M., Sasaki, H., Mori, Y., Kubota, T.,
Ito, J., Furuse, M., & Tsukita, Sh. (2004) J. Cell Sci. 117, 5087-5096
(41) Gow, A., Davies, C., Southwood, C.M.,
Frolenkov, G., Chrustowski, M., Ng, L., Yamauchi, D., Marcus, D.C., &
Kachar, B. (2004) J. Neurosci. 24, 7051-7062
(42) Gow, A., Southwood, C.M., Li, J.S.,
Pariali, M., Riordan, G.P., Brodie, S.E., Danias, J., Bronstein, J.M.,
Kachar, B., & Lazzarini, R.A. (1999) Cell 99, 649-659
(43) Miyamoto, T., Morita, K., Takemoto,
D., Takeuchi, K., Kitano, Y., Miyakawa, T., Nakayama, K., Okamura, Y.,
Sasaki, H., Miyachi, Y., Furuse, M., & Tsukita, Sh. (2005) J. Cell
Biol. 169, 527-538
(44) Simon, D.B., Lu, Y., Choate, K.A., Velazquez,
H., Al-Sabban, E., Praga, M., Casari, G., Bettinelli, A., Collussi, G.,
Rodriquez-Soriano, J., McCredie, D., Milford, D., Sanjad, S., & Lifton,
R.P. (1999) Scinece 285, 103-106
(45) Hadj-Rabia, S., Baala, L., Vabres, P.,
Hamel-Tellac, D., Jacquemin, E., Fabre, M., Lynnet, S., De Prost, Y., Munnich,
A., Hadchouel, M., & Smahi, A. (2004)? Gastroenterology 127, 1386-1390
(46) Lane, N.J., Martinucci, G., Dallai,
R., & Burighel, P. (1994) in Molecular Mechanisms of Epithelial Junctions:
From Development to Disease (Citi, S. ed.), pp.23-43, R.G. Landes Company,
Austin
(47) Behr, M., Riedel, D., & Schuh, R.
(2003) Dev. Cell 5, 611-620
(48) Wu, V.M., Schulte, J., Hirschi, A.,
Tepass, U., & Beitel, G.J. (2004) J. Cell Biol. 164, 313-323