1.位相差低温電子顕微鏡によるバクテリア細胞内核酸の動態観察
金子康子(埼玉大学教育学部,理工学研究科)
仲本 準(埼玉大学理工学研究科)
仁木宏典(国立遺伝学研究所)
前島一博(理化学研究所中央研究所)
田中雅嗣(東京都老人総合研究所)
新田浩二(テラベース株式会社)
永山國昭
位相差低温電子顕微鏡により氷包埋したシアノバクテリアの細胞内微細構造を細胞ごと高いコントラストで観察することが可能となった。この方法で観察した細胞は滑らかな膜構造を有し,細胞内には様々な大きさの顆粒状構造や繊維状構造を観察することができる。
氷包埋したシアノバクテリア細胞内のDNA分子を同定するために,チミジンアナログであるBrdUを含む培地で細胞を培養した。細胞内DNAがBrによりラベルされたことは,蛍光抗体法と,樹脂包埋超薄切片のEDX分析により確認した。位相差電子顕微鏡観察により,BrdUを取り込ませたシアノバクテリアのDNA領域は電子密度が高くなり,特徴的な構造を高いコントラストで観察することができた (Nitta K, Danev R, Nagayama K, Kaneko Y, J. Microscopy 234: 118-123, 2009)。本研究ではさらに,明暗周期により細胞分裂を同調化した細胞内のDNAをHoechst 33342で染色し,蛍光顕微鏡と位相差電子顕微鏡観察を組み合わせて観察し,細胞内クロモソームDNAの動態を明らかにすることを目指した。
Synechococcus elongatus PCC 7942 はBG-11寒天培地上で23℃,12H/12Hの明暗周期下で培養した。経時的にHoechst 33342でDNA染色した細胞を蛍光顕微鏡観察し,細胞周期によるDNAの形状変化を明らかにした。同様にHoechst 33342で染色した細胞を急速凍結後,細胞ごと位相差電子顕微鏡により観察した。
Hoechst 33342(分子量562)は生細胞に容易に浸透し,2本鎖DNAのAT領域に結合し,蛍光を発する。Hoechst 33342染色したシアノバクテリア細胞の核様体は,明暗周期に合わせて拡散?まだら状態,凝集状態,ひも状態など,規則的な形態変化を経て,細胞分裂時に分配される様子が蛍光顕微鏡観察により明らかになった。各段階の細胞を丸ごと氷包埋し,位相差電子顕微鏡観察すると,蛍光染色されたDNAとほぼ同じ部位に電子密度の高い領域が観察され,その領域に高いコントラストで特徴的な構造を観察することができた。今後,位相差電子顕微鏡トモグラフィーにより細胞内DNAの3次元立体構築を行い,シアノバクテリア細胞内DNAの空間的,経時的形状変化の解明を目指す。
2.白色脂肪細胞における容積センサーアニオンチャネルの
インスリン抵抗性発症への関与の検討
井上 華,小西真人(東京医科大学細胞生理学講座)
岡田泰伸(生理学研究所)
TNFa は脂肪細胞においてインスリン依存性グルコース取込を阻害する(インスリン抵抗性)。これまでに我々は前駆脂肪細胞株である3T3-L1を用いて,TNFa が容積センサーアニオンチャネル(VSORチャネル)を活性化し,その結果引き起こされる細胞容積の減少がインスリン抵抗性発症に関与することを示唆するデータを得ている。本研究では,生体から単離した白色脂肪細胞を用いて,これまでに3T3-L1で得られた知見が実際に生体内で起こりうるものであるかどうかを検討した。
正常マウス副精巣周囲脂肪組織より単離した白色脂肪細胞は細胞内の大きな脂肪滴により浮遊するため,天井培養によってカバーグラスに接着させた。接着した白色脂肪細胞にパッチクランプ法を適用しホールセル電流記録を行い,低浸透圧負荷によって細胞を膨張させ容積センサーチャネルが存在するか否かを検討した。ホールセルボルテージクランプ下で白色脂肪細胞を低浸透圧溶液に曝すと,内向き電流および外向き電流が活性化された。この電流の逆転電位はクロライドイオンの平衡電位に一致し,外液のクロライドイオン濃度を減少させると逆転電位が正方向にシフトしたことから,クロライド電流であることが明らかとなった。また,このクロライド電流は外向き整流性であり,強い脱分極電位で不活性化を示し,VSORチャネルの阻害剤であるNPPBやグリベンクラミドによって抑制された。これらの電気生理学的・薬理学的性質は,前駆脂肪細胞株3T3-L1において低浸透圧によって活性化される電流と一致していた。また,この電流はこれまで他の細胞で報告されているVSORチャネル電流の性質とも一致するものであり,白色脂肪細胞にVSORチャネルが発現していることが明らかになった。我々はこれまでに,3T3-L1細胞では等浸透圧条件下であってもTNFa によってVSORチャネルが活性化されることを観察していたので,急性単離白色脂肪細胞においてもTNFa でVSORチャネルが活性化されるかどうかを検討した。ホールセルボルテージクランプ下で白色脂肪細胞にTNF a を添加しても,電流の活性化は見られなかった。このことから正常マウスから単離した白色脂肪細胞では,TNFa 受容体が発現していないか,受容体からの活性化シグナルがチャネルに伝達されていない可能性が考えられ,これについては今後の課題である。
3.TRPM7と容積感受性クロライドチャネルの機能的相互作用とその分子同定
森 泰生,沼田朋大(京都大学 工学研究科)
佐藤かお理,岡田泰伸(生理学研究所)
細胞は,たとえ異常な浸透圧条件下においても自らの細胞容積を調節することにより生命活動を維持している。低浸透圧暴露による細胞膨張後の細胞容積調節過程,すなわち調節性容積減少(Regulatory Volume Decrease: RVD) の過程には,細胞容積増大をセンスして開口するTRPM7 (Transient Receptor Potential Melastatin 7) および容積感受性Cl-チャネル (VSOR) が大きな役割を担っている。TRPM7およびVSORは細胞容積調節のみならず細胞増殖や細胞周期,及び細胞死に関わるなど多くの両チャネルに共通した生理機能を持つ。このことから両チャネルには機能連関があると考え,分子実体の既知であるTRPM7の機能制御を行うことによりVSORの機能変化を観察し,分子実体に迫っていく。
現在までTRPM7の機能を阻害剤およびsiRNAを用いてTRPM7の活性を抑制するとVSOR活性が抑制することを確認している。さらに,低浸透圧による細胞膨張後のRVDにおいても阻害剤およびsiRNAにより抑制されることを確認している。本研究では,TRPM7の機能制御からVSORCl-チャネル及びその制御因子を同定し,それら分子群の相互作用メカニズムを解明することを目的とし,さらにVSORの分子同定を目指す。
今回,TRPM7から流入するイオン自体がVSORの活性に重要なのか,それとも,C末端の酵素活性がVSORの活性に重要なのかをポア変異,及びTRPM7のC末端酵素活性部位kinase-dead変異,酵素活性部位欠損変異を用いて検討したが,いずれも重要ではないことが判明した。一方でVSORとTRPM7は,機能的な連関が予想されるので,TRPM7にtagを付けてTRPM7,VSORを内在的に持つHEK293細胞にTRPM7を大量発現させてTRPM7と物理的に相互作用のある蛋白を免疫沈降してVSOR候補蛋白を探索し,いくつかの相互作用する蛋白質が見出された。今後は,この蛋白質の分子と役割の同定を行っていく。また,ノックダウンの容易なDT40細胞系を用いた検討も開始していく。
4.細胞容積センサーとして働く分子群の同定及び機能解析
赤塚結子,川西正祐(鈴鹿医療科学大学・薬学部)
岡田泰伸(生理学研究所)
細胞外及び細胞内の浸透圧変化に対応して自らの容積を一定に保とうとする働きは,動物細胞が生命を維持する上で必要不可欠な機能であるが,最近ではこの容積調節の破綻が細胞死につながることが明らかとなっており,細胞がいかに自らの容積をセンスし対応するかという点に注目が集まっている。細胞が一旦膨張した状態から元の体積に戻る調節性容積減少 (regulatory volume decrease: RVD) の過程は,細胞内の情報伝達系を介して,最終的には細胞内からのK+とCl-流出による駆動力が細胞内の水を細胞外に流出させることで達成される。特にこの場合のCl-の通り道であるチャネルは細胞の容積上昇を感知して開口するために容積感受性Cl-チャネル (VSOR) と名づけられているが,このチャネル分子の実体が不明であるため,RVDのメカニズムはわからない点も多い。
報告者は,VSORの調節蛋白質としてATP-binding cassette (ABC) 蛋白質スーパーファミリーに属するABCF2を同定しているが,本共同研究によって,ABCF2を大量発現させたHEK293T細胞ではVSOR電流が著明に抑制されること,それに一致してRVDも著明にブロックされること,またsiRNAでABCF2の発現を抑制するとRVDは亢進することが明らかになった。さらに,ABCF2がアクチン結合蛋白質であるアクチニン-4と結合することを見出しているが,細胞膜画分に存在するアクチニン-4とABCF2の親和性は低浸透圧刺激によって約8倍に高まることがわかった。ABCF2は低浸透圧刺激直後から,アクチニン-4は低浸透圧刺激によって細胞表面にラッフリング膜が形成される頃から細胞膜画分に集積してくるが,低浸透圧刺激後に両者の結合能力が高まることによってABCF2がVSORに結合することを抑制し,RVDが促進されると考えられた。実際にアクチニン-4を大量発現させたHEK293T細胞ではRVDが亢進し,siRNAでその発現を抑制するとRVDが抑制されることがわかっている。
一方,siRNAでアクチニン-4の発現を抑制したHEK293T細胞でもVSOR電流が観察されることがわかり,VSOR活性化に関わる分子はアクチニン-4以外にも存在することが考えられた。現在その分子を探索している。
5.ミツバチの社会性行動を担う新規温度受容センサーの生理機能の解析
門脇辰彦,河野景吾(名古屋大学大学院生命農学研究科)
曽我部隆彰,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
ミツバチの重要な社会性行動の1つとして,昼夜や季節に伴う外気温の変動に対し,巣内の温度を常に一定 (33℃) に保つ行動がある。したがって,ミツバチは他の昆虫には存在しない,温度受容センサーおよび温度認知能力を持つことが推定される。そこで,ミツバチゲノムの解読結果から同定された新規温度受容センサーの生理機能を解明することにより,集団として恒温性を示すミツバチの社会性行動の動作原理を抽出することを試みた。ミツバチゲノムからTRPMサブファミリー,TRPAサブファミリーに属する6つをクローニングして哺乳類expression vectorに入れたコンストラクトを作成した。その6つのミツバチTRPチャネルをHEK293細胞に強制発現させて,Ca2+イメージング法を用いて温度感受性を検討した。6つのTRPチャネルのうちTRPAファミリーに属する1つのチャネルを発現させたHEK293細胞に置いて40度までの温度刺激に対して細胞内Ca2+濃度の増加が認められた。このクローンについて,パッチクランプ法による膜電流解析を行い,全細胞記録法において30度前後で活性化する外向き整流性のある非選性陽イオンチャネル電流を確認した。ミツバチTRPチャネルの温度応答性の陽性コントロールとしてショウジョウバエで熱刺激感受性を欠失した変異体の原因遺伝子painlessを強制発現させたHEK29636細胞を用いた。painless遺伝子を導入したHEK293細胞はCa2+イメージング法において熱刺激に対して細胞内Ca2+濃度の大きな増加が観察され,パッチクランプ法でも熱活性化電流が観察された。活性化温度域値は細胞内外のCa2+濃度に依存するものの42度から44度であった。チャネル電流の活性化キネティクス,不活性化キネティクスに加えて,活性化温度閾値も細胞内Ca2+濃度に大きく依存することが明らかになった。また,painlessはAITCを含めたTRPA1刺激化合物に反応しないことが明らかとなった。
6.視床下部の摂食調節にかかわる生体分子センサーについての機能形態学的研究
塩田清二,影山晴秋(昭和大学医学部第一解剖学教室)
竹ノ谷文子(星薬科大学薬学部体育学研究室)
箕越靖彦,志内哲也
近年,オレキシン,ガラニン様ペプチド (GALP) やグレリンなどの発見により,神経ペプチドによる摂食調節機構が注目されている。特に弓状核で産生されるGALPは摂食調節とエネルギー代謝に深く関わっており,これまでに摂食調節にかかわるニューロンネットワークをラットで解明してきた。GALPはラットやマウスの摂食抑制および体重減少作用を示すが,マウス脳においては微量にしか存在しておらず,免疫染色でのニューロンネットワークを解析することは困難である。そこで,我々はGALPニューロンを形態学的解析のみならず電気生理学的にも解析できるように、Cre-loxPシステムによって緑色蛍光タンパク質を高発現するトランスジェニック (Tg) マウスを作製することを目的とした。
コンディショナルにGALP産生ニューロンに緑色蛍光タンパク質を発現させるために,GALPプロモーター制御下でDNA組み換え酵素Creと変異エストロゲン受容体との融合タンパク質を発現するトランスジーンと強力なプロモーター活性を持つプロモーターの下流にloxP-stopコドン-loxP-緑色蛍光タンパク質の2つのトランスジーンを構築した。それぞれを受精卵に微量注入し,遺伝子改変動物を作出した。それぞれの遺伝子改変動物を交配しcre-loxPシステムを持つダブルTgマウスを完成させた。このマウスにエストロゲン誘導体であるタモキシフェンを投与し,緑色蛍光タンパク質を過剰発現させた後,抗GFP抗体を用いて免疫組織学的に観察した。このマウスの視床下部弓状核でGFPの強い免疫陽性反応を検出した。したがって,このマウスから蛍光を指標としてニューロンを単離することにより電気生理学的実験に応用できる可能性を示唆した。
さらにGALPは循環血液中にも存在していることから,末梢臓器での産生が考えられる。そこで末梢臓器におけるGALPの発現をReal Time RT-PCR法で検討した。GALP mRNAは報告のある視床下部や下垂体での発現のみならず,脂肪細胞にも発現していた。本研究で作出したダブルTgマウスにおいて,緑色蛍光タンパク質の蛍光を白色および褐色脂肪細胞で観察した。以上の結果より末梢—中枢神経系の複雑なクロストークにGALPが関与している可能性を示唆した。現在,栄養状態の変化または肥満動物におけるGALP遺伝子発現の変化を検討している。
7.視床下部におけるSIRT1のエネルギー代謝制御機構の解明
北村忠弘,佐々木努(群馬大学生体調節研究所代謝シグナル解析分野)
箕越靖彦,志内哲也
【目的】SIRT1は,細胞内のエネルギー状態を反映するNADに依存して酵素活性を示す。SIRT1の肝・膵・骨格筋・脂肪でのエネルギー代謝制御への役割は知られているが,中枢神経系での役割は不明である。FoxO1は,全身のエネルギー代謝を反映するインスリンシグナルを媒介し,視床下部では摂食行動制御を担う。本研究ではSIRT1が視床下部において基質であるFoxO1を介してエネルギー代謝を制御している可能性を検証する。
【成果】共同研究の結果として,以下の点を確認した。
1) Sirt1は視床下部でAgrp及びPomc陽性ニューロンで発現している。
2) Sirt1の視床下部におけるタンパク量は,絶食後の再摂食で増加する。この変化はRNAレベルでは見られない。
3) Sirt1はユビキチン修飾を受け,プロテオソーム阻害剤存在下でタンパク量が増加する。
4) マウスの視床下部内側基底部へのSirt1発現ウイルスのmicro-injectionでは,コントロールウイルス注入群よりも体重増加傾向がみられる。なおこの変化は,酵素活性のないSirt1発現ウイルスでは見られない。また,Sirt1の強制発現は,核内滞留型Foxo1による摂食過剰・体重増加を有意に抑制する。
5) Sirt1は摂食促進性神経ペプチドをコードするAgrpプロモーターの活性を抑制し,AgRPの発現を抑制する。この効果にはSirt1酵素活性が必須である。また,核内滞留型Foxo1によって亢進したAgrpプロモーターの活性をSirt1は抑制する。なお,Sirt1はPomcプロモーター活性には影響を及ぼさない。
以上より,栄養素もしくは成長因子等の食事性の変化が視床下部に伝わり,その結果としてSirt1タンパク量が増加し,摂食促進性神経ペプチドAgRPの発現を抑制して,摂食の停止が起こるメカニズムが示唆された。
8.レプチン過剰発現トランスジェニックマウス(LepTg)やメタボリックシンドローム
病態を示す種々の遺伝子操作マウスにおけるOCT-1の発現解析
益崎裕章(京都大学大学院 医学研究科 内科学講座 内分泌代謝内科)
箕越靖彦
肥満に伴う二型糖尿病に汎用されてきた糖尿病治療薬,メトフォルミンの作用機構には不明点が少なくなかった。最近,organic cation transporter 1 (OCT-1) が主に肝臓におけるメトフォルミン輸送蛋白として機能する可能性が注目されているが病態における意義は明らかでない。本研究では申請者らが箕越教授との共同研究で取り組んできた脂肪細胞由来ホルモン,レプチンの作用が増強されている遺伝子操作マウスであるレプチン過剰発現トランスジェニックマウス (LepTg)(このモデルマウスにおける肝臓はグリコーゲン含量,脂質含量の著しい減少による重量の低下と優れたインスリン感受性を示すことが既に確認されている)および全身性脂肪萎縮性糖尿病のモデルであり,血中レプチン濃度が著しく低下し,結果として著明なインスリン抵抗性と顕著な異所性脂肪蓄積(肝臓,骨格筋,膵臓など)を伴うAZIP-F1トランスジェニクマウスの肝臓におけるOCT-1遺伝子発現レベルを解析した。OCT-1の遺伝子発現レベルは蛋白量やトランスポーター活性と概ね並行関係にあることが既に報告されている。LepTgにおけるOCT-1mRNA発現レベルは野生型対照に比べて減少傾向にあり,一方,AZIP-F1トランスジェニックマウス肝臓のOCT-1発現レベルは野生型対照に比べて明らかに増加していた。特に,肝臓における代謝表現型がミラーイメージにある両者の間でOCT-1遺伝子発現パターンが同様にミラーイメージを示したことからOCT-1は脂肪肝で増加する可能性が示唆され,メトフォルミンがインスリン抵抗性の強い肥満二型糖尿病において効果が大きいという従来の知見に矛盾しない結果と考えられた。次に,同一個人からダブルバイオプシーで得られた肝臓,皮下脂肪組織の検体を用いてヒトにおける意義を検討した(12例の糖尿病患者。京都大学医の倫理委員会承認を受けて実施)。その結果,ヒトにおけるOCT-1の発現レベルは脂肪組織に比較し,肝臓において圧倒的な高濃度を示した。肝臓における発現レベルと脂肪組織における発現レベルの間に相関性は認められなかった。肝臓におけるOCT-1発現レベルは検討した症例数の範囲内では肥満で増加するという明らかな傾向は認められなかったが,今後,さらに症例数を増やして見解を整理する必要があると考えている。
9.凍結割断法を用いた一次嗅覚路の解析
高見 茂(杏林大学保健学部)
脳由来神経栄養因子 (BDNF) の様々な作用機序の一つに,BDNFがシナプス後細胞膜に存在する受容体TrkBと結合することによる電位依存型Naチャネル,voltage-gated sodium channel 1.9 (Nav1.9),の開放およびシナプス後細胞の脱分極誘発が知られている。しかしながら,TrkBとNav1.9が同一細胞膜上に局在している事を示す,電子顕微鏡レベルでの所見は得られていなかった。我々は,ラット嗅細胞軸索膜近傍に脳由来神経栄養因子(BDNF) の膜受容体TrkBが局在している事を包埋後イムノゴールド法により明らかにした。また,光学顕微鏡レベルではあるが,Nav1.9の免疫反応性が嗅神経線維束に存在していることも示した。平成20年度における本共同研究は,Freeze-fracture replica immunolabeling (FRIL) 法を用いて,ラット一次嗅覚路におけるTrkB分子そしてNav1.9分子の分布を観察する事を目的とした。
灌流固定後の成獣Wisterラットより嗅細胞軸索を含む嗅球組織を摘出したのち,凍結割断およびその前処理,凍結割断,割断面へのカーボンおよびプラチナ蒸着を行い,SDS処理を施してレプリカ膜を作製した。これに,抗TrkBあるいは抗Nav1.9抗体,および嗅球投射ニューロン樹状突起糸球体分枝膜のマーカーである抗mGluR1抗体を用いたイムノゴールド法を行い,5 nmあるいは10 nm金粒子により抗原抗体結合部を可視化した。こののちレプリカ膜をグリッドに載せて透過電子顕微鏡 (TEM)観察を行ない,各抗体の免疫反応を示す金粒子の分布を調べた。
TrkB免疫反応は嗅細胞軸索やこれを束ねて包むolfactory ensheathing cell (OEC),嗅球糸球体内のmGluR1免疫陽性樹状突起にみられたが,膜内タンパク粒子 (IMP) に特異的に近接している像が得られなかった。一方,Nav1.9免疫反応はmGluR1の免疫反応がみられず形態学的にもOECであると同定できる細胞のIMPに近接しており,特にIMPが小さなクラスターを形成した部位に頻繁に観察された。
従って,一次嗅覚路に存在するOECの細胞膜上にはNav1.9が存在し,BDNFのシナプス後細胞脱分極誘導作用に関与している可能性が高い。今後は,OECの同定法を検索すると共に,TrkBおよびNav1.9のノックアウト動物を用いてコントロール実験を行うこと,さらにNav1.9がTrkBの近傍に存在しているのかどうかを調べることが必要であると考える。
10.運動学習記憶痕跡に関連するシナプス微小形態の変化
永雄総一((独)理化学研究所運動学習制御研究チーム)
マウスの水平性視機性眼球反応 (HOKR) の適応の先行研究の結果は,眼球運動の学習の獲得の原因が,小脳のシナプス伝達の長期抑圧であることを強く示唆する。しかしながら,運動学習の長期記憶は,小脳皮質内部ではなく,むしろその出力先の小脳核や前庭核のシナプスに保存されていることが,マウス,サルや猫を用いた前庭動眼反射の適応や,瞬き反射の古典的条件付けの実験結果から示唆されている。従って,小脳皮質の長期抑圧によって形成された運動学習の記憶痕跡が,学習が長期間に及ぶにつれて,小脳皮質から前庭(小脳)核に移動することになる。この記憶痕跡の移動のメカニズムを形態と薬理学的方法を用いて検討した。
小脳皮質のプルキンエ細胞と前庭核神経細胞との間に形成されるシナプスの構造の特徴を,光顕と電顕を用いて検討した。小脳皮質にレンチウイルスを用いてL7プロモーターを持続的に強制発現させ,前庭核内のプルキンエ細胞の軸索終末を標識した標本を観察すると,軸索終末の2/3は定説どおり,前庭核細胞の細胞体部と近位樹状突起に見られたが,残りの1/3は遠位樹状突起に見られた。さらに電顕で,遠位樹状突起の終末は、前庭核細胞と抑制性シナプスを形成していることを確認した。次に,前庭神経をビオチンで順行性に標識した標本を作製し,前庭神経-前庭核の興奮性シナプスと小脳皮質-前庭核の抑制性シナプスの分布を検討したが,興奮性シナプスと抑制性シナプスが遠位樹状突起上で,近接していることを光顕で観察した。現在この所見を,電顕を用いて確認している。今後は,興奮性シナプスと抑制性シナプスの空間的配置に,運動学習の長期記憶に関連する変化が生じるかを検討する予定である。
タンパク合成阻害剤を用いて,HOKRの運動学習の記憶の獲得と保持に,小脳皮質でのタンパク質合成が関与するかを検討した。運動記憶の獲得にはタンパク合成は関与しないが,保持には関与するという結果を得た。小脳皮質のタンパク合成が,前庭核のシナプスにどのように影響するか,今後検討する予定である。
11.シナプス後膜におけるグルタミン酸受容体のトラフィック制御機構
柚﨑通介(慶應義塾大学医学部)
記憶・学習を支えるシナプス可塑性の実体は,神経活動に基づくシナプス後膜におけるAMPA型グルタミン酸受容体の数の増減であることが,近年明らかとなってきた。本研究では,これまでの予備的実験結果を踏まえ,シナプス可塑性や学習が障害された2種類の遺伝子変異マウスを用いることにより,神経活動がどのようなバイオ分子によりセンスされ,どのようにしてAMPA受容体の数の制御に変換されて長期記憶を担うのかを明らかにすることを目指している。
小脳平行線維-プルキンエ細胞シナプスにおける,長期抑圧 (LTD) は運動学習の基礎過程と考えられている。シナプス前部を構成する平行線維が分泌するCbln1と,シナプス後部を構成するd2型グルタミン酸受容体は,ともに平行線維シナプスにおけるLTDを制御する。LTDの実体は,同シナプス後膜におけるAMPA受容体のエンドサイトーシスであると考えられているが,Cbln1やd2受容体がどのようにこの経路を制御するのかは明らかでない。平成20年度には,平成19年度に引き続き,急性小脳切片においてLTD誘導刺激によるAMPA受容体の数の変化をSDS-FRL法によって定量する方法の確立を進めた。また,Cbln1欠損マウスやd2受容体欠損マウスでは,定常状態においてAMPA受容体の数が増加していること,一方,Cbln1欠損マウスにおいてはd2受容体の数が低下していることを明らかにした(論文準備中)。このことはシナプス前部から分泌されるCbln1が,シナプス後部においてd2受容体の集積化とシグナル伝達系を駆動することによりAMPA受容体のエンドサイトーシスを制御している可能性を示唆している。神経活動によってどのようにCbln1-d2受容体シグナリングが制御されるのかを,引き続き電気生理学・分子生物学,そして生理学研究所脳形態解析研究部門におけるSDS-FRL法による解析によってさらに解明していく予定である。
12.GABAシグナリングにおける新奇分子PRIPの役割解明
兼松 隆,平田雅人(九州大学歯学研究院)
石橋 仁,鍋倉淳一(生理学研究所)
我々は,新規分子PRIP (PLC-related but catalytically inactive protein) のノックアウトマウスを用いた解析により,PRIPがGABAA受容体シグナリングに関与している事を明らかにした。GABAA受容体シグナリングの可塑性制御の一つとして,細胞膜上での受容体数の調節が考えられる。我々は,これまでにPRIPによるGABAA受容体シグナリング制御の分子基盤として,PRIPがGABAA受容体bサブユニットの脱リン酸化調節を介して,GABAA受容体のエンドサイトーシスを制御していることを明らかにした。一方,PRIPがGABAA受容体のリン酸化を介した細胞膜へのインサーションに関与しているかどうかは明らかでない。そこで,この現象におけるPRIPの関与について検討を行った。脳スライスを用いた電気生理学的な解析において,野生型マウスではインスリンによるGABA誘導性電流の増加がみられた。一方,PRIP1,2ノックアウト (DKO) マウスではこの様な増加は全く見られなかった。インスリンによるGABA誘導性電流の増加にはAktを介したGABAA受容体bサブユニットのリン酸化が密接に関与していることが報告されている。そこで初代神経培養細胞を用いて,GABAA受容体bサブユニットのリン酸化を調べたところ,野生型ではインスリン刺激によってリン酸化の増加が認められたのに対し,DKOでは増加が認められなかった。また,インスリン・シグナルの素過程に対するPRIPの影響を検討したが,野生型およびDKOで大きな違いは認められなかった。次に,マウス脳抽出液および培養細胞再構成系を用いて,GABAA受容体,PRIPおよびAktの複合体形成について検討を行ったところ,インスリン刺激存在下で,活性化AktがPRIP,GABAA受容体と三者複合体を形成するが明らかとなった。この複合体形成が,GABAA受容体の細胞膜へのインサーションに重要かどうかを検討するために,PRIP-GABAA受容体結合阻害ペプチドを電気生理学的解析に導入したところ,インスリンによるGABA誘導性電流の増加が減弱した。これらの結果から,PRIPがインスリン刺激によって惹起される活性化Akt,GABAA受容体の三者複合体形成を介して,GABAA受容体のリン酸化,細胞膜へのインサーションを制御していることが明らかとなった。
13.多光子顕微鏡を用いた嗅覚障害とその回復時における
ニューロンのターンオーバーの可視化解析
鍋倉淳一(生理学研究所 生体恒常機能発達機構研究部門)
澤本和延,金子奈穂子,加藤康子,澤田雅人
(名古屋市立大学大学院医学研究科再生医学分野)
成体哺乳類の脳室下帯 (SVZ) では生涯にわたってニューロン新生が行われており,SVZで産生されたニューロブラストは吻側移動経路 (RMS) を経由し,嗅球へ向かって高速で移動する。SVZから嗅球に到達したニューロブラストは介在ニューロンである顆粒細胞または傍糸球細胞へと分化・成熟して既存の神経回路へと組み込まれる(図1)。
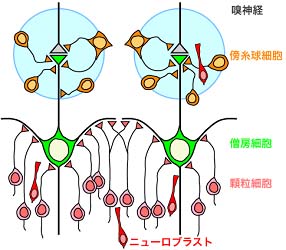
図1:嗅球の構造 嗅球は外界の匂い情報が直接中枢神経系に入力する領域である。嗅神経は嗅球表層の糸球体で僧房細胞とシナプスを形成し,匂い情報を嗅皮質へと伝達するが,傍糸球細胞は嗅神経及び僧房細胞に対して抑制性のシナプスを形成する(図1)。一方で顆粒細胞は嗅球深部で僧房細胞に対して抑制性のシナプスを形成する。匂い情報を直接伝達する僧房細胞が決して入れ替わらず安定であるのに対して,その周囲で抑制性の制御を行う傍糸球細胞及び顆粒細胞がニューロン新生により常に入れ替わっていることから,嗅覚の可塑性はこれら介在ニューロンのターンオーバーに依存しているのではないかと考えられている。実際に,新生ニューロンの生存や分化は嗅覚入力の遮断に影響を受けることが分かっているが,入力の変化によって嗅球介在ニューロンのターンオーバーがどのように変化するかは分かっていない。 そこで,生理学研究所生体恒常機能発達機構研究部門及び名古屋市立大学大学院医学研究科再生医学分野の共同研究により,入力障害及び回復過程での嗅球ニューロンのターンオーバーの変化を,多光子励起法を用いて同一個体で経時的かつ詳細に解析し,嗅覚障害とその回復におけるニューロン新生の役割を解明することを目的とした。 現在までに,可逆的嗅覚障害モデルとして,脱着可能な外鼻孔閉塞プラグ挿入術(図2)を確立した。 |
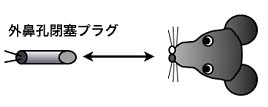
図2:可逆的嗅覚障害モデル
さらに,傍糸球細胞の殆どが蛍光標識される遺伝子改変マウス(VGAT:Venusマウス及びGAD67:EGFPマウス)を用いて,2ヶ月以上の同一個体での嗅球生体観察法を確立し,生理的条件下における傍糸球細胞のターンオーバーを解析した。嗅覚障害の回復過程の解析は,同一個体を用いた生体観察法を用いなければなし得ないものであり,現在データ取得中である。 |
14.歯髄幹細胞を用いた血管新生・歯髄再生
鍋倉淳一(自然科学研究機構生理学研究所生体恒常機能発達機構)
中島美砂子,庵原耕一郎(国立長寿医療センター 研究所口腔疾患研究部)
私共は以前より,歯の延命化を目指した,歯髄幹細胞を用いた歯髄再生治療法の開発を行ってきた。歯髄再生においてはまず,血管新生を促進する必要がある。私共は,ブタ歯髄組織より幹細胞を多く含む細胞画分としてside population (SP) 細胞を分取した。この細胞の一部は血管周囲に局在性がみられた。よって,今回,血管内皮前駆細胞および血管内皮細胞のマーカー,CD31およびCD146を用いて,歯髄SP細胞をさらに分取し,その細胞の特徴化ならびに血管新生能,歯髄再生能を検討した。
ブタ歯髄SP細胞には,CD31-; CD146-が50%, CD31+; CD146-が48%, CD31+; CD146+が2%の割合で含まれていた。CD31-; CD146-SP細胞はCD11b, CD14は陰性であり,CD34およびVEGFR2/Flk1の発現率は高く,CD133は陰性であり,よって,骨髄由来のangioblastあるいは血管内皮前駆細胞に類似しているが同一ではなく,monocyte /macrophage,造血系ではないことが明らかとなった。
増殖能に関しては,CD31-はCD31+に比べ,高い増殖能を有し,遊走能を有していた。またCD31-SP細胞は脂肪,軟骨,神経,象牙芽細胞などへの多分化能を有していた。Matrigel上で血管誘導を行うとCD31-SP細胞は24時間後には管状構造を呈した。
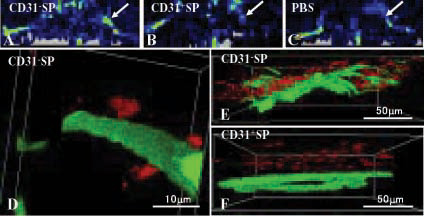
次に,マウス下肢虚血モデルを用いて血管新生能を検討した。7日後,CD31-SP細胞移植(図A)ではCD31+SP移植(図B)やPBS(図C)に比べて,有意に血流の回復が見られ,血管新生も顕著にみられた。三次元共焦点レーザー顕微鏡 (FLUO VIEW FV1000) およびMETAMORPH,IMARISにて画像解析すると,移植したCD31-SP細胞は新生血管周囲に定着しているが,血管内皮細胞に組み込まれておらず(図D,E),CD31+SP細胞は血管から離れて存在していた(図F)。In vitroでは,CD31-SP細胞の培養上清は血管内皮細胞に対して,増殖促進,アポトーシス抑制作用がみられた。移植したCD31-SP細胞は下肢虚血部の新生血管周囲において,前血管誘導因子を発現していた。よって,CD31-SP細胞を下肢虚血部に移植すると,前血管誘導因子を分泌して血管内皮細胞にパラクリン的に働く可能性が示唆された。
ついで,イヌ歯髄切断面上にCD31-SP細胞を自家移植すると,細胞は切断面下の創傷部の新生血管周囲に遊走・集積し,種々の前血管誘導因子を発現し,血管新生,歯髄再生を促進した。
以上のことから,CD31-SP細胞は歯髄再生の細胞源として有効である可能性が示唆された。
15.トランスジェニック動物作製への凍結乾燥精子の利用
保地眞一(信州大学繊維学部・生物機能科学課程)
平林真澄
ラット精子を凍結乾燥(FD)する際,一次圧を0.37hPa,二次圧を0.001hPaに制御し,それぞれ14時間と3時間,真空乾燥させる。このFD精子を1年間の冷蔵保存後に顕微授精 (ICSI)して産子を得たが,発生率を見る限り完全な凍結乾燥条件が設定されているとは言い難かった。本研究の最終目的は外来遺伝子溶液の存在下で凍結乾燥した精子をICSIによる遺伝子導入に利用することだが,本実験ではまず,FDラット精子のICSI後の機能的正常性を(1)カルシウムオシレーションの誘起頻度,(2) 前核形成・二分割・桑実胚/胚盤胞への発生,を指標にして調べることでFD諸条件の整備を図ろうとした。
[Ca2+]i に反復性の上昇が認められた卵子の割合は84~100%だった。このうち10~20分間隔で起こる正常オシレーションパターン(パルス頻度2~5回/時間)は対照区のみで79%と高く,乾燥用バッファでの凍結保存区,FD/冷蔵保存区,FD/液体窒素保存区の3試験区では時間当たりのパルス頻度が6回以上だったものが43~72%を占めた。次にICSI後6時間経過した卵子の前核形成率を調べたところ,いずれの試験区でも79~90%と高く,これらの正常受精卵が二分割した割合も試験区に関わらず75~92%と高かった。しかし桑実胚/胚盤胞への発生率を見ると,対照区の39%と比較してバッファ感作区とFD/液体窒素保存区ではおよそ1/2に,FD/冷蔵保存区では1/4以下に低下した。今後,バッファ組成の見直しから始め,凍結条件の再検討,そして乾燥プログラムの最適化へと道をつけていく。
16.SERCA2a遺伝子を導入したトランスジェニックラットの作製
高木 都(奈良県立医科大学医学部医学科)
平林真澄
心筋細胞内のCa2+ハンドリングに重要な役割を果たすSERCA2a遺伝子を過剰発現させたトランスジェニック (Tg) ラットを作製し,心筋細胞の興奮収縮連関におけるSERCA2aの役割を解析することを目的とする。
CMV-MLC2v-SERCA2a-SV40polyA (8.0kb) 融合遺伝子をラットの前核期受精卵に顕微注入し,生まれた産仔のうち遺伝子導入が確認されたトランスジェニック個体を繁殖させる。次に,産仔の尾部組織から抽出したDNAはprimer(MLCSERとSER5)を使ってPCRによって分析する。これまでに,合計622個の顕微注入卵をレシピエントラットに移植することにより,合計で90匹の産仔が得られた。PCR解析により遺伝子導入が確認されたTg個体は,合計で2匹(いずれも♀)であった。これら2匹のTg♀ラットとWT♂との交配により,それぞれのG1産仔,合計で23匹(計2産分)を作製し,PCR解析を行ったが,いずれのTg♀からもSERCA2a遺伝子を持つ産仔は得られなかった。この結果から,このTg♀2匹はいずれもSERCA2a遺伝子がモザイク状態で導入され,生殖系への寄与が極めて低いあるいは無いことが考えられる。
現在,新たに226個のDNA注入卵を移植した8匹のレシピエントラットを奈良県立医科大学へ搬入し,出産待ちの状況である。産仔離乳後,PCR解析によりTgラットを選別し,G1個体およびG2ホモ個体を作製する。Tgホモ個体の摘出心臓を対象に,我々独自の心力学的・エネルギー学的解析を行う予定である。
17.CNR/プロトカドヘリン遺伝子ジーンターゲティングマウスの作製と機能解析
八木 健,平林敬浩(大阪大学大学院・生命機能研究科)
平林真澄,冨田江一,三宝 誠,山内奈央子
脳神経系は個性を持った神経細胞が神経回路を形成し組織化されることでシステムとして機能を生み出している。しかし,この脳神経系における神経細胞の多様化と組織化をもたらす分子メカニズムについては十分に明らかになっていない。
CNR/プロトカドヘリン分子群はa1~a12, c1, c2と呼ばれる14種類のアイソフォームで構成される多様化膜分子群であり,その遺伝子構造は各分子種ごとに異なる多様化した14個の縦列した可変領域エクソンと共通にスプライシングされる3つのエクソンからなる共通領域エクソンで構成され,各アイソフォームはひとつの可変領域エクソンと共通領域エクソンがスプライシングされ発現している。これらのアイソフォームは個々の神経細胞で差次的発現をすることが知られていることから,CNR/プロトカドヘリン分子群は神経回路形成やシナプス形成の際に神経細胞の個性をもたらす分子群であることが示唆されている。そこで本研究ではCNR/プロトカドヘリン分子群の特徴である分子的多様性や個々の神経細胞での差次的発現は脳システム構築においてどのような生理学的意義があるのかを明らかにするために,CNR/プロトカドヘリン遺伝子に多様化をもたらす可変領域エクソンの数を変換した種々の遺伝子改変マウスを作製し,解析を行った。その結果,CNR/プロトカドヘリン分子群の可変領域エクソンを1つにして,分子的多様性を無くした遺伝子改変マウスでのCNR/プロトカドヘリン分子群mRNA発現量をreal-time PCRで定量したところ,同マウスでは1つだけ残存している可変領域エクソン由来のa1分子種の発現量は増加し,またその量は野生型マウスが発現している全CNR/プロトカドヘリン分子群mRNA発現量と有意差はなかった。一方,可変領域エクソン数を27に増加した遺伝子改変マウスでも全CNR/プロトカドヘリン分子群mRNA発現量は野生型マウスと差はなかった。同様な結果は他の可変領域数変換マウスでも得られていることから,CNR/プロトカドヘリン分子群には常に発現量を一定に保つ機構が存在すると考えられる。
18.ラット精子幹細胞を用いた顕微授精
篠原隆司(京都大学大学院医学研究科・遺伝医学講座分子遺伝学分野)
平林真澄
昨年までに,1) ラット精子幹細胞(Germline Stem, GS細胞)の樹立,2) 試験管内での遺伝子導入 (Biol Reprod 79, 1121-1128 (2008)),3) 顕微授精による産仔作製 (Proc. Natl. Acad. Sci. USA 103, 13624-13628 (2006)) の3つのステップにつき技術的な基盤を確立することに成功した。現在とくに問題になっているのは,このうち,2) のGS細胞への遺伝子導入とその後の薬剤選択の部分であり,効率よくノックアウト(KO)細胞を得るためには改善が必須である。本年度は,この問題を解決するために以下の対策を講じた。
1) 新規ラット精子幹細胞の樹立
SDラット以外の系統由来の細胞株樹立を行い,その遺伝子導入と薬剤選択の効率の比較を試みた。具体的にはVenus遺伝子を導入したWistarラットからのGS細胞の樹立,さらにSDおよびWistarラットと交配して生じたF1からのGS細胞株の樹立を行った。現在までに,Donryu, Long-Evans, Brown Norway系統へのバッククロス,およびそのF1からのGS細胞樹立に成功した。
2) 新規KOトラット作製のためのベクター作製
相同組換え法によるKOラットの作製には,プラスミドベクターによる遺伝子導入および薬剤選択法を確立する必要がある。これまでに,マウスES細胞のKO作製に汎用されているphosphoglyserokinase-1 (pgk-1) 遺伝子プロモーターを利用し,薬剤選択を試みてきたが,この遺伝子コンストラクトでは薬剤選択によるstable transfectantの樹立効率が107個に1個以下と非常に悪かった。実際にこのpgk-1の発現をマウスGS細胞と比較したところ,ラットではほとんど発現していない(10%以下)ことが明らかになった。このために低濃度の薬剤を添加することでもGS細胞の選択が困難になることが予想される。この問題を解決するために,プロモータートラップ型のKOベクターの構築に着手した。
3) 顕微授精の改善
Wsitarラット由来GS細胞から発生した精子をSDラット卵子に顕微授精したところ,SDラット由来GS細胞の場合より10倍 (2% vs. 20%) の産仔作製効率の改善が見られた。Wsitarラットを用いることで,より確実に高率でGS細胞からの産仔獲得ができることが分かった。
19.光学顕微鏡標本における抗酸菌Ziehl-Neelsen染色の機序に関する
位相差低温電子顕微鏡を用いた検討
山田博之(財団法人結核予防会結核研究所)
新田浩二(テラベース株式会社)
Radostin Danev,飯島寛文,永山國昭
抗酸菌属は結核菌やらい菌など100種を超える菌から構成され,その特徴は抗酸菌染色の過程で酸による脱色に耐えて,フクシンによる染色が維持されることである。しかし,結核菌でも培養条件(低酸素,薬剤存在下)により抗酸性の低下が起こり,抗酸性自体の機序は明らかではない。
位相差低温電子顕微鏡は,無染色のサンプルの位相差を用いて高コントラストの電顕像を提供し,生きた状態に近い生物試料の観察に有用である。また,病理組織学的観察で用いられる光学顕微鏡用の染色を施したサンプルを電子染色することなく観察した際に,位相差低温電子顕微鏡で光顕染色部位が高いコントラストを持った像として得られ,光顕染色像との相関,染色部位である細胞構成要素を特定できる可能性が示唆されている。
今回,光学顕微鏡用の抗酸菌染色(Ziehl-Neelsen染色)を施した結核菌あるいはその類縁の抗酸菌を位相差低温電子顕微鏡で観察し,無染色の菌,抗酸菌続以外の非抗酸性菌との比較,更に,抗酸性の基礎をなす塩酸アルコールによる脱色処理の有無により菌体内の染色領域およびその菌体構成成分の特定,菌体の構造変化の検討を試みる。また,抗酸性が低下した菌,あるいは元来抗酸性を示さない菌の微細構造を比較検討する。将来的には抗酸性と菌の毒力の関連の関連を検討する。
現段階ですべての条件の試料の観察が終わっていないが,非抗酸性菌と抗酸菌で染色後の菌のコントラストに差があるかどうか検討中である。
20.MEND法による抗体Qドット、アビジンナノゴールドの高効率取り込み
‐ナノ微粒子の質量顕微鏡法への応用‐
瀬藤光利,早坂孝宏,井上菜穂子(浜松医科大学)
永山國昭
我々は,細胞内へ取り込み可能な直径2.6nmの葉酸及びcoumarin修飾機能性ナノ微粒子の開発を行ってきた。今年度は,matrix-assisted laser desorption/ionization(MALDI法)による質量分析で利用するマトリックスの代替物質として,このナノ微粒子を利用することで,マトリックスでは検出が困難であった生体分子の検出と,質量顕微鏡法による生体分子の分布画像の高解像度化を目指した。ナノ微粒子は質量顕微鏡法に用いることを考慮し,末端にヒドロキシル基とアミノ基を配位するよう設計することによりイオン化の促進を図った。その配位をFT-IRによって確認し,形態および直径については電子顕微鏡で観察することによって確認した。その直径は約3.7±0.1nmであることが明らかになった。マウス脳組織から作成した凍結切片上へ均一にナノ微粒子を噴霧し,その表面に対してレーザーを二次元走査した。その結果,様々な生体分子がイオン化された。特に既存のマトリックス(DHB:2, 5-dihydroxybenzoicacid)では検出できなかった低分子領域においてもシグナルの検出が可能であることを見出した。検出された数千にも及ぶシグナルのうち2つのシグナルについて多段階質量分析により解析した結果,phosphatidylcholine(1-alk 38:3)およびgalactosylceramide (C24h:0)として同定することが出来た。さらに,それらの生体分子の分布画像は,既存のマトリックスにより取得された画像よりも高解像度であることが明らかになった。以上の検討によりナノ微粒子は,その表面修飾を変化させることにより細胞内への取り込み解析のみならず,質量顕微鏡法での生体分子の分布解析に利用可能な機能性を持ち合わせることが明らかになった。本研究成果は,Analytical Chemistry誌へ報告した(Taira et al, 2008, 80(15), 4761-4766)。
21.シリコンベース膜蛋白バイオセンサー製作のための
タンパク質発現・精製・集積技術開発
宇理須恒雄,手老龍吾(分子科学研究所)
内海裕一(兵庫県立大学)
柴崎貢志,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
分子科学・材料科学分野のシリコン表面ナノ制御技術およびアレイ構造形成技術と生命科学分野の膜タンパク発現・精製技術とを融合し,新たにシリコン基板上への膜タンパク/脂質二重膜の集積技術を開発するとともに,これを発展させてシリコン電子集積回路と統合した新規バイオ分子センサーを開発させること目指した。さらに,神経細胞機能解析素子,など新たな膜タンパク電気生理特性の新規計測法や,生体分子情報系の新しい分子科学の開拓を進めた。プレーナー型イオンチャンネルバイオセンサーはピペットパッチクランプの弱点である,多点計測,長時間計測,測定に熟練が必要,などの問題を解決するイオンチャンネル電流計測法として提案され市販品もでているが,センサーとしての細胞の寿命が短いため培養を必要とする神経細胞に適用できないという問題があった。この問題を解決するため,あらたに培養型のプレーナーイオンチャンネルバイオセンサーを提案し開発に成功した。この新センサーはしかし,まだ微細貫通孔への細胞のポシショニングが容易ではないという問題があった。そこで,この問題を解決するためにマイクロコンタクトプリンテイング技術を開発し,細胞外マトリックス蛋白質分子を所定のパタン形状でセンサー基板上に印刷し,これにより細胞を微細貫通孔の位置に確実に誘導することに成功した。さらに,この状態でのホールセルモードのイオンチャンネル電流計測におけるノイズ特性を解明した。
22.TRPチャネルファミリーの味覚受容および情報伝達における役割について
二ノ宮裕三,重村憲徳,吉田竜介,村田芳博(九州大学大学院歯学研究院)
富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
味覚センサーあるいはそのモジュレータとしてさまざまなTRPチャネルが関与する可能性が示唆されている。しかし,その詳細については多くがまだ不明のままである。種々のTRPチャネルファミリーのリガンド応答性について,マウスの味細胞および味神経と培養細胞発現系用いて解析し,TRPチャネルの味覚受容・情報伝達における役割を検索することを目指した。野生型および関連遺伝子改変マウスを用いて,茸状乳頭味蕾単一味細胞およびその支配神経である鼓索神経,さらには舌咽,迷走神経の各種味物質に対する応答を記録した。酸に対して,on応答のみならずoff応答(神経の発火)が観察された。
HEK293細胞にPKD2L1/PKD1L3複合体を強制発現させて,pH3.0以下の酸刺激に対する膜電流応答を観察して,pH・電流曲線を作成したところ,約pH2.8以下で活性化し,ほんの少しのpH上昇で電流の急激が減弱が起こることが観察された。温度依存性を検討したが,PKD2L1/PKD1L3複合体チャネル電流は温度の影響を受けなかった。阻害物質の探索を行い,クロライドチャネル阻害薬として知られるNPPBがPKD2L1/PKD1L3複合体チャネル電流を抑制することが明らかとなった。HEK293細胞で見られたPKD2L1/PKD1L3複合体チャネルのoff応答を味細胞でも確認すべく,マウス有郭乳頭からの味細胞単離を試みた。
23.運動時の呼吸・循環応答と遅発性筋痛に関わる受容器における
TRPV1とTRPA1の役割
水村和枝,片野坂公明,田口 徹,堀田典生,妹尾詩織(名古屋大学環境医学研究所)
曽我部隆彰,柴崎貢志,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
現在までに明らかになっている9つの温度感受性TRPチャネルのうち2つ,TRPV1とTRPA1は無髄のC線維特異的に発現して,侵害刺激受容に関わることが明らかになっている。しかし,それら侵害刺激受容体の運動時の呼吸・循環促進と遅発性筋痛への関与は不明である。筋細径線維受容器は運動時の呼吸・循環促進と疼痛に関わっているが,受容器タイプの異同をそれらの反応が変化した動物モデル(新生時期カプサイシン処理ラット,心不全ラット)を用いて明らかにすることを目的とし,また,それら受容器の反応におけるTRPV1とTRPA1の役割も解明を試みた。筋肉炎症時にはブラジキニンが産生されて炎症時痛の発生に関わると考えられている。ブラジキニン (100 pmol/site) をマウス足底に投与して起こる疼痛関連行動は野生型マウスに比べてTRPV1欠損マウスで減弱していたが,高濃度 (1 nmol/site) では野生型マウスとTRPV1欠損マウスで差が見られなかった。ブラジキニンによるC線維の発火は両遺伝子型で差がなかった。ブラジキニンはTRPV1欠損マウスの後根神経節細胞で明らかな細胞内Ca2+濃度上昇を引き起こした。ブラジキニンはTRPA1を間接的に活性化すると報告されているが,ブラジキニン感受性のある感覚神経細胞にTRPA1刺激剤であるマスタードオイルに反応しないものが見られた。これらのことから,ブラジキニンによる侵害刺激受容応答には,TRPV1, TRPA1以外の複数のイオンメカニズムが関わっているものと推察された。
24.2光子FRET顕微鏡を用いた複数機能を同時可視化する手法の開発と
細胞死の分子メカニズムの解明
永井健治,友杉 亘(北海道大学電子科学研究所)
根本知己(生理学研究所・多光子顕微鏡室)
【目的】アポトーシス(プログラム細胞死)は個体がその恒常性を維持するための最も重要な生理現象の一つである。例えば,癌化した細胞の除去や,個体発生における形態形成の原動力,或いは,免疫系の自己抗原に反応する細胞の除去など,様々な生理現象においてアポトーシスは重要な役割を果たしている。本研究はアポトーシス過程におけるCa2+シグナリングとカスパーゼ,それに細胞骨格ネットワークの3者を2光子FRET法により同一細胞内で観察する系を樹立し,アポトーシス誘導の分子ネットワークをシステム的観点から解明する。
【実験内容】我々が開発した世界で最も波長が短い蛍光を発する群青色蛍光タンパク質Siriusは360nmに極大吸収を持ち,420nmに極大蛍光を有する。また,Siriusはシアン蛍光タンパク質 (CFP) と組み合わせることで,効率の良いFRETが生じることを確認済みである。また,GFP変異体SapphireとSiriusは,UV或いは700nm程度の2光子で同時に励起することが可能であることが分かった。こうした知見を踏まえて,SiriusとCFPのFRETペアーに加え,SapphireとDsRedのFRETペアーを併用することで,1波長励起4波長測光によるDual FRETを試みた。
【成果】HeLa細胞のアポトーシス過程におけるCa2+動態とカスパーゼ-3の活性化を同時に可視化することに成功した。
25.2光子レーザー顕微鏡による免疫細胞動態の解析
木梨達雄,片桐晃子,片貝智哉(関西医科大学)
根本知己(生理学研究所・多光子顕微鏡室)
稲田浩之(生理学研究所・生体恒常機能発達機構研究部門)
【目的】Tリンパ球は高内皮細静脈から末梢リンパ節に移行し,リンパ組織内を移動し,抗原提示細胞と一過性に接着し,異物抗原を探索する。Tリンパ球はin vitroではmotilityが低いが,Rap1が活性化するとそのエフェクター分子RAPLによって細胞極性形成とLFA-1を介する接着が誘導され,細胞移動が亢進する。近年,2光子レーザー顕微鏡によって生体内リンパ組織深部の観察が可能になり,Tリンパ球はリンパ節皮膜から100-300mmの深部で活発にrandom-walk用に移動している様子が報告された。しかし,2光子レーザー顕微鏡によるリンパ節内観察は技術的に用意ではなく,特にイメージングに適したリンパ節の安定した固定と温度管理が必要である。本研究では,成体マウスへの侵襲が少ない膝下リンパ節を2光子レーザー顕微鏡によって観察する系を樹立し,Tリンパ球組織内移動にRAPLが関与するかどうかを調べる。
【実験内容】RAPL欠損Tリンパ球,およびlittermate controlマウス由来Tリンパ球をCFSEとCMTMRでラベル後,正常マウス(C57/BL6,8週齢♀)に静注する。24時間後,膝下リンパ節をmicrosurgeryによって麻酔下に露出した後,独自に考案した温度コントロール付き肢固定装置にマウスを置き,固定する。温度を38度に保持しながらオリンパス社製正立型FV1000/Ti:sapphire laser (810nmにセット),20倍レンズ (NA 0.95) で3D time-lapse (3mm z-section, 30s interval) 観察する。CFSEは480-550nm, CMTMRは590-685nmの範囲で検出する。timelapse画像をVolocity (Improvision) によってautomatic trackingし,速度,移動距離,trajectory mapを作成する。
【成果】膝下リンパ節は,膝下静脈分岐部直下に位置し,microsurgeryによって血管,リンパ管を避けて露出した。皮膜から100-250mmの深部において移入したTリンパ球が明瞭に観察された。30分間の観察によって取得した画像を解析し,ラベルされたリンパ球の動態を調べた。その結果,コントロールTリンパ球は平均15mm/min移動速度でrandomに動く様子が観察できた。同時に移入したRAPL欠損Tリンパ球の移動速度は平均7mm/minで約半分に低下していた。したがって,RAPLはリンパ球の活発な組織内移動に必須の分子であることが明らかになった。
26.ハイブリッド顕微鏡用環境制御セルの開発
箕田弘喜(東京農工大学工学部)
飯島寛文,永山國昭
我々は,これまで環境制御型透過電子顕微鏡を用いて,活きたミオシン分子のATP誘起の構造変化の過程を記録する研究を進めてきた。この方法では,浸水状態の試料を準備して,電子顕微鏡内にそのまま持ち込むことで生体活性を保持したままの生体試料の観察を実現することができる。従来の我々の実験方法では,ミオシン頭部にサイト選択的に抗体を反応させて金コロイド粒子を取り付け,ATP投与前後で金コロイド粒子の位置の変化を調べることで,ミオシンの頭部の変化を調べる方法をとってきた。しかしながらこの方法では,金粒子の位置を通してミオシン分子の運動を調べるという間接的な観察を行っていることから,生体高分子の動きを直接観察することを目指して我々の環境制御型電子顕微鏡に位相差電子顕微鏡法を組み合わせた手法を開発することを目指して,永山教授と共同研究を開始した。2つの手法の組み合わせを実現するために,我々にとって,未経験の位相差電子顕微鏡法により,現在観察しているミオシン分子がどの程度のコントラストで観察することができるのかについて検討を行った。
位相差顕微鏡法は,電子の干渉性を利用した観察手法であるのに対して,環境制御型電子顕微鏡法を用いた活きたミオシン分子の観察においては,液体中の試料の観察を行う必要があるため,入射電子の干渉性を低下させてしまう。干渉性の低下は試料コントラストの低下を招くため,干渉性の低下を極力抑制した条件での試料観察が可能な試料ホルダーを開発する必要がある。本共同研究はその試料ホルダー設計のための条件確認という予備実験としての意味合いも持っている。
ミオシン分子,およびその分子を重合して作製したミオシンフィラメントを位相差電子顕微鏡法で,室温および低温条件で観察した結果,いずれの条件でも高いコントラストでの観察が実現できることを確認でき,環境制御型電子顕微鏡法と組み合わせてミオシン分子を直接観察する見通しが立った。また,観察結果から,試料ホルダーのデザインを決定するのに必要な情報が得られた。H21年度は引き続き共同研究を進め,H20年度に得られた知見を元に試料ホルダーを作製し,環境制御条件での位相差顕微鏡法観察による生体分子の直接観察を行いたい。
27.慢性疼痛モデル動物における大脳皮質体性感覚野ニューロンの可塑性
-電気生理学的解析と2光子励起を用いた形態学的研究の融合-
吉村 恵,古江秀昌(九州大学医学研究院統合生理学)
慢性炎症モデルラット皮膚への機械的刺激によって大脳皮質体性感覚野第IV/V層の錐体細胞に如何なる応答が得られるかを調べた。正常ラットでも無刺激で自発性の活動電位が観察されたが,慢性炎症ラットでは発火の頻度が有意に増大していた。次に,後肢足底への機械的侵害刺激と非侵害刺激によって誘起されるシナプス応答と活動電位の頻度を検討した。その結果,正常ラットでは非侵害性刺激によっては有意なEPSPの頻度や活動電位の増加は見られなかったが,侵害性刺激によってEPSPの頻度と振幅の増大が観察された。一方,慢性炎症ラットでは非侵害性の刺激によってもEPSPの頻度と振幅の増大が観察され,EPSPの一部は活動電位を誘起した。次に侵害性の刺激によって誘起される応答について検討を行った。その結果,正常ラットと比較して多くの細胞で活動電位が誘起され,またその発火頻度が増大していた。興味あることに一部の細胞で侵害刺激によって膜の脱分極が見られた。この変化は正常ラットでは観察されなかったことから大脳皮質における何らかの可塑的な変化を示すものと考えられた。そこで2光子励起顕微鏡を用い,皮膚への生理的感覚刺激に対する皮質ニューロンのCa2+濃度変化を炎症モデルおよび正常動物で比較検討した。先ず,大脳皮質第一次体性感覚野からのin vivoパッチクランプ法を用いてカルシウム感受性色素を注入し,2光子励起顕微鏡を用いて体性感覚野ニューロンのCa2+濃度変化を記録した。炎症モデル動物では後肢のピンチ刺激に対してCa2+濃度が上昇し,その応答は刺激の間持続した。また,後肢に受容野を持つ多くの錐体細胞がCa2+応答を示したが,正常ラットではピンチ刺激に対してCa2+濃度を一過性に上昇させるニューロンが存在したが,その数は炎症ラットと比較して少数であった。以上より,大脳皮質では痛み刺激に応答する細胞が少ないと考えられてきたが,本研究により少なくとも錐体細胞の一部は痛み刺激に応答する細胞が炎症モデルで増加する事が示された。モデル動物でみられた応答,特に振幅の大きな脱分極や持続時間の長いCa2+濃度の上昇は脊髄における変化をそのまま反映しているのではなく,大脳皮質内の神経回路の可塑的変化によって起こるものと考えられるが,今後この点について更なる詳細な解析を行う事が必要である。
28.2光子顕微鏡による新奇分子を介した開口放出制御の解明研究
兼松 隆(九州大学 大学院歯学研究院 口腔細胞工学)
(現:広島大学 大学院医歯薬学総合研究科 歯科薬理学)
根本知己(生理学研究所・多光子顕微鏡室)
【目的】イノシトール三リン酸結合性分子(PRIP)の機能解明研究を進める中,PRIPノックアウト(KO)マウスの表現型の一つとして,このマウスが高インスリン血症を示すことを認めた。そこで,その原因を明らかにするために,2光子顕微鏡を用いて膵臓b 細胞のインスリン開口放出の可視化解析を行い,PRIP分子を介したインスリン開口放出機構の分子基盤を明らかにする。
【実験内容】野生型およびPRIP KOマウスの膵臓からランゲルハンス島を単離培養し,2光子顕微鏡イメージングによりインスリンの開口放出を可視化し,高グルコース刺激を行った時のインスリン顆粒の単一の融合細孔形成と同時に細胞内Ca2+濃度を定量した。
【結果】野生型およびPRIP KOマウスの膵b細胞において,高グルコース刺激時のCa2+濃度変化には,有意な差は認めなかった。この事は,インスリン開口放出過程におけるグルコース取り込みからCa2+流入までの素過程に,遺伝子欠損の差異は認められないことを意味する。しかしながら,PRIP KOマウスの膵b細胞で,高グルコース刺激におけるインスリン開口放出の頻度が,ある相で明らかに亢進していた。この結果は,単離培養したランゲルハンス島を用いた生化学的解析 (perfusion assay) 結果と良く一致していた。PRIP分子は,タンパク質脱リン酸化酵素と複合体を形成している。そこで,PRIPを介するインスリン開口放出過程に,タンパク質のリン酸化/脱リン酸化反応が関与するか,膵b細胞をホルスコリンで刺激をして調べた。その結果,野生型とPRIP KOマウスでその反応性に違いがあることが明らかとなった。
29.黒質網様部GABA作動性ニューロンの代謝依存的活動調節機構
山田勝也(弘前大学医学部)
柴崎貢志,富永真琴(生理学研究所・岡崎統合バイオサイエンスセンター)
現在までに黒質網様部 (SNr) が脳内エネルギー基質の低下を感知し,運動制御に結びつける代謝センサー器官として機能する可能性を見いだしている。SNrは高頻度の自発発火を営むGABA作動性ニューロンから構成され,隣接する緻密部からはドーパミンニューロンの樹状突起が侵入しドーパミンを樹状突起放出しているがその作用機序には不明の点が多い。そこで,バイオセンサー法を用い,ドーパミンがアストロサイトのグリシントランスポーターを介してSNrニューロンの自発発火活動を制御する可能性について検討した。多くのアストロサイトにはドーパミン受容体が発現しており,またSNrにおいてアストロサイト代謝の選択的阻害は代謝依存性グリシントランスポーターGlyT1を介して細胞外グリシン濃度を変化させると報告されている。一方,成熟SNrニューロンの発火がグリシンにより直接的に,ドーパミンにより間接的に調節されることを発見し,成熟SNrニューロンにおけるグリシン受容体発現も観察した。そこで,緻密部から放出されたドーパミンがアストロサイトのGlyT1を介したグリシン取り込み調節によりSNrの発火様式を制御する可能性を検証するために,HEK293細胞にグリシン受容体を強制発現させてホールセルパッチクランプ法によるバイオセンサーを用いてSNrの初代培養アストロサイトにドーパミンを投与した際のグリシン電流の観察することに成功した。また,アミノ酸分析法によって,アストロサイトがドーパミン刺激でグリシン放出を行う能力を有することが確認された。加えて,ドーパミン投与による細胞内カルシウム上昇がドーパミン受容体阻害剤で消えることも確認した。これらの結果は,アストロサイトがドーパミン刺激でグリシン放出することを明らかに示すもので,SNrでの免疫電子顕微鏡法によるグリシン放出の観察を行っている。
30.脳領域特異的なコンディショナルなメタスチンノックアウトマウスの
作製とその解析
前多敬一郎,冨川順子,平嶋 昴(名古屋大学大学院生命農学研究科)
平林真澄
メタスチン(キスペプチン)はGPR54の内因性リガンドとして発見された神経ペプチドである。このペプチドを含むニューロンは,は近年,性腺刺激ホルモン放出ホルモン(GnRH)の分泌を直接制御し,卵巣から分泌されるエストロジェンのGnRHへのフィードバック効果を仲介するニューロンとして注目されている。
メタスチンニューロンは,げっ歯類脳内では2つの集団を形成し,一つは前腹側室周囲核 (AVPV) にもう一つは視床下部弓状核 (ARC) にある。AVPVにある集団は排卵を制御し,エストロジェンの正のフィードバックに関与するとされている。ARCの集団の機能は全くわかってないが,われわれはこの集団が,GnRHのパルス状分泌を制御しており,卵胞発育を制御することで生殖機能全体の中枢として機能していると考えている。本研究では,メタスチンニューロンの脳内の2つの集団の生理的役割を明らかにするため,Cre/loxPシステムを用い,それぞれの脳領域で特異的にメタスチン発現を欠損するようなコンディショナルKOマウスの作出を目指している。
マウスメタスチン遺伝子のexon 3を含む領域をloxPではさんだコンストラクトを組み込んだベクターをエレクトロポレーション法により,ES細胞に導入し,同領域が組み換えられたESクローンを得た。このクローンのネオマイシン耐性遺伝子を除くため,Creを強制発現させたところ,同遺伝子だけを欠損したクローンが得られた。現在このESクローンを8細胞胚に注入し,キメラマウスを作出している段階である。
また,AVPVあるいはARCのいずれのメタスチンニューロンで特異的にCreを発現するマウスを作出するため,現在メタスチンの領域特異的なエンハンサー部位を明らかにしようとしている。このため,メタスチンペプチドをコードする遺伝子領域の上流22 kbpおよび下流5 kbpを上限とするさまざまな長さの配列にAcGFP1遺伝子をつないだコンストラクトを作成し,マウス受精卵に注入し,TGマウスを作成して,in vivoのreporter assayを行っている。現在最初のマウスが生まれつつあり,今後それらのマウスの脳におけるGFP発現を解析していく予定である。