1.Analysis of dendritic spine neck in normal hippocampal neuron culture
and chemical LTP model
Jee-Woong Kim, Hyun Wook Kim, Im Joo Rhyu
(Department of Anatomy, College of Medicine, Korea University, Korea)
Tatsuo Arii, Keiji Imoto (NIPS)
The dendritic spine is a protrusion of dendrite of the neuron, which is a major synaptic input of excitatory synapse. Recently many dendritic spine researches on plasticity have been reported thanks to improved quality of the confocal microscopy with fluorescent technique. But the fluorescent images are dependent on the intensity of fluorescence, not actual size of the region of interest (spine). Especially histological characteristic of dendrtic spine neck is important to understand compartment resistance chemical gradient and electricity flow.
We constructed high resolution electron tomography with high voltage electron microscope. The 7-10 day-old hippocampal neuron was transfected with a vector containing GFP using a lipofectamine 2000 protocol. Two-four days later, cultures are visualized at high resolution on the Pascal. Transfection yields normally several (10-100) fluorescent cells in one dish. The neurons was fixed with 4% paraformaldehyde and fluorescent signal into DAB precipitation. The neuron was embedded in the in Epon-Araldite mixture and well stained hippocampal neuron was cut into 1-2 micrometers section and was observed under the high voltage electron microscope. After acquisition of serial tilting image of +/-60o, the series of image was aligned and virtual volume was reconstructed by IMOD program. Further analysis of the neck with control and chemical LTP model is under way.
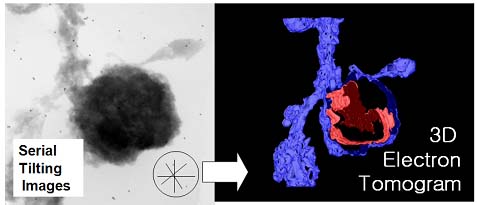 |
|
The electron tomogram of dendritic spine (right) |
2.神経細胞などにおける細胞骨格や膜タンパク質などの3次元構造解析
遠藤泰久,中田香奈,伏木大輔,四方雅人,吉村亮一(京都工芸繊維大学)
有井達夫(生理学研究所)
多細胞動物の細胞間結合装置のひとつであるギャップ結合は,隣接する細胞と直接的情報伝達を行い,発生期の形態形成,筋組織の同調,神経系における電気シナプスなど多様な機能をはたしている。ギャップ結合を構成するタンパク質として,脊椎動物ではコネキシン・ファミリー,無脊椎動物ではイネキシン・ファミリーが知られている。両ファミリーはアミノ酸配列に相同性が見られないが,膜4回貫通構造などの共通性を有している。最近,イネキシンのホモログであるパネキシンが哺乳類で同定され,ギャップ結合の系統発生的な起源が新たな問題となっている。また,それらの機能的分担や,ヘミチャネルとしての機能の詳細はいまだ不明である。我々はイネキシンがコネキシンと同様の6量体チャネル構造を形成するのか,細胞膜上での詳細な分布を解析するため,昆虫培養細胞系を用い超高圧電子顕微鏡によって観察を行った。
ホルムバール支持膜を張った金メッシュを70%エタノールで滅菌後,コラーゲンコートを施し,昆虫培養細胞NIAs-AeAl-2を培養した。4%パラフォルムアルデヒド固定後,抗イネキシン2抗体によりABC-HRP法で免疫染色し,DAB,硫酸ニッケルアンモニウムで発色した。1%オスミウム酸で後固定し,エタノール系列で脱水し,二酸化炭素−臨界点乾燥を行った。試料をカーボン蒸着後,超高圧電子顕微鏡(H-1250M 加速電圧1,000kV)により,同一視野を−60度から+60度まで2度刻みの傾斜連続写真を撮影し,IMODにより成長円錐におけるイネキシン免疫反応部位の3次元画像解析を行った。イネキシンの免疫反応は細胞膜上に凝集して見られた。図1に示すように,直径約10nmのほぼ円形の電子密度の高い構造が数10個,密に集合していた。個々の構造は酵素反応によって増感されていることを考慮すると,直径6-8nmの円形構造と考えられる。この構造はフリーズフラクチャーによって観察されるギャップ結合の膜内粒子の構造によく類似している。3次元画像解析によりイネキシン・チャネルの構造を詳細に検討する予定である。
 図1.昆虫培養細胞NIAs-AeAl-2におけるイネキシン2の超高圧電子顕微写真。Bar=40nm |
3.細胞内亜鉛の分布に関する細胞化学的研究
野田 亨(藍野大学医療保健学部理学療法学科)
亜鉛は遺伝子の転写因子をはじめ,いくつかの酵素の構成要素ともなっており,人体に必須な金属である。また亜鉛の摂取不足では味覚,生殖器,皮膚,神経系組織に大きな影響を及ぼすことが知られている。最近,形質膜をはさんだ細胞内外の亜鉛の輸送や細胞質と細胞小器官との間の亜鉛の輸送にトランスポーターが関与することが明らかになってきた。そこで我々は亜鉛輸送トランスポーターの電子顕微鏡レベルの免疫組織化学,および亜鉛そのものを検出する手法を用いて,亜鉛の細胞内動態とその意義について明らかにする。
まず,ラット精巣上体について,亜鉛の局在をautometallography (AMG) という手法を用いて,電子顕微鏡下に可視化することを試みた。この方法により,精巣上体を観察すると,正常では,亜鉛の存在を表す銀粒子は細胞質に均一で,まばらな分布を示し,特定の細胞小器官に銀粒子が集中することはなかった。しかし,硫酸亜鉛の水溶液5mg/100g.b.w.を2日間,腹腔投与した後に検出したものでは,細胞質における有意な銀粒子の分布は認められず,特に主細胞の核上部に集中していた。通常の電子顕微鏡,および超高圧電子顕微鏡による観察では,この核上部の集中している領域はゴルジ装置に一致していた。次に亜鉛輸送トランスポーターのうち,ZnTファミリーの1つであるZnT7の局在を間接蛍光抗体法で観察すると,このトランスポーターの分布も主細胞の核上部に一致しており,TGN38蛋白との二重標識所見から,ZnT7の局在もゴルジ装置と重なっていた。これらの結果から,精巣上体主細胞ではゴルジ装置が亜鉛の細胞質からの取り込みと貯蔵に積極的に関与していることが示唆された。但し,厳密にはゴルジ装置におけるZnT7の局在はTGN38と必ずしも一致せず,TGN38よりはやや外側の領域が陽性であったことからZnT7の局在はゴルジ層板の中間層,あるいはcis側層板である可能性が高い。しかしながら,AMGによる亜鉛の局在を示す銀粒子の分布はむしろゴルジ層板のややtrans側層板と考えられることから,ZnT7の局在とAMGによる銀粒子の分布との間には一致しない点があり,精巣上体主細胞のゴルジ装置にはZnT7とともに,ZnT7以外の亜鉛輸送トランスポーターの関与も推測される。
4.孵化直前のイソアワモチveliger幼生の眼にみられる
photic vesicle形成過程の超高圧電顕観察
片桐展子,片桐康雄(弘前学院大学・看護学部)
有井達夫(生理研超高圧電顕)
イソアワモチOnchidium verruchlatum(軟体動物,腹足類)の近縁種Onchidium sp.は,卵嚢内でveliger幼生期を経て,成体に近い形態にまで生長し殻をもって孵化する。眼は産卵後8日目のveliger幼生に原基が形成され,そのまま,孵化後の成体の眼となり,網膜の細胞は黒い色素顆粒を有するので黒点として認めることができる(片桐ら1999)。加温オスミウム染色は組織に高いコントラストを与えるので,超高圧電顕よって,準厚切切片においても通常の電顕のように微細構造の観察が可能である。腹足類の眼では,光受容細胞内に密在するphotic vesicle (PV) は加温オスミウム染色によって黒染される。Onchidium sp.の幼生は孵化時の大きさは約10mm長で小さく,眼は固定するとその出現部位を外見から識別できなくなる。そのため,連続した準厚切切片を作成し,眼の形成過程の観察を行った。
【材料】孵化直前の幼生を用いた。加温オスミウム染色などの方法は生理研報告25および28を参照。超高圧電顕により,1,500~20,000倍で観察した。
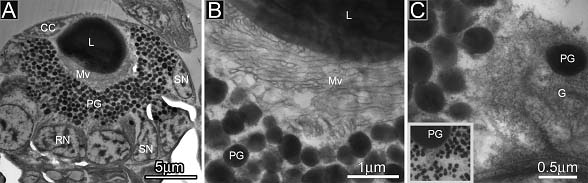
【結果】孵化直前の幼生の眼は楕円形で,大きさ20 x 15mm,中央に高電子密度の球形のレンズ(径5mm)が位置する。レンズを囲む壁は角膜と網膜である。角膜は扁平な角膜細胞からなり,レンズ表面を覆う。網膜は最も厚いところで約8mmあり,光受容細胞と支持細胞から構成され,両者は黒い色素顆粒(径0.5mm)を有する。光受容細胞の核は丸くより大形で網膜の外側に,支持細胞の核はやや小形でレンズ側に位置する。微絨毛は径や長さが不規則で,レンズの下半部を囲むように配列し。成体の眼におけるように放射状に伸びて整然と配列していない。細胞質にはゴルジ層板やPVに相当する粒状の構造が認められる。しかし,成体のPVと異なり,輪郭が不明瞭で低電子密度である。
【考察】これらの微細構造から,孵化直前の幼生の眼は,産卵10日目のveliger幼生と孵化後の幼動物の中間の形態(生理研年報28)である。孵化後の幼動物や成体の光受容細胞に特徴的な微絨毛やPVは出現しているが,視物質の合成や代謝はまだ不十分で,加温オスミウム染色によって特染されない。孵化直前の幼生は卵嚢内にいるが幼動物と形態はほぼ同じにみえた。しかし,その眼は構造も機能も未熟と考えられる。
 | |
|
図A |
孵化直前の幼生の眼。中央に高電子密度のレンズ (L),扁平な角膜細胞 (CC) がレンズ表面を覆う。網膜は光受容細胞と支持細胞から構成され,両者は黒い色素顆粒 (PG) を有する。光受容細胞の核 (RC)は丸くより大形,支持細胞の核 (SC) はやや小形。Mvは微絨毛。 |
|
図B |
微絨毛 (Mv) はレンズの下半部を囲むような方向に認められる。成体の光受容細胞とやや異なり,微絨毛はまっすぐに伸びていない,サイズは一様でない,その配列も整然としていない。PGは色素顆粒。 |
|
図C |
細胞質にはゴルジ層板やphotic vesileに相当する粒状の構造が,不明瞭ではあるが認められる。
|
5.嗅球ニューロン・グリアの三次元構造解析
樋田一徳(川崎医科大学解剖学)
これまで報告者が嗅球シナプス神経回路の解析を行なってきた際に,電顕連続切片からシナプス近傍にastrocyteの存在が観察されたが,その存在様式と形態は多様で,シナプス結合の種類やシナプス結合を形成するニューロンの化学的・形態的性質との明らかな相関は確認できなかった。ニューロンとは異なりグリア細胞の突起部分まで詳細に全体像を特異的に染色することはゴルジ染色以外に難しい。一方astrocyteのゴルジ染色像は複雑な形態を呈し,光学顕微鏡でその全貌を理解するのも困難である。そこで我々は超高圧電子顕微鏡の高解像力を利用してラット及びマウス嗅球のゴルジ染色標本を層別にastrocyteの解析を行なってきた。当年度はラット嗅球顆粒細胞層のastrocyteに注目し解析を行なった。その一例を紹介する。
astrocyteの形態はゴルジ染色で観察され,ニューロン周囲に取り巻く立体構造を示す。(昨年度報告書)
5mm厚ゴルジ染色切片のastrocyteの突起辺縁は薄膜状に広がり顆粒細胞を取り巻いている。(図a, b)この部分を2º 毎に±60º 連続傾斜撮影し(c)トモグラフィー解析から三次元再構築を行なうと(d),ゴルジ染色像(a, b) がデジタル画像データ(e, f)に変換される。この三次元voxelデータから2nm間隔の再切片像が取得でき(g),顆粒細胞表面の40-90%がastrocyteに囲まれていることがわかる。
S100bの免疫染色では,顆粒細胞の周囲に微細な免疫反応性が認められ,また顆粒細胞のGABA反応性は多様であり,細胞間相互作用とastrocyteの被覆率の多様性を視野に,更に解析を進めている。
[図の説明]
ゴルジ染色によるラット嗅球顆粒細胞層astrocyteの超高圧電顕トモグラフィー解析の一例。
aとbは嗅球顆粒薄膜部分のステレオ像 (±8º )。これは5mm厚切片を2º 毎に±60º 連続傾斜撮影し (c),このデータをもとにコンピューター解析を行うと (d ; IMODversion3.9.3),360º 三次元再構築像が得られる (e)。この三次元voxel data (f&g) から2nm間隔の再切片像が取得できる(g)。gのスケールは5mm,a, b, e-gは同倍率で,cとdの各図はその1/2の縮小倍率。

6.電気シナプスを形成した網膜及び脳ニューロンの樹状突起の構造
日髙 聰(藤田保健衛生大学医学部生理学教室)
ギャップ結合チャネル蛋白・コネキシン (connexin, Cx)の解明から,神経科学の実験手法を組み合わせることにより,ギャップ結合と電気シナプスとの構造と機能との関係を解析できる。a) 電気シナプスを電気生理学的に解析し,b) ニューロンの間での接触部位を同定して,c) 超薄切片上でギャップ結合を同定すると共に,d) 5mmの厚さの切片を1,000kVの加速電圧の超高圧電子顕微鏡下で解析することによって,ギャップ結合を形成する樹状突起の立体構造を解明して,ギャップ結合の大きさを同定する。e) 抗コネキシン抗体を用いた免疫細胞化学法を適用し,光学顕微鏡レベルでもギャップ結合の部位を解析する。本研究では,網膜神経節細胞の間,抑制性のアマクリン細胞の間と,水平細胞の間の電気シナプスの解析を行ない,ギャップ結合と電気シナプスの構造と機能との解析結果から,電気シナプスのチャネル開口率を計測した。
Dual whole-cell patch-clamp法による電圧固定から細胞間チャネルの最大コンダクタンスを測定した(ラットa型網膜神経節細胞の間2.45 nS,キンギョのアマクリン細胞の間5.48 nSと,水平細胞の間44.06 nS)a)。細胞内標識した標本を解析し,樹状突起間の接触部位は平均7個(網膜神経節細胞),1個(アマクリン細胞)と,6個(水平細胞)であったb)。超高圧電子顕微鏡で樹状突起の間の接触部位にあるclose membrane appositionの構造を同定したd)。そこには,超薄切片でギャップ結合を同定したc)。超高圧電子顕微鏡でgonio-meterを用いてギャップ結合斑の大きさを計測し,平均直径は網膜神経節細胞で0.86mm,アマクリン細胞で5.97mmで,水平細胞間で2.90mmであったd)。ラットa 型網膜神経節細胞ではCx36,キンギョのアマクリン細胞ではCx43が,水平細胞ではCx55.5が発現していることが分かったe)。これらのコネキシンの最大シングルチャネルコンダクタンスは知られている(f)。これらの結果に,凍結割断レプリカ法での各ニューロン型が形成するギャップ結合チャネル・コネクソン粒子の密度(g)を導入して,測定した各ニューロン間の最大チャネルコンダクタンス(a)を元に計算したギャップ結合の開口チャネルの割合は,網膜神経節細胞間で0.7%,アマクリン細胞間で0.1%,水平細胞間では0.3%であった。本研究から,網膜ニューロン間に存在する電気シナプスのチャネル開口率は,これまでに想像されていた値よりもずっと小さいことが明らかになった。
[文献]
1) Hidaka, S. et al. (2004) Journal of Neuroscience, 24 (46): 10553–10567.
2)Hidaka, S. et al. (2005) Journal of Integrative Neuroscience, 4 (3): 313–340.
3) Hidaka, S. (2009) submitted to Journal of Neuroscience (in revised process).
|
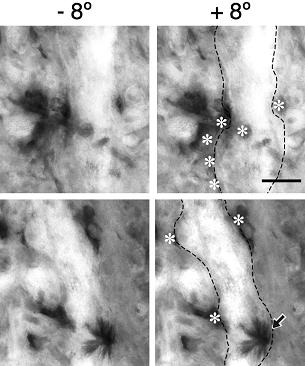
図1:ニューロンの樹状突起の間のギャップ結合斑の大きさ。隣り合う細胞の樹状突起間の相互接触部位の,網膜水平切,厚さ5mm切片の1,000kVの加速電圧での超高圧電子顕微鏡像。キンギョのアマクリン細胞をNeurobiotinで細胞内標識して発色した。ギャップ結合を介して拡散したNeurobiotinにより,隣り合うアマクリン細胞の樹状突起が染色された。試料ステージを段階的に傾斜して,樹状突起の間のギャップ結合斑(close membrane apposition形態の接触領域)を観察して,ギャップ結合斑の大きさを計測した。Close membrane apposition形態の接触領域の上端と下端に矢印を置いてある。本ギャップ結合斑の大きさは縦の長軸方向に15.5 mmであった。それぞれの写真は以下の傾斜角で撮影された。(A) -20º ,(B) -12º ,(C) -8º ,(D) 0º ,(E) +8º と (F) +22º 。Scale bar: 10 mm.  |
7.Three-dimensional analysis of ultra-structure of functionally identified neurons in the mouse olfactory bulb
清蔭恵美,樋田一徳(川崎医科大学解剖学)
Adam C. Puche, Michael T. Shipley (Department of Anatomy and Neurobiology,
University of Maryland School of Medicine, MD, USA)
我々はこれまで,糸球体層における各種介在ニューロンの電気生理学的特性と形態的特徴の解析を進めてきた。その結果,GABA系介在ニューロンは1~2個の糸球体内で突起の伸長が留まっているのに対し,ドーパミン系介在ニューロンでは多数の糸球体にその突起を伸長していることが明らかとなった。しかし,個々の糸球体内での各種介在ニューロンの突起分布の詳細についてはまだ明らかになっていないため,超高圧電子顕微鏡を用いて各種介在ニューロンの突起網の三次元構造解析を始めた。
GABAの合成酵素であるglutamic acid decarboxylase 65KDa (GAD65) 及びドーパミンの律速酵素であるtyrosine hydroxylase (TH) 発現をgreen fluorescent protein (GFP) で置き換えたトランスジェニック (Tg) マウスを灌流固定後,嗅球から50mm厚の連続スライスを作製した。抗GFP抗体を用いた免疫染色後,蛍光ナノゴールドを経て銀増感標識した。更に5mm厚の切片を作製して糸球体内の立体観察を超高圧電子顕微鏡で行った。また2度毎で連続傾斜像を±60度撮影し,それを電子線トモグラフィー法で三次元構造解析を行った。
嗅受容細胞の軸索のマーカーである抗olfactory marker protein抗体との多重蛍光染色を共焦点レーザー顕微鏡で観察したところ,GAD65 GFP (+) ニューロンは糸球体内で嗅受容細胞軸索とコンタクトする突起の分布がTH GFP (+) ニューロンに比べて多様性を示した。しかし,複雑に絡み合い多様性を示す糸球体内突起網の詳細な分布は不明なため,超高圧電子顕微鏡を用いた観察を行った。その結果,GAD65 GFP (+) ニューロンは0.1~0.4 mm径の不規則な突起が複雑に折れ曲がり,相互に接触し2次,3次に分枝した突起が絡み合いながら糸球体内に限局した蜂の巣状構造を呈していた。これに対しTH GFP (+)ニューロンは,径がやや大きい0.4~0.8 mm径の突起が大きく蛇行し,部分的に数珠状を呈しながら糸球体内に,一部は傍糸球体領域へ伸長していた。またこれらの突起の分枝は二次分枝に留まることが多く,3次分枝はまれであった。このように異なる神経伝達物質を発現する介在ニューロンは,糸球体内で異なる突起分布を示すことが示唆された。また,Tgマウスと抗GFP抗体を組み合わせた試料は,超高圧電子顕微鏡を用いた微細な突起網の解析に非常に有用であると考えられた。現在,トモグラフィー法による突起網の詳細な三次元解析を進めている。
8.ヒトヘルペスウイルス6 (HHV‐6) 感染細胞の3次元構造再構築
吉田まり子(岡山大学大学院医歯薬学総合研究科)
ヒトヘルペスウイルスの成熟エンベロープの獲得部位については,核膜や小胞体膜であるという報告と,細胞質内の空胞膜であるという報告がある。HHV-6は,他のヘルペスウイルスとは異なり,高電子密度のテグメントを有し,成熟エンベロープの獲得の場がどこかという点を明瞭に示すマーカーとなる。そこで,HHV-6感染細胞をもちいて,厚切り切片 (0.3-5mm) や凍結置換固定による全載標本を作成して研究を進めている。
1,000kVの加速電圧を有する超高圧電子顕微鏡(H-1250M) よるステレオ観察を行うとともに,トモグラフィー解析手法を用いて3次元構造を再構築しエンベロープの獲得部位を同定するために,目的とする構造との関連で,最適な膜厚を実験的に検討している。
9.精神疾患モデル動物を用いた脊髄内運動ニューロンの形態変化
坂本浩隆(岡山大学大学院・自然科学研究科・理学部附属臨海実験所)
河田光博(京都府立医科大学大学院・解剖学・生体構造科学)
有井達夫(生理学研究所・脳機能計測センター・形態情報解析室)
ラットの球海綿体筋を支配する球海綿体脊髄核 (SNB) は,腰部脊髄 (L5-6) に存在し,雄優位の性的二型核を示す運動ニューロン群であり,勃起・射精など,雄の性行動に重要な役割を果たすことが知られている。ラットの去勢実験から,男性ホルモン(アンドロゲン)がSNB運動ニューロンの樹状突起上に存在するシナプス数を制御していることが報告されているが,これらのSNBに入力するシナプス群の神経解剖学的特性の同定は,未だなされていない。一方,最近我々は,神経ペプチドgastrin-releasing peptide (GRP) の発現が雌に比べ,雄ラットの腰髄に有意に高いことを新規に見いだした(Sakamoto et al., 2008, Nature Neuroscience)。ラット脊髄のGRPニューロンは,腰髄のL3-4付近に細胞体が存在し,腰髄のL5-6に位置する勃起や射精をつかさどる自律神経核にまで軸索を到達させていた。腰髄に存在するGRPシステムは脊髄内に神経ネットワークを構築し,自律神経系を制御することにより,雄性性機能を調節しているものと考えられた。本研究では,GRP免疫組織化学法とSNBニューロンの逆行性標識法とを組み合わせることにより,超微形態学的にSNBニューロンの樹状突起上にGRPシナプスの入力があるかどうかを,超高圧電子顕微鏡(日立:H-1250M)を用いて調べた。
西洋ワサビペルオキシダーゼ結合コレラトキシンbサブユニット(CTb-HRP) により逆行性標識されたSNBニューロンをテトラメチルベンジジン(TMB) 法で,また,GRP免疫組織化学染色をジアミノベンジジン(DAB) 法でそれぞれを可視化し,超高圧電子顕微鏡下で区別することに成功した(図1)。その結果,SNBニューロンにGRPシナプス入力が存在することが3次元的に示唆された。球海綿体筋の収縮は陰茎勃起と射精に深く関与していることが報告されており,SNBへの救心性GRPシナプス入力を介して性行動を制御している可能性が示唆された。現在,これらの逆行性標識法と免疫組織化学法とを組み合わせた先端的技術を利用して,超高圧電子顕微鏡下,多角的に解析を進めている。
以上の結果をまとめた論文を現在投稿中であり,またデータの一部は,第50回日本組織細胞化学会総会・学術集会(平成21年9月26-27日開催)で発表予定である。
 | |
|
図1; |
超高圧電子顕微鏡のステレオペア像(±8º の傾斜をかけて撮影)。放射状沈着物として観察されているTMB産物(矢印)で,逆行性標識されたSNBニューロンの樹状突起(破線)に終末するGRPニューロンの軸索(*)。Bar = 2 µm. |
10.Study on the Bi-1 role in Mitochondria in C. elegans using RNAi
Seok Won Jeong, Jee Young Kwon, Md. Mujibur Rahman,
Jee Yeon Park, Hye Lim Kim, Young Rok Seo
(Department of pharmacology, Institute for Basic Medical Science (IBMS),
School of medicine, Kyung Hee University, Seoul, Republic of Korea)
Apoptosis-related signaling pathway has been issued owing to a number of health problems including neurodegenerative disease. Recently, several homologous of animal programmed cell death regulators have been identified in human cell. Bax Inhibitor-1 (BI-1), among the cell death regulators, has been known to decrease Bax-induced apoptosis. However, BI-1 function and localization has not been elucidated clearly. We identified the BI-1 localization that associated with both ER membrane and mitochondria as a novel aspect of BI-1 for the role in apoptosis process. Searching the BI-1 like gene was done in C. elegans as an alternative animal model. We attempted to investigate a role of BI-1-like gene in the 3-dimensional mitochondrial formation of C. elegans using High Voltage Electron Microscopy (HVEM). We are on the process of making the construction of 3-dimensional mitochondria structure in C. elegans treated with the RNAi of BI-1-like gene.
11.哺乳類神経前駆細胞からの神経細胞生成過程の観察
小曽戸陽一,末次妙子(理化学研究所・発生再生科学総合研究センター)
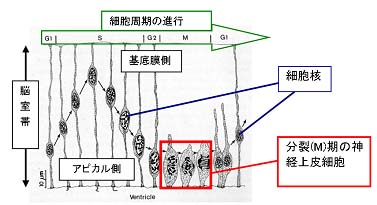
脊椎動物の発生期の脳の形成過程で中枢神経系の神経細胞は,神経管を縁取る脳室帯に存在する前駆細胞である「神経上皮細胞」(図1)から生み出される。神経上皮細胞は脳発生初期の自己複製的増殖から,後に神経細胞への分化という発生学上の運命をたどる。単純な神経管から複雑な脳へという組織形成の過程では「時空間的な秩序を伴った」神経上皮細胞の増殖・分化が必須であり,脳形成・神経発生の仕組みを統合的に解明することは,「脳の構築」を知る際の根幹となる。
「エレベーター運動」(図1)と呼ばれる細胞核運動は,神経上皮細胞分裂位置の決定メカニズムに関わる鍵といえる。神経上皮細胞の「自己複製的分裂」は脳室帯アピカル表層(図1,下方)で起こるが,その細胞核は「細胞周期」に従って組織内を往復運動する。アピカル表層で細胞分裂(M期)が起こり,その後のG1期で基底膜側方向に細胞核が移行する。DNA合成期であるS期に核は脳室帯の基底膜側に局在し,その後のG2期間に細胞核は再び基底膜側からアピカル側に逆方向に移行する。現在までにエレベーター運動の最大の特徴である「組織構造の秩序を保ちつつ,細胞周期に従った核移行」という点について,本質的な機構の解明がなされていない。
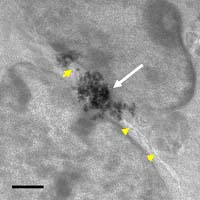
私は,予備的実験からアピカル側の細胞分裂により生じるアピカル→基底膜間の密度勾配により神経上皮組織内に「流れ」が生じ,その流れに従って細胞核がアピカルから基底膜側に移行することを作業仮説として提唱している。一般的に物質の「流れ」を顕微鏡で視認する際には「流れ」に沿って動く物体(マイクロビーズなど)を観察する方法が適当である。接着組織内でのマイクロビーズの挙動の観察はほとんど前例が無いが,私はすでに,予備実験としてマイクロビーズの神経上皮組織内への新規の取り込み技術を開発している。取り込まれたマイクロビーズの局在する位置が,細胞内あるいは細胞外であるかを知ることは,結果の解釈に重要となってくる。この目的のためには細胞間隙を直接観察することが必要であるが,光学顕微鏡での観察では解像度が不十分である。そのため私は,超高圧電子顕微鏡(生理学研究所)の共同利用研究を行い,組織内のマイクロビーズの局在を電子顕微鏡レベルで観察することを進めている(図2)。
 |
 | ||
|
図1. |
神経上皮細胞のエレベーター運動 |
図2. |
生理学研究所の超高圧電子顕微鏡にて観察された,磁性マイクロビーズの神経上皮組織内での局在。取り込まれたビーズ(白矢印)が細胞間隙(黄矢頭)に局在していることが示されている。Bar=1µm |
12.3-D Reconstruction of Plastid Crystalline Bodies during C-4 Cellular Differentiation
InSun Kim (Keimyung University)
High voltage electron microscopy has been used to reveal the distinctive structural pattern and development of the crystalline inclusion bodies (IBs) within dimorphic C-4 plastids of Salsola. komarovii. Formation of the plastid IBs has been investigated at the sub-cellular level of the two different cell types. The plastid IBs in mesophyll and epidermal cells both exhibited paralleled and crystalline structures with membranous boundary (Figs. 1, 2), but the arrangement of elements consisting of the IBs were different at initiation. In the mesophyll plastids, aggregates of IBs initially formed a different periodicity, while the epidermal IBs were rather uniform. The periodicity distances between membranous elements were rather irregular at the margin, but eventually reached to about 10 nm by the newly joined membranes that were just added to the growing bodies. In both cell types, however, the elements of growing IBs were derived from thylakoidal membranes of various orientations that were adjacent to. The plastid IBs examined in the two cell types probably originated from the neighboring thylakoidal membrane system, although the size and internal structure of the elements were relatively different during early development. The epidermal IBs were usually small and central, while the mesophyll IBs were irregular and situated randomly, but close to starch grains (Fig. 3).
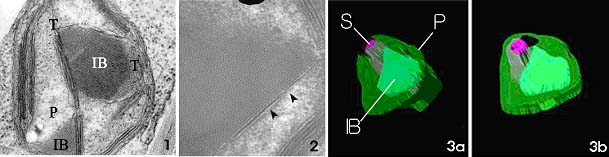 Fig. 1. Crystalline inclusion body (IB) formed within the mesophyll plastid (P); Fig. 2. A higher magnification of the epidermal IB exhibiting the element origin from the neighboring thylakoidal membranes (arrowheads); Fig. 3a. 3-D model of the IB and starch (S) within plastid (3b, tilted image). |
13.Ultrastructure in testis of mutant mip40 of Drosophila melanogaster
Se Jin Park, Kyung Eun Lee, Sung Sik Han
(School of Life Sciences and Biotechnology, Korea University)
In drosophila, co-ordination of the cell cycle with cellular differentiation is essential for the development of spermatogenesis. These two developmental pathway are independent, but must be co-ordinated to ensure that the massive morphological changes that normally occur after meiosis are not initiated prematurely. Meiotic cell cycle progression and cellular differentiation are linked by the function of the meiotic arrest gene. The meiotic arrest gene control differentiation by regulating the transcriptional activation for many differentiation-specific genes. Loss of function in meiotic arrest gene fail to undergo spermatid differentiation and eventually degenerate leading to male sterility. Mip40 (Myb-interacting protein 40) is testis-specific meiotic arrest complex which involved in spermatid differentiation. In this study we examined structure of testis in mip40 mutant of Drosophila melanogaster and found the morphological change during spermatogeneis employing a high voltage electron microscopy(HVEM), which has been effectively applied to study three-dimensional structure. We have attempted to make a 3D-reconstruction of testis structure in mip40 mutant using IMOD software. Our results might suggest a new approach to understand that function of meiotic arrest gene in Drosophila spermatogenesis.
《超高圧電子顕微鏡共同利用実験での業績リスト》
発表論文
- Kim IS (2008) Comparison of the plastid inclusion bodies in Sedum examined by the transmission electron icroscopy (TEM) and high voltage electron microscopy (HVEM). J. Inst. Nat. Sci. (Keimyung University) Vol. 26(2): 55-61.
- Hidaka S (2008) Intracellular cyclic-AMP suppresses the permeability of gap junctions between retinal amacrine cells. J Integr Neurosci. 2008 Mar;7(1):29-48.
- Kosodo Y, Toida K, Dubreuil V, Alexandre P, Schenk J, Kiyokage E, Attardo A, Mora-Bermúdez F, Arii T, Clarke J DW, Huttner W B (2008) Cytokinesis of neuroepithelial cells can divide their basal process before anaphase. EMBO J. 27, 3151-3163.
- Toida K (2008) Synaptic organization of the olfactory bulb based on chemical coding of neurons. Anatomical Science International 83, 207-217.
- 小澤一史 (2008) 超高圧電子顕微鏡を用いた生物試料観察の基礎と応用。顕微鏡 43, 241-245.
- 野田 亨 (2008) 超高圧電子顕微鏡を用いた細胞小器官の観察。顕微鏡 43, 246-249.
- 樋田一徳,清蔭恵美,有井達夫 (2008) 超高圧電子顕微鏡による嗅球のニューロンとグリアの三次元構造解析。顕微鏡 43, 250-253.
学会報告
- Mun JY, Jung MK, Lee YM, Han SS. (2008.2) Ultrastructure of subsarcolemmal mitochondria in mitochondrial disease patient.: Electron tomographic and ultrastructural analysis. 52nd ann. meet. and 16th Intern. Biophysics Congress (Long Beach, USA).
- 日髙 聰 (2008.3) 網膜内網状層で側状抑制を行うアマクリン細胞間の電気シナプスの働き。第85回日本生理学会大会(東京)
- 樋田一徳 (2008.3) 超高圧電子顕微鏡及び電顕連続切片による嗅球シナプス構成の三次元構造解析。第113回日本解剖学会総会(大分)
- Mun JY, Han SS (2008.5) Electron tomography of biological field. 日本顕微鏡学会第64回学術講演会(京都)
- 重本隆一 (2008.5) 学習やシナプスの長期増強現象による神経樹状突起の形態変化を超高圧電子顕微鏡で見る。日本顕微鏡学会第64回学術講演会(京都)
- 小澤一史,梶村直子,戸張靖子,松本恵介,沢井信彦 (2008.5) 超高圧電子顕微鏡を用いた神経細胞および神経膠細胞のトモグラフィー観察。日本顕微鏡学会第64回学術講演会(京都)
- 西田倫希,有井達夫,吉村亮一,遠藤泰久,鷹岡昭夫,森博太郎 (2008.5) 超高圧電子顕微鏡トモグラフィーによる神経成長因子受容体TrkAの局在に関する研究。日本顕微鏡学会第64回学術講演会(京都)
- 小澤一史 (2008.5) 超高圧電子顕微鏡の生物試料観察への基礎と応用。日本顕微鏡学会第64回学術講演会(京都)
- 小曽戸陽一,木村 暁,末次妙子,馬場昭次,松崎文雄 (2008.5) Comprehensive analysis of the interkinetic nuclear migration in developing brain. 第41回日本発生生物学会大会(徳島)
- Kim IS(2008.5) Development of the plastid crystalline bodies during C-4 tissue differentiation. The 39th Annual eeting of the Korean Society of Electron Microscopy (Daegu, Korea).
- Mun JY, Lee TH, Koo HS, Han SS (2008.6) Reactive oxygen species due to expression level of mitochondrial protein reorganizes mitochondrial cristae/inner membrane structure. 33rd FEBS Congr. 11th IUBMB Conf. (Athens, Greece).
- Hidaka, S. (2008.7) Artificial antibody aginst electrical synapses between retinal ganglion cells. Neuro2008 (Tokyo).
- 小曽戸陽一,木村 暁,末次妙子,馬場昭次,松崎文雄(2008.7)胎生期マウスの脳形成におけるエレベーター運動の多角的解析。第31回日本神経科学大会(東京)
- 久加亜由美,伏木大輔,吉村亮一,西田倫希,藤澤 肇,遠藤泰久(2008.7)超高圧電顕による軸索ガイド分子受容体(ニューロピリン,プレキシン)の3次元画像解析。日本神経科学第31回大会(東京)
- 日髙 聰,海野 修 (2008.8) 網膜杆体系ON型双極細胞の受容野中心部の光応答特性―双極細胞間のhomologousな電気シナプスとの関係―。第12回視覚科学フォーラム大会(大阪)
- Kim IS (2008.8) Formation of the plastid crystalline bodies during C-4 cellular differentiation. The 63th Annual Meetings of the Korean Association of Biological Sciences (Mokpo, Korea).
- 小曽戸陽一,木村 暁,末次妙子,馬場昭次,松崎文雄 (2008.8) Comprehensive analysis of the interkinetic nuclear migration in developing brain. 7th ELSO Meeting (Nice, France).
- Nishida T, Arii T, Takaoka A, Yoshimura R, Endo Y. (2008.10) Three-dimensional, computer-tomographic analysis of membrane proteins (TrkA, caveolin, clathrin) in PC12 cells(日本組織細胞化学会論文賞受賞講演)日本組織細胞化学会第49回学術集会(長崎)
- Mun JY, Lee TH, Koo HS, Han SS (2008.11) Electron Tomographic Analysis of Mitochondrial Ctistae Topology; Functional-liked Morphological Change. 9th Asia-Pacific Microsc. Conf. (Jeju, Korea)
- Nagata T (2008.11) Applications of high voltage electron microscopy to thicker biological specimens. 9th Asia- Pacific Microsc. Conf. (Jeju, Korea)
- Mun JY, Jung MK, Lee YM, Han SS (2008.11) Ultrastructural change of mitochondria in mitochondrial respiratory chain disease: Electron tomographic and ultrastructural analysis. 9th Asia-Pacific Microsc. Conf. (Jeju, Korea)
- Noda T (2008. 11) The structures revealed by Zinc Iodide Osmium (ZIO) staining method and zinc metabolism. 9th Asia-Pacific Microsc. Conf. (Jeju, Korea)
- 有井達夫(2008.12)医学生物学用超高圧電子顕微鏡の開発と応用。日本電子顕微鏡学会関西支部特別企画講演会(岡崎)
- 濱 清(2008.12)超高圧電子顕微鏡の歴史と期待。日本電子顕微鏡学会関西支部特別企画講演会(岡崎)