皮膚のかさつきは、皮膚のバリア機能が弱まり、肌から水分が蒸発しやすい場合に起こるといわれています。今回、生理学研究所の曽我部隆彰(そかべ・たかあき)助教と富永真琴(とみなが・まこと)教授らの研究チームは、表皮角化細胞(ケラチノサイト)にある温度センサーTRPV4(トリップブイフォー)が体温を感じてカルシウムを細胞に取り込み、ケラチノサイト同士の接着をより強くし皮膚のバリア機能を高めていることを明らかにしました。これによって、冬の乾燥肌など、気温や季節に依存した肌コンディションの変化を防ぐには皮膚温を保つことが重要である可能性を示しました。最も権威のある生化学雑誌Journal of Biological Chemistryで4月22日(電子版)に報告されました。同誌7月号にて"Paper of the week"として注目論文として紹介される予定です。
研究チームが注目したのはTRPV4センサー。このタンパク質は皮膚の温度を感じるセンサーで、カルシウムをケラチノサイトの中に取り込むことが知られています。今回の研究では、TRPV4がβカテニンというタンパク質を介して細胞同士が結合する部位にとどまり、取り込んだカルシウムによってケラチノサイト同士のつながりを強めることが明らかになりました。TRPV4をなくしたマウスではこうした細胞同士のつながりに異常がでることでケラチノサイトによる皮膚のバリア機能が弱まり、皮膚からの水分蒸発量が大幅に増えることが明らかになりました。
曽我部助教は、「冬の乾燥肌などは、皮膚温が低下してTRPV4の働きが悪くなることも一因と考えられる。TRPV4の活性を制御する化粧品・薬剤を開発すれば、肌荒れや皮膚疾患などの改善に役立つ可能性がある」と語っています。
本成果は文部科学省科学研究費補助金の支援を受けて行われました。
1)皮膚の表皮角化細胞(ケラチノサイト)にある温度センサーTRPV4が皮膚の温度を感じて、皮膚バリア機能を高めていた。
2)TRPV4がβカテニンというタンパク質を介して細胞間接着分子と結合し、カルシウムを供給することで細胞同士の結合を緊密に保っていた。
3)TRPV4を無くしたマウスでは、ケラチノサイトの細胞同士のつながりに異常がでて、皮膚からの水分蒸発量が大幅に増えていた。
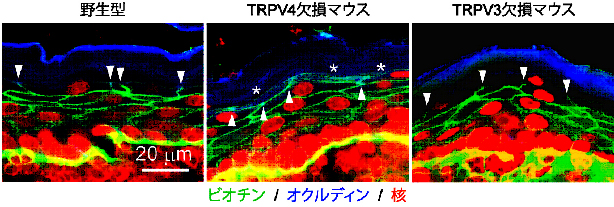
皮下にビオチンという小分子(緑色)を注入しその広がりをみた。正常な場合(野生型、左図)、皮膚表面のケラチノサイトの細胞間接着によるバリア機能があり、ビオチンの拡散は阻止されるが、TRPV4を無くしたマウスではそのバリア機能が失われ、皮膚表面にむかってビオチンの拡散がみられる(中央図、*)。同じ細胞にある別の分子であるTRPV3をなくしたマウスでは、バリア機能に異常はない(右図)。
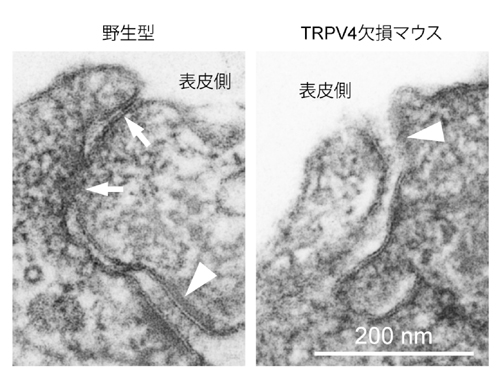
培養したケラチノサイトの細胞間に形成された細胞間接着構造の電子顕微鏡画像。正常な場合(野生型)、バリア機能を発揮する緊密な接着構造(矢印)が形成されており、その下にバリア機能を持たない接着構造(矢頭)が見られる。TRPV4をなくした場合には、バリア機能を持つ接着構造がほとんど形成されていなかった。
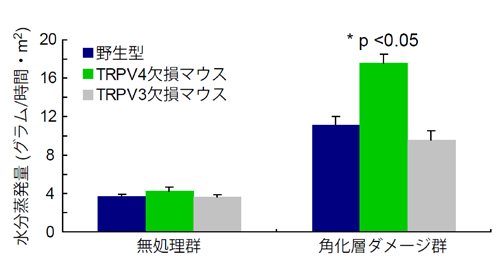
剃毛したマウスの皮膚表面から蒸発する水分量を計測した。無処理群では、いずれのマウスでも大きな違いはない。一方、有機溶媒で角化層にダメージを与えると、TRPV4をなくしたマウスの水分蒸発量が有意に増加した。別のタンパク質であるTRPV3をなくしたマウスでは正常な場合と同様な水分蒸発量であったことから、皮膚バリア機能にTRPV4が重要な役割を果たしていることがわかった。
1)皮膚のバリア機能に関与する温度センサーの働きを解明
ケラチノサイトにあるTRPV4という温度センサーであるタンパク質が、皮膚の温度を感じて機能することで、皮膚のバリア機能を高めていることが明らかになりました。冬の乾燥肌などは、皮膚温が低下してTRPV4の働きが悪くなることも一因と考えられます。TRPV4の活性を制御する化粧品・薬剤を開発すれば、肌荒れや皮膚疾患などの改善に役立つ可能性があります。
The TRPV4 channel contributes to intercellular junction formation in keratinocytes
Takaaki Sokabe, Tomoko Fukumi-Tominaga, Shigenobu Yonemura, Atsuko Mizuno, and Makoto Tominaga
The Journal of Biological Chemistry
285 (24): 18749-18758, 2010.
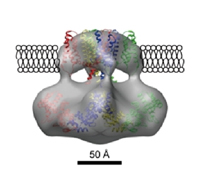
生理学研究所の富永真琴教授と永山國昭教授の共同研究の結果、電子顕微鏡による立体構造解析から、TRPV4分子センサーの分子レベルの構造が明らかになりました。図はTRPV4が細胞表面の"膜"にはまり込んでいる様子を再現したものです。100オングストローム(1億分の1メートル程度)ほどの大きさがあります。(J. Biol. Chem. 285 (2010) page 11210-11218にて発表済)
<研究について>
生理学研究所 細胞生理研究部門
曽我部 隆彰 助教 (そかべ たかあき)
TEL:0564-59-5287、FAX:0564-59-5285
E-mail:sokabe@nips.ac.jp
<広報について>
生理学研究所・広報展開推進室
小泉 周 准教授 (こいずみ あまね)
TEL:0564-55-7722、FAX:0564-55-7721
E-mail:pub-adm@nips.ac.jp