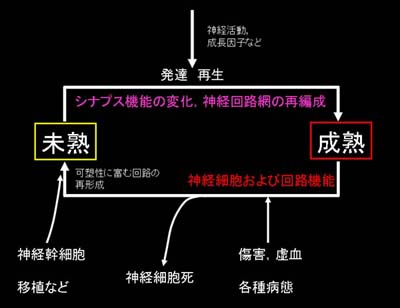
| 発達や再生期に起こる神経回路機能の長期可塑性と神経回路活動を明らかにする。 生後発達初期の脳において神経回路は余剰に形成されます。発達に伴って視覚、聴覚、触覚などの感覚受容器が発達し、外界から様々な刺激を受け、その刺激に応じて神経回路が適切に調律され成熟した神経回路が形成されます。疾患などにおいて神経回路に障害が生じた際、その適切な機能を再取得するため神経回路が再編成されるが、その再編成機構は発達段階の脳に見られるものとよく一致し、このことによって適切な神経回路が再び形成されます。私たちは、このような発達、回復過程に見られる神経回路機能の再編成の機構に注目してグリア細胞、抑制性神経伝達の観点から研究を展開しています。 研究手法としては、2光子顕微鏡を用いたマウスの脳のin vivoイメージングと電気生理学(パッチクランプ法)を軸にしており、必要に応じて分子生物学的手法や免疫組織化学などの手法も用いています。特にフェムト秒レーザーを用いた2光子励起顕微鏡は生理学研究に応用されるようになってまだ間もないものであり、これからますます発展していくと思われます。 |
|
 |
|
| 神経細胞は電気的に活発であるため、これまでの脳研究は神経細胞に主眼がおかれ研究が進められてきました、しかしながら神経細胞は脳内の30%程度を占めるにすぎず、残りの70%程度はグリア細胞といわれる細胞で構成されます。脳内には様々なグリア細胞が存在し、神経細胞と積極的に相互作用し、脳内環境を調節していると考えられています。私たちはそのようなグリア細胞であるミクログリア、アストロサイト、オリゴデンドロサイトに着目して研究を行っています。ミクログリアは脳内免疫担当細胞で、これまで免疫的防御を担っていると考えられ、様々な神経疾患への関与を調べられてきました。その中で私たちはその生理的な機能に着目し。その結果、ミクログリアが神経細胞に突起を伸ばし接触し、神経細胞と神経細胞をつなぐシナプスの活動状態を監視していることを発見しました。また、ミクログリアは虚血時においてシナプスの入れかわりが亢進する部位でシナプスを除去することも発見し、病態時の神経回路再編成に関与すること考えられています。そこで、私たちは、ミクログリアがどのように神経回路再編成を引き起こすのかを研究しています。 次に、もう一つのグリア細胞であるアストロサイトは、脳内の主要なグリア細胞であり、神経細胞への栄養補給、血液脳関門を形成することによる脳内環境の保持に寄与しています。これまでアストロサイトは神経細胞をサポートする役割しか持たないと考えられてきましたが、近年、神経伝達の調節や、シナプス形成・消失を行うなど、神経細胞に積極的に関わることが明らかになっています。そこで私たちは虚血モデルや慢性疼痛モデルを用い、大脳皮質においてアストロサイトの活動が病態時においてどのように変化し、また変化したことによってどのように神経回路再編成に寄与するのかを研究しております。 さらにオリゴデンドロサイトは中枢神経系において軸索周囲に髄鞘を形成するグリア細胞として知られております。髄鞘を形成することによって神経伝導速度を調節し、近年この過程が神経活動依存的であることがわかってきました。このことによってオリゴデンドロサイトは神経細胞の発火のタイミングを調節することができると考えられます。そこで私たちはこれらの変化が学習行動や神経回路再編にどのように寄与するかを調べ、髄鞘の制御が損なわれた際に発火のタイミングが変化し、どのように学習行動を阻害し、神経回路再編を妨げるかを研究しております。 |
|
 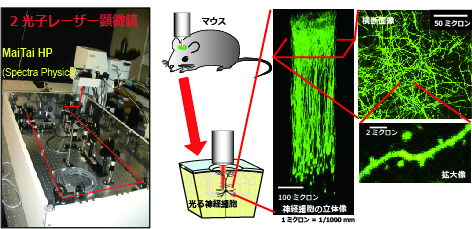 2光子顕微鏡のシステムの図。左は2光子顕微鏡。真ん中は生きたマウスの脳内の神経細胞をイメージングしている図。右は脳表から撮像した大脳皮質神経細胞。 |
麻酔下マウス脳内の神経細胞に突起を伸ばし接触するミクログリア。神経細胞(赤)、ミクログリア(緑) |
|
覚醒下マウス脳内の神経細胞活動(カルシウムセンサーGCaMP6fをAAVで神経細胞に発現させている) |
| 神経伝達物質GABAは神経細胞の興奮性を抑制する役割を持ち、脳が正常に機能するのに重要な役割を果たしています。このGABAの抑制性作用は細胞内のCl-濃度によって決まります。神経細胞の細胞内Cl-濃度を調節する分子としてカリウム-クロライド共輸送体KCC2があります。KCC2はは神経細胞特異的に発現し、細胞内から外へとCl-をくみ出すことにより、細胞内のCl-濃度を制御し、その結果GABAの抑制作用を調節していることがわかっています。これまで幼少期においてKCC2は発現しておらず、細胞内Cl-濃度が高いことによって、GABAが抑制性ではなく興奮性作用を持つことがわかっています。この興奮性の機能が、幼弱期の神経回路構築、再編成の誘導に重要な役割を担います。発達に伴いKCC2の発現は増加し、成熟期には細胞内Cl-濃度が低下するため、GABA機能は抑制作用へと変化し、成熟した神経回路を形成します。一方、成熟期でも虚血や慢性疼痛などの病態時には神経細胞におけるKCC2の発現量が減少するため、興奮-抑制バランスが破綻し、病態行動が惹起されます。またこれらの興奮—抑制バランスは様々な精神疾患、神経疾患で重要であるといわれています。私たちは、KCC2の発現、機能変化に着目し、発達期、病態時に起きる神経回路再編成におけるKCC2、GABA神経伝達の役割について研究しています。 | 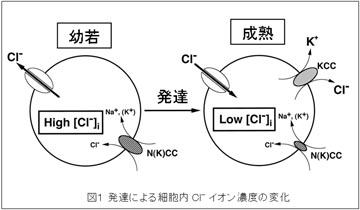 |
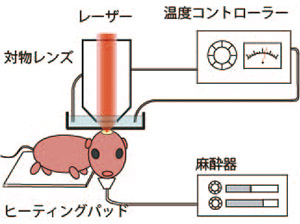 麻酔された幼弱マウスを用いたin vivo イメージングの模式図 |
|
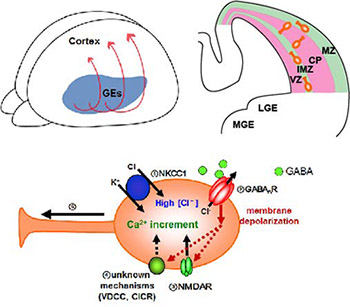 幼弱期には、抑制性神経細胞はGEで生まれ、大脳皮質まで移動し、配置される。この移動の機構として、GABAが興奮性に働くことで抑制性細胞が移動できるこがわかった。 |
|
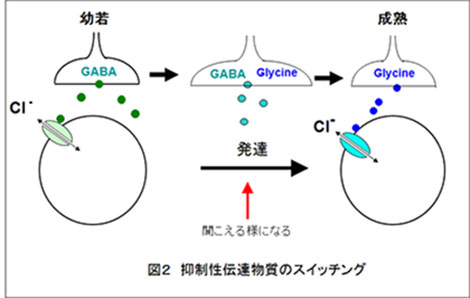
発達期における神経回路の編成には、神経伝達物質受容体のサブユニットや局在の変化と並んで、プレシナプスから放出される伝達物質自体の変化(スイッチング)があげられます。これまで、脳幹の聴覚中継路である内側台形体核(MNTB)から、外側上オリーブ核(LSO)へ抑制性の出力をすることが知られていましたが、当研究室では、このシナプスにおいて神経伝達物質が発達に伴ってGABAからグリシンへとスイッチすることを見出しました(Nabekura et al.,2004. NatNeurosci.)。GABAとグリシンはいずれもCl-チャネルを開口して神経活動を抑制する働きを担いますが、なぜGABAからグリシンへ発達スイッチする必要があるのか、その意義を明らかにするため、当研究室では電気生理学的パッチクランプ法とイメージング法を用いてアプローチしています。また、これと併せてポストシナプスで生じる発達変化についても検討しています。Qドットを用いたグリシン受容体の分子イメージング。緑はシナプス。紫はグリシン受容体。 |
 |
| 鍋倉研究室では、主に、2光子顕微鏡を用いたマウスの脳のin vivoイメージングと電気生理学(パッチクランプ法)を軸に研究をしています。必要に応じて分子生物学や免疫組織化学などの手法も用いています。 | |
| 2光子励起法は、超短パルスレーザーを用いて蛍光物質を励起させる方法です。1光子励起に比べ発生確率の極端に低い2光子励起を近赤外領域の超短パルスレーザーによって引き起こすことにより、従来よりも(1)より低浸襲的に(2)より深部の構造物を、観察できます(詳しくはこちらへ)。 2光子顕微鏡を用いて生きた固体の脳内を観察するためには、特定の細胞に蛍光物質(蛍光蛋白質、蛍光色素)を導入する必要があります。私たちの研究室では主に4つの手法を用いて蛍光物質を導入しています。①蛍光色素の脳内投与。カルシウム指示薬やアストロサイトマーカーなどの色素を脳内に投与することで細胞標識を行います。②特定の細胞に蛍光蛋白質を発現する遺伝子改変マウス。神経細胞特異的に緑色蛍光蛋白質(GFP)を発現する遺伝子改変マウスを用い、神経細胞の微細構造を観察することができます。③子宮内エレクトロポレーション法を用いた蛍光蛋白質導入。胎児脳に蛍光蛋白質のDNAをエレクトロポレーションを用いて導入することができます。④アデノ随伴ウイルス(AAV)を用いた蛍光蛋白質導入法。これらの方法を実験目的により使い分けることで、生きた固体脳における神経・グリア細胞のダイナミックな活動・構造変化を観察することが可能となります。 | |
| 生体、特に脳や骨格筋、心筋の細胞は、通常の外に対して負に帯電していて、興奮すると一時的に正の電位になります。すなわち細胞膜は電気を発生しているのです。一方で、細胞と細胞の間の情報伝達は殆ど化学物質によって行われます。そのため、物質(伝達物質)に対する細胞(受容体)の応答を観察することは機能解析における基本的でかつ重要な研究で、パッチクランプ法などの電気生理学的手法を用いて、世界的にも多くの研究が行われています。 パッチクランプ法は、正常過程の検索(生理学)や異常時(各種病態)における機能変化、薬による機能回復や副作用(薬理学)、各種病態遺伝子による情報伝達修飾(分子生物学)などを検討する際に細胞膜の電気的な現象を見る非常に有効な手法です。また、パッチクランプ方法は20世紀の10大発明のうちの一つに選ばれた方法で、生体機能解析、薬剤効果検定や導入した遺伝子の機能解析などにもっとも優れた方法です。 |
|
  (左)実験風景。(右)培養神経細胞でパッチクランプ記録をしている図。 |
|