多くの方はふとした時に次のような疑問を持ったことがあると思います。
なぜ昔体験した出来事を覚えているのか?
脳は機械と異なって柔らかい組織ですし、それらを構成する細胞内のタンパク質や脂質の多くは拡散しています。また、脳には多くの血管が入り込んでいて血流もあります。なぜ、このような場所に記憶を長期間保存しておくことができるのでしょうか?世の中には記憶について書かれている本が多くありますので、手に取ってみた方や購入して読んだ方も多いと思います。しかしそこには皆さんが知りたかった記憶の保存の仕組みがきちんと書かれていたでしょうか?そして、皆さんの疑問は解消したでしょうか?おそらく記憶の仕組みについて理解し、納得することはできなかった筈です。当然のことです。記憶の仕組みは、手掛かりのようなものは得られているものの、まだ殆ど分かっていないと言ってよい段階なのです。我々の研究室では最先端の光学顕微鏡技術と独自開発のプローブを駆使して脳組織細胞を可視化して操作することによって記憶の実体を明らかにしたいと考えています。
1、2光子蛍光寿命イメージング顕微鏡法による脳組織内生化学反応のイメージング
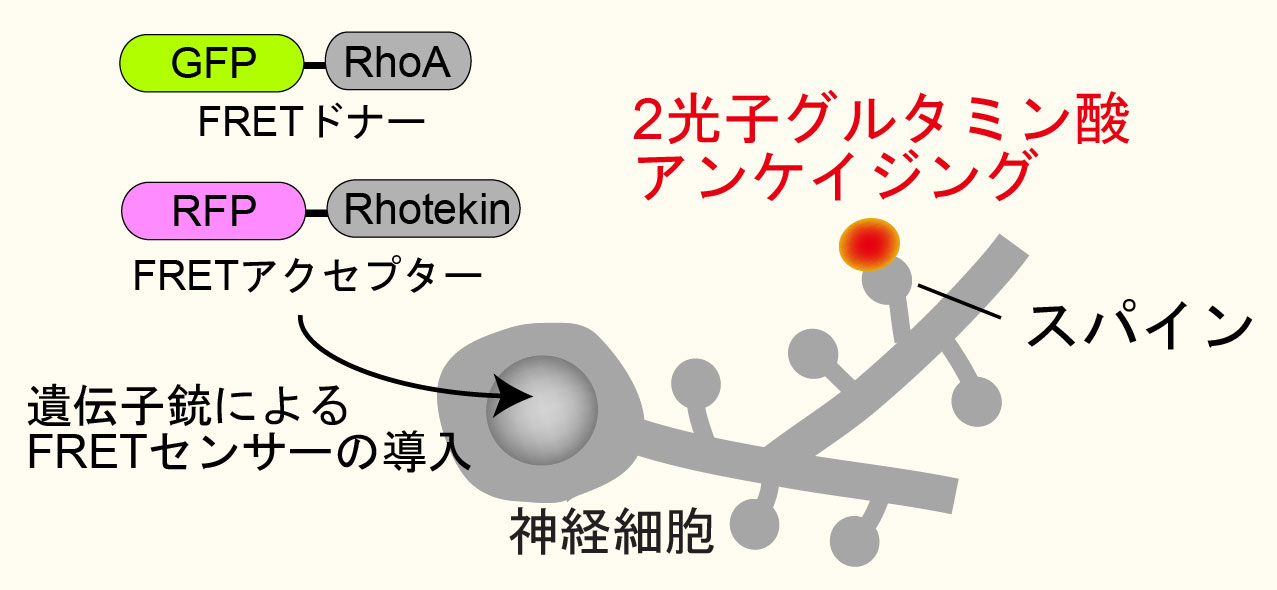
脳組織は主に神経細胞、グリア細胞から構成されており、その隙間を縫うように血管が存在しています。現在までに多くの神経学者らの努力によって、神経細胞のネットワーク、特に、神経細胞同士を繋いでいるシナプスと呼ばれる領域が記憶にとって重要な役割を果たしていることが分かってきました。このような背景のもと、私達は、世界最先端の手法である2光子蛍光寿命イメージング顕微鏡法(2-photon fluorescence lifetime imaging:2pFLIM、原理の説明はこのページの最後尾にあります)を用いて、生きた脳組織内の神経細胞シナプス内の様々な反応を可視化することで、シナプスとその可塑性の仕組みを明らかにしたいと考えています。
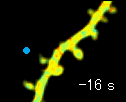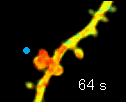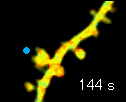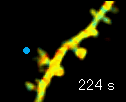
左の動画は、2pFLIMで撮影したラットの海馬スライス(厚さ350ミクロン)内の神経細胞の樹状突起とシナプス(スパイン、直径0.5ミクロン程度)です。水色で示したスパインに、神経伝達物質であるグルタミン酸を局所投与した時の様子を示しています。スパインの体積が大きくなっていますが、これはスパインの可塑的構造変化と呼ばれるもので、神経細胞間の信号の伝わり易さと関係があると考えられています。また、色が赤く変化しているのは細胞内の信号分子である低分子量Gタンパク質であるRhoAが活性化する様子を表しています(Murakoshi et al. Nature 2011)。このように、2pFLIMを用いることで、シナプスの形態を観察しながら、その内部で起こっている様々な反応を可視化することができます。
近年ではこのような形態変化が多数のスパインで起こることによって記憶形成を行うという仮説もあり、まさに今、私達は記憶が出来る瞬間を見ているのではないかという大きな期待感があります。
2、細胞内生化学反応を高感度に可視化するための蛍光プローブの開発2pFLIMでタンパク質の活性や分子間相互作用などの生化学反応を可視化するためには、各種蛍光プローブを細胞内に導入する必要があります。すなわち、細胞内生化学反応を正確に、かつ高感度に捉えるためには顕微鏡技術だけではなくプローブの開発も極めて重要になります。我々は遺伝子工学技術を用いて、蛍光タンパク質などの蛍光プローブを遺伝子改変し、各種シグナル分子動態を高感度で検出するためのプローブ開発にも力を入れています。このような新規のプローブを自分たちで開発し、2pFLIMに応用することによって、これまで検出できなかった未知の反応を捉えたり、様々な生化学反応を同時に可視化することができるようになります。
左の動画では、CaMKIIと呼ばれる神経細胞内分子の活性化(構造変化)を2pFLIMで可視化しています。上記と同様に、水色で示したスパイン(直径0.5ミクロン程度)に神経伝達物質であるグルタミン酸を局所投与した時の様子を示しています。色が一瞬赤く変化しているのがCaMKIIの活性化を示しています。このようなイメージングには蛍光タンパク質をCaMKIIに融合したプローブを導入する必要がありますが、プローブの性能は細胞毎に大きなバラつきがあり、高精度で計測することはそれ程簡単ではありません。我々は大腸菌を用いてこのようなプローブを分子進化させることで高性能化・高精度化する試みも行っています。(Shibata et al. PLoSONE 2015)。
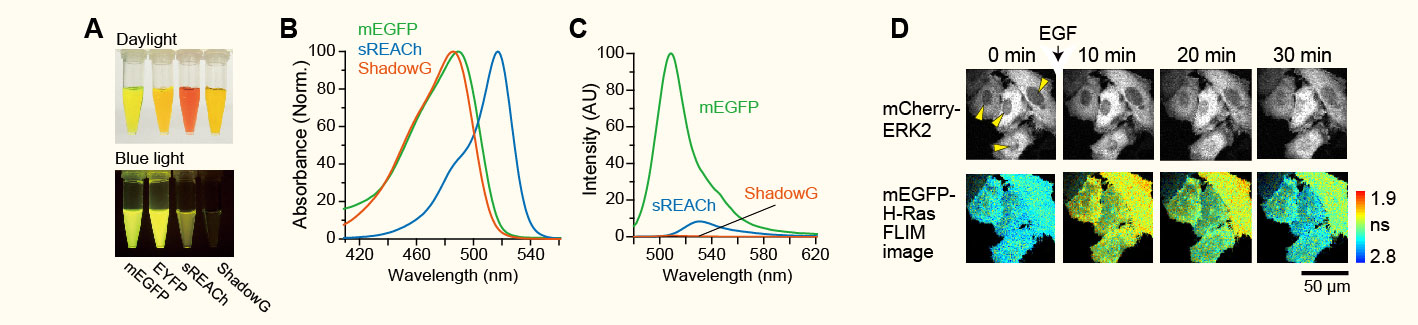
新規蛍光タンパク質ShadowGの開発(Murakoshi et al. Scientific Reports 2015より転載)。
(A)大腸菌より精製した蛍光タンパク質。(B)各蛍光タンパク質の吸収スペクトル。(C)各蛍光タンパク質の蛍光スペクトル。
(D)ShadowGを用いたH-Rasのプローブにより、その下流分子であるERK2との同時観察が可能になった。
3、細胞内生化学反応を阻害する光操作分子(paAIP2)の開発上記のような分子活性化イメージングを用いると細胞内で起こる様々な現象を知ることができます。しかしながら、現象を見るだけでは各分子の機能は分かりません。そこで私達は分子イメージングだけでなく、光を使って分子機能や活性を阻害する試みも行っています。例えば、最近私達は遺伝子コードされた光応答性シグナル分子阻害ペプチドの開発に成功しました(Murakoshi et al. Neuron 2017)。光照射を行っている間のみCaMKIIと呼ばれる細胞内タンパク質の活性を阻害することができます。つまり、光照射のオン・オフに対応してタンパク質の活性を可逆的に阻害することができます。このような光応答性分子を用いて、シナプスや生きた動物での分子機能を調べることができるようになりつつあります。
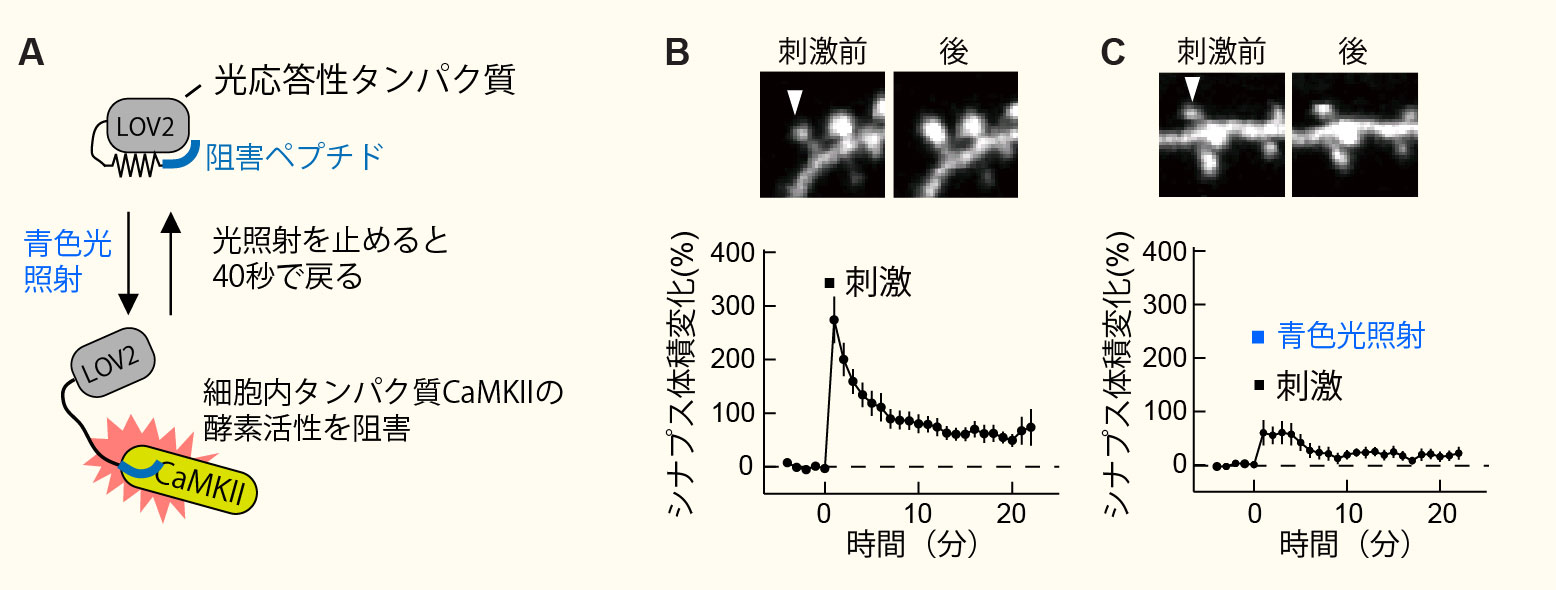
新規光応答性CaMKII阻害ペプチドの開発(Murakoshi et al. Neuron 2017より改変転載)。
A, 光応答性ペプチド(paAIP2)の模式図。
B, 海馬い神経細胞のシナプスにグルタミン酸を局所投与するとシナプス(スパイン)の体積が大きくなる。
C, 青色光照射によりCaMKIIの活性を阻害するとスパインの体積は増大しない。
4、光応答性CaMKII(Photoactivatable CaMKII: paCaMKII)の開発CaMKIIは記憶や学習に関与する神経細胞内の主要な酵素で、12量体を形成してシナプスに存在しています。最近私達はCaMKIIを遺伝子改変(青色光受容タンパク質LOV2と融合)することにより光応答性CaMKIIの開発(paCaMKII)に成功しました。paCaMKIIをシナプス内で活性化させるとシナプス長期増強を惹起することができます。今後、paCaMKIIを用いてシナプス長期増強のメカニズムを詳細に明らかにしていきます。
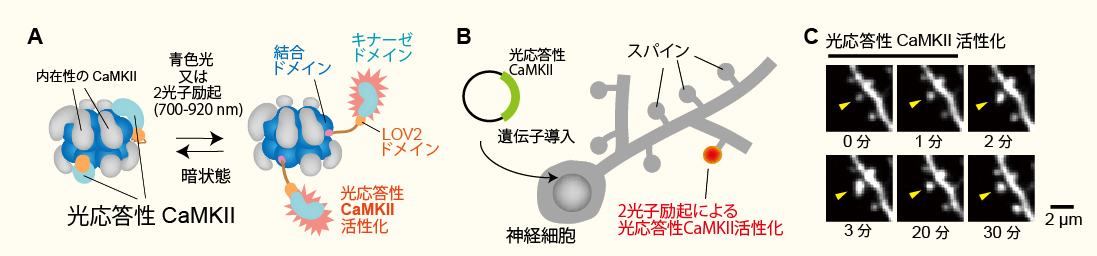
新規光応答性CaMKIIの開発(Shibata et al. Nature Communications 2021より改変転載)。
A, 光応答性CaMKIIの模式図。
B, 光応答性CaMKIIをコードするDNAを海馬スライスの神経細胞に導入。シナプス(スパイン)内で
2光子励起(レーザー波長900 nm)で光応答性CaMKIIを活性化させる。
C, 光応答性CaMKIIを活性化させたスパインの画像。矢印で示したスパインの体積が増大していることに着目。
5、生きた個体動物の脳を可視化・操作する 私達は独自に開発した光応答性CaMKIIを利用して生きたマウス内のシナプスの光操作にも成功しています。今後、この光応答性CaMKIIをさらに遺伝子改変することにより、記憶に関与するシナプス集団の光操作を目指します。
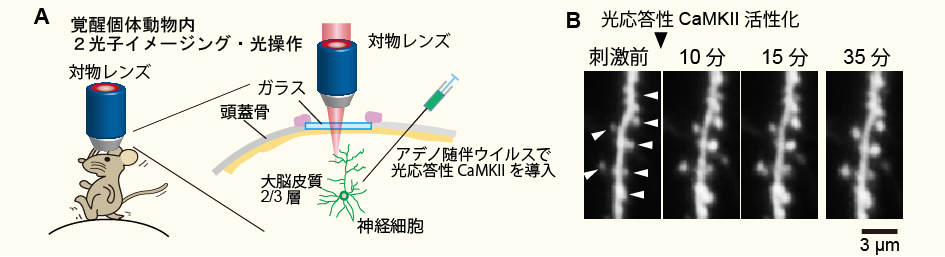
覚醒マウス内シナプスの光操作(Shibata et al. Nature Communications 2021より改変転載)。
A, 光応答性CaMKIIと黄緑色蛍光タンパク質(Clover)をアデノ随伴ウイルスによってマウスの大脳皮質に導入する。
B, 覚醒状態のマウス脳内を2光子顕微鏡で可視化。10マイクロメートル程度の領域を900 nm(2光子励起)で照射することによりスパイン体積の増大を誘起することができた。
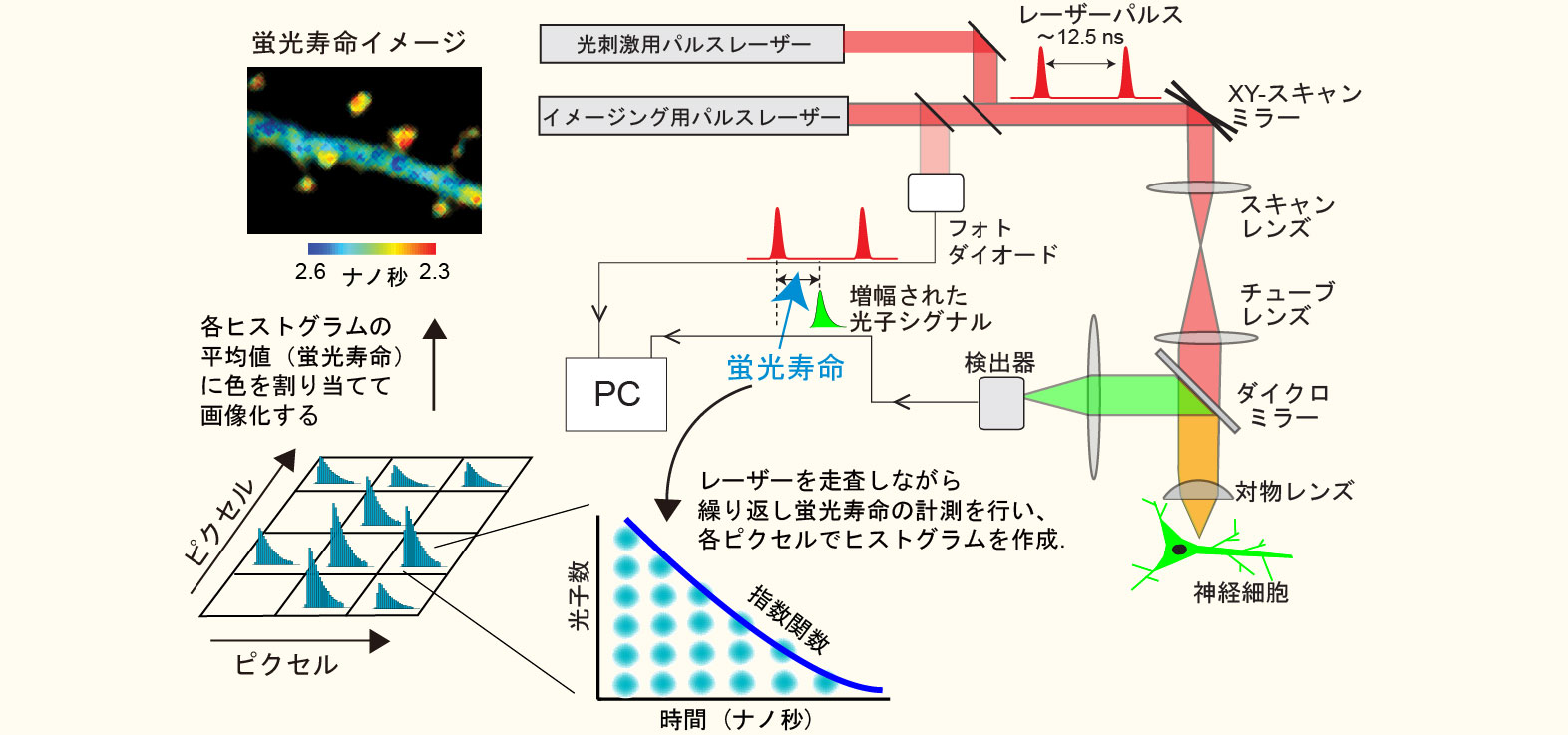
2光子蛍光寿命イメージング顕微鏡法(2pFLIM)って何?
蛍光寿命とは、励起光により蛍光分子が高いエネルギー状態に遷移してから蛍光光子を放出するまでの時間(大抵の蛍光分子では数ナノ秒程度)です。よく混同されるのですが、蛍光退色(発色団が不可逆的に壊れる)とは全く異なる現象です。2pFLIMは装置としては比較的シンプルで、一言でいうと,通常の二光子顕微鏡にレーザー励起パルスとサンプルからの蛍光放出の時間差(蛍光寿命)を測定する機能を付加したものです。蛍光寿命測定を試料面でレーザーを走査しながら何度も繰り返すことにより各ピクセルで得られた蛍光寿命をヒストグラムにします。その上で、各ヒストグラムの平均値を算出し、色割り当てを行うことで蛍光寿命イメージを構築します。
蛍光寿命は温度、pH、イオン濃度といった外部環境によって変化しますが、特に利用価値が高いのが蛍光共鳴エネルギー移動(FRET)による蛍光寿命の短縮です。今、低分子量Gタンパク質であるRhoAの活性化を検出することを考え(項1の図参照)、RhoAにGFPを融合させたものをFRETのドナーとし、活性型RhoAに結合するペプチド(Rhotekinの RhoA結合ドメイン)にRFPを融合したものをアクセプターとします。GFP-RhoAが活性化すると、RFP-Rhotekinが結合し、GFPからRFPへのFRETが起きますが、このときGFPの蛍光寿命が短くなるので2pFLIMで可視化することができます。