神経細胞を光で操作し、サルの手を動かすことに成功
内容
|
光で活性化する物質を細胞に発現させ、光によって細胞の機能を制御する技術(オプトジェネティクス、光遺伝学)は、脳の刺激方法を革新し、脳の仕組みの解明に大きく貢献しています。オプトジェネティクスは、ネズミなどにおける研究で盛んに用いられる一方、ヒトに近い霊長類(ニホンザルなどマカクサル)における研究においては、眼の動きに関する研究以外では、ことごとく失敗していました。 今回、自然科学研究機構生理学研究所の南部篤教授、東北大学大学院の虫明元教授らの研究チームは、遺伝子を導入する技術や光照射方法などを工夫することにより、オプトジェネティクスでサルの手を動かすことに世界で初めて成功しました。今回の成果は、非ヒト霊長類へのオプトジェネティクスの活用を促進させ、将来的には光による脳深部刺激療法*1などヒトの病気治療への応用させることも期待されます。本研究成果は、Nature Communications 誌(日本時間6月26日18時解禁)で公開されました。 |
生きた動物の神経細胞を制御する方法として、電気刺激によって神経細胞を強制的に活性化させる技術が古くから用いられてきましたが、電気刺激では刺激を与えた周囲のすべての細胞を活性化させてしまい、特定の神経細胞のみ活動させることは不可能でした。近年開発されたオプトジェネティクスは、光照射のオン/オフによって細胞の活動を制御する技術で、特定の細胞群や特定の神経経路のみに光で活性化する物質を発現させることにより、これらの活動を制御(興奮、あるいは場合によっては抑制)することが可能となりました。この技術は脳の仕組みを研究する際に非常に有用で、ネズミなどにおける研究では盛んに用いられています。ヒトの脳を理解するために、ヒトに近い霊長類(サル)においてもオプトジェネティクスの活用が望まれていましたが、これまでの成功例は少なく、限られた研究でしか利用されていませんでした。
光で神経細胞の活動を操作するためには、まず光で活性化するチャネルロドプシンという物質を遺伝子導入により細胞に発現させる必要がありますが、これまでの技術では、このチャネルロドプシンをサルの脳内で効率的に発現させることが困難でした。そこで研究チームはまず、チャネルロドプシンをサルの脳の神経細胞に効率良く発現させるため、サルに適したアデノ随伴ウイルスベクター*2の探索を行いました。脳の大脳皮質運動野と呼ばれる領域は、体の運動をコントロールしており、電気刺激を加えると刺激の場所に応じて足・手・顔など体の一部にはっきりとした運動が生じます。本研究では、大脳皮質運動野のうち手の運動に関与する領域を正確に同定し、最適なウイルスベクターを投与した結果、周辺の神経細胞にチャネルロドプシンを発現させることに成功しました(図1)。
次に、チャネルロドプシンが発現している神経細胞に光照射を行うことで、実際に手の運動を引き起こすことができるのかを検証しました。本研究では、脳の神経応答を記録しながら光照射あるいは電気刺激を行うため、神経細胞の活動を記録するための電極、光照射を行うための光ファイバー、電気刺激を与えるための電極の3つが一体となった電極(オプトロード)を独自に作製しました。そして、このオプトロードを大脳皮質運動野に挿入し、チャネルロドプシンを発現している神経細胞に光を照射しました。その結果、運動野の神経細胞を興奮させ、目で見て分かる明確な手の運動を起こすことに成功しました(図2)。
また光照射と、電気刺激とを比較しました。オプトロードを用いて、光照射によって引き起こされる運動と、電気刺激によって引き起こされる運動を詳細に比較したところ、光照射と電気刺激は、同じ筋肉に対して同程度に強い活動を生じさせることがわかりました。すなわち、光刺激は電気刺激と比べて、遜色ない有効な刺激方法であることが確認できました。
南部教授は「オプトジェネティクスは、光によって特定の細胞群や特定の神経経路の活動を制御することを可能にした画期的な技術で、脳機能の研究に不可欠なものとなりつつありますが、霊長類の行動に影響を及ぼすことに成功した例は世界的にも非常に少なく、眼球の運動に関する報告がいくつかあるだけでした。今回の私たちの成果は、オプトジェネティクスの霊長類への適用の扉を開くものであり、さらには光による脳深部刺激療法などヒトの病気治療への応用にもつながる可能性があります。」と話しています。
用語説明
*1 脳深部刺激療法:パーキンソン病やジストニア、手の震えなどの中で、薬では効果が得られない神経難病に対して、脳の深部に刺激電極を留置し、心臓ペースメーカーと同様の装置で、電気刺激を与えると治療することができる。2000年より保険適用となっている。
*2 ウイルスベクター:遺伝子の運び屋。遺伝子を細胞に導入するという、ウイルスが本来持っている性質を利用する。このうちアデノ随伴ウイルスベクターは病原性もなく安全とされており、ヒトの遺伝子治療にも用いられている。
助成金など
本研究は、文部科学省科学研究費補助金(新学術領域研究「オシロロジー」「適応回路シフト」、基盤研究、国際共同研究加速基金)、AMED「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」「戦略的国際脳科学研究推進プログラム(国際脳)」、CREST「オプトバイオ」(光の特性を活用した生命機能の時空間制御技術の開発と応用)の補助を受けて行われました。



図1
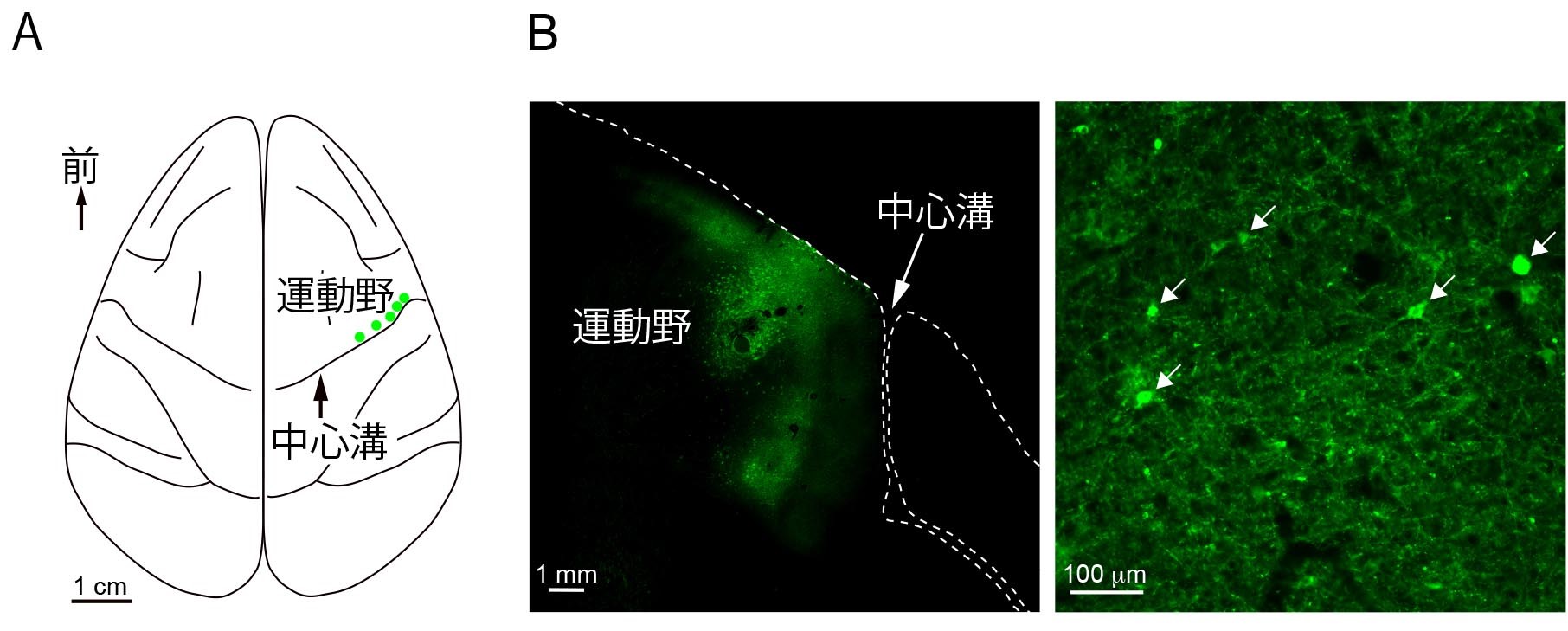 図1. (A)ニホンザル大脳皮質運動野のアデノ随伴ウイルスベクター投与部位(緑色の丸)。(B)大脳皮質運動野におけるチャネルロドプシンの発現(緑色に光って見える領域)を観察した蛍光顕微鏡写真。右は左の一部を高倍率で観察したものであり、チャネルロドプシンを発現している神経細胞が見える(矢印)。
図1. (A)ニホンザル大脳皮質運動野のアデノ随伴ウイルスベクター投与部位(緑色の丸)。(B)大脳皮質運動野におけるチャネルロドプシンの発現(緑色に光って見える領域)を観察した蛍光顕微鏡写真。右は左の一部を高倍率で観察したものであり、チャネルロドプシンを発現している神経細胞が見える(矢印)。
図2
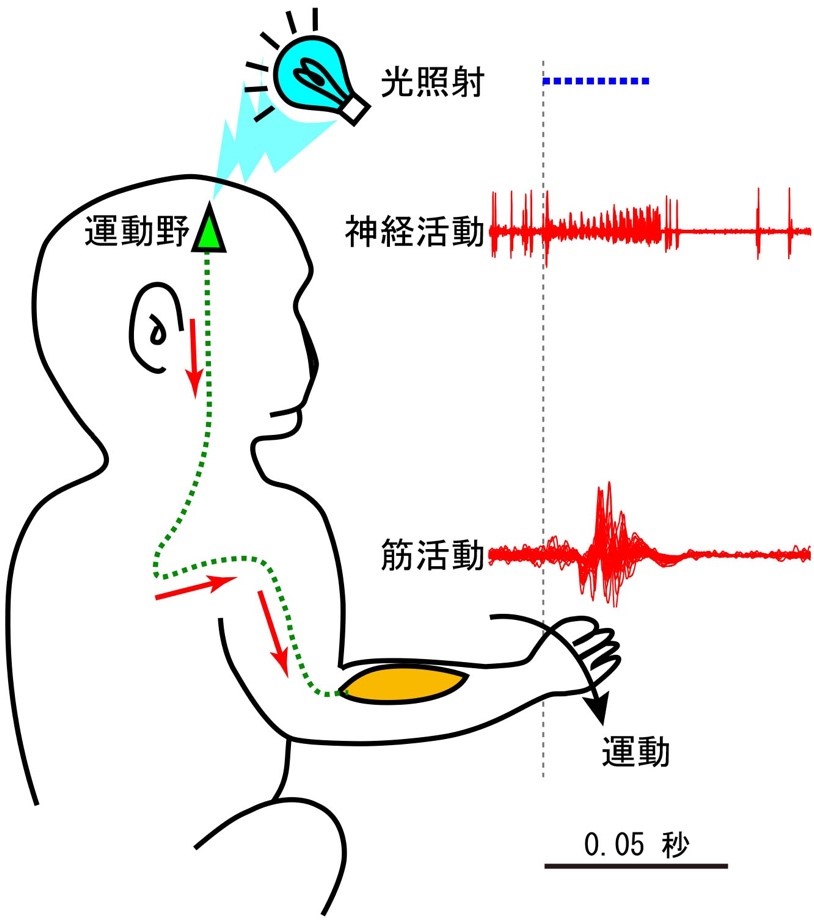
図2. 実験のセットアップ。チャネルロドプシンを発現させたニホンザルの大脳皮質運動野に青色レーザー光を照射する。神経活動とともに、筋活動と手の運動が誘発された。
今回の発見
- チャネルロドプシンという光感受性物質を、サルの脳神経細胞に効率良く発現させるために最適なアデノ随伴ウイルスベクターの探索を行いました。
- オプトジェネティクスを用いて、サル脳の大脳皮質運動野の神経細胞を効率よく興奮させ、手の運動を引き起こすことに成功しました。
- この成果は、オプトジェネティクスの非ヒト霊長類への適用の扉を開いただけでなく、さらには光による脳深部刺激療法などヒトの病気治療への応用にもつながるものと期待できます。
この研究の社会的意義
今回の成果によって、霊長類を用いた脳研究においてオプトジェネティクスの活用が進むことにより、ヒトの脳機能の解明に大きく近づけると考えられます。さらに、ヒトへの応用も考えられます。重症のパーキンソン病などに対して電気刺激による脳深部刺激療法が有効ですが、オプトジェネティクスを用いた光による脳深部刺激療法など病気の新しい治療法の開発にもつながるものと期待できます。
論文情報
Forelimb movements evoked by optogenetic stimulation of the macaque motor cortex
Hidenori Watanabe, Hiromi Sano, Satomi Chiken, Kenta Kobayashi, Yuko Fukata, Masaki Fukata, Hajime Mushiake, Atsushi Nambu
Nature Communications. 2020年 6月26日号
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 生体システム研究部門
教授 南部篤 (ナンブアツシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
<AMED事業について>
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
戦略的国際脳科学研究推進プログラム
<東北大学の研究について>
東北大学大学院 医学系研究科 生体システム生理学分野
教授 虫明 元(ムシアケハジメ)
<東北大学の研究広報について>
東北大学大学院医学系研究科・医学部広報室
リリース元



自然科学研究機構 生理学研究所
東北大学大学院医学系研究科
日本医療研究開発機構

