ドーパミン異常と学習・記憶の関係を表す計算モデルの開発に成功
―精神疾患・運動障害の原因解明に期待―
内容
|
ドーパミンの情報伝達は、動物の学習・記憶に重要であると同時に、その異常は統合失調症をはじめとする様々な精神疾患や運動障害の原因となります。しかし、ドーパミンの情報伝達は非常に複雑で様々な要因が関わっているため、総合的理解は難しく、ドーパミンの情報伝達を説明できる計算モデルの開発が進んでいます。今回、自然科学研究機構・生理学研究所の浦久保秀俊特任助教および窪田芳之准教授らの研究グループは、ドーパミンの情報伝達におけるアクセルとブレーキのバランスの崩れが、学習・記憶に異常をもたらすことを計算モデルを用いて示しました。本研究は、東京大学大学院医学系研究科の河西春郎教授(東京大学国際高等研究所ニューロインテリジェンス国際研究機構主任研究者)および柳下祥講師、京都大学大学院・情報学研究科の石井信教授(同 連携研究者)との共同研究であり、成果はPLoS Computational Biology誌(日本時間2021年10月1日午前3時解禁)に掲載されました。 本研究は、文部科学省・科学研究費助成事業、JST戦略的創造研究推進事業CREST、東京大学国際高等研究所ニューロインテリジェンス国際研究機構、日本医療研究開発機構の支援を受けて行われました。 |
研究の背景
ドーパミンの情報伝達は、動物の学習・記憶に重要であるとともに、その異常は統合失調症をはじめとする様々な精神疾患・運動障害に関係することが知られています。また、学習や記憶にはシナプス可塑性(注1)と呼ばれるシナプスの柔軟な変化が重要であること、線条体(注2)と呼ばれる脳の領野においては、シナプス可塑性はドーパミン信号の一過的な減少(ドーパミン減少)を引き金に生じることが分かっています。
しかしドーパミンの情報伝達は非常に複雑で、様々な要因が関わっているため、個々の症例や実験から、総合的に精神疾患・運動障害の原因を理解することは難しいのが現状です。そこで研究グループは、これまでドーパミンの複雑な情報伝達を説明する計算モデルの開発を進めてきました。計算モデル上の様々なパラメータを操作・観察することで、ドーパミン異常による病気の原因を予測することが可能になり、治療に役立つ可能性があります。これまでの研究で、シナプス可塑性を導く情報伝達の計算モデルの開発に成功していましたが(浦久保ら, 2020; PLoS Comput Biol 16(7): e1008078)、“ドーパミン減少”がどのようにシナプス可塑性を導いて学習や記憶を行っているのか、メカニズムは分かっていませんでした。
しかしドーパミンの情報伝達は非常に複雑で、様々な要因が関わっているため、個々の症例や実験から、総合的に精神疾患・運動障害の原因を理解することは難しいのが現状です。そこで研究グループは、これまでドーパミンの複雑な情報伝達を説明する計算モデルの開発を進めてきました。計算モデル上の様々なパラメータを操作・観察することで、ドーパミン異常による病気の原因を予測することが可能になり、治療に役立つ可能性があります。これまでの研究で、シナプス可塑性を導く情報伝達の計算モデルの開発に成功していましたが(浦久保ら, 2020; PLoS Comput Biol 16(7): e1008078)、“ドーパミン減少”がどのようにシナプス可塑性を導いて学習や記憶を行っているのか、メカニズムは分かっていませんでした。
研究内容
研究グループは、開発した計算モデルの詳細な解析から、ドーパミン減少が有効に伝達されるためにはアクセル分子とブレーキ分子の濃度バランスが重要であることを発見しました。D2R(ドーパミンD2受容体)は、ドーパミン信号を抑制し、ブレーキをかける働きをします(図1A)。一方でRGS(regulator of G protein signaling)はドーパミンの信号を活性化し、アクセルをかける働きをします(図1A)。複雑な計算モデルから“ドーパミン減少”が伝達される条件を抽出・定式化したところ、(1)アクセル分子RGSとブレーキ分子D2Rの濃度のバランスがとれていること、(2)アクセル分子RGSの濃度が十分に高いこと、という2つの条件が必要であることが分かりました(図1B、青領域と赤領域)。
実際に、生体内でのアクセル分子とブレーキ分子の濃度を測った過去の実験と照らし合わせたところ、正常なマウスでは両分子の濃度は成長に伴って共に上昇し、バランスが保たれることを再発見しました(図1B、緑点→灰点)。統合失調症ではブレーキ分子は過剰に活性化しますが、アクセル分子は減少しており、ブレーキ分子側へバランスを崩しています(図1B、青点)。反対に、運動障害の一種であるDYT1ジストニアでは、ブレーキ分子が減少する一方、アクセル分子濃度は増大し、アクセル分子側へとバランスを崩しています(図1B、赤点)。実際に、統合失調症ではシナプス可塑性が生じにくくなること、DYT1ジストニアではシナプス可塑性が過剰に生じることも報告されています。いずれの実験結果も、計算モデルの予測と合致しました。
これらの結果から、健康な脳においては“ドーパミン減少”の伝達に必要な分子濃度のパラメータ調整が行われていること、精神疾患・運動障害においては、パラメータ調整に失敗していることが分かりました。
実際に、生体内でのアクセル分子とブレーキ分子の濃度を測った過去の実験と照らし合わせたところ、正常なマウスでは両分子の濃度は成長に伴って共に上昇し、バランスが保たれることを再発見しました(図1B、緑点→灰点)。統合失調症ではブレーキ分子は過剰に活性化しますが、アクセル分子は減少しており、ブレーキ分子側へバランスを崩しています(図1B、青点)。反対に、運動障害の一種であるDYT1ジストニアでは、ブレーキ分子が減少する一方、アクセル分子濃度は増大し、アクセル分子側へとバランスを崩しています(図1B、赤点)。実際に、統合失調症ではシナプス可塑性が生じにくくなること、DYT1ジストニアではシナプス可塑性が過剰に生じることも報告されています。いずれの実験結果も、計算モデルの予測と合致しました。
これらの結果から、健康な脳においては“ドーパミン減少”の伝達に必要な分子濃度のパラメータ調整が行われていること、精神疾患・運動障害においては、パラメータ調整に失敗していることが分かりました。
社会的意義
今回の知見にもとづいて、統合失調症、DYT1ジストニアをはじめとするドーパミン異常に伴う様々な精神疾患・運動障害の原因の理解が進み、よりよい治療法が開発されることが期待されます。
研究助成
本研究は日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」、科学技術振興機構(JST)CREST「光の特性を活用した生命機能の時空間制御技術の開発と応用」「細胞内現象の時空間ダイナミクス」、東京大学国際高等研究所ニューロインテリジェンス国際研究機構(IRCN)、文部科学省科学研究費補助金(新学術領域研究「脳情報動態を規定する他領野連関と並列処理」、基盤研究)の支援を受けて行われました。
今回の発見
- ドーパミンの情報伝達におけるアクセル分子RGSとブレーキ分子D2Rのバランスの崩れが、学習・記憶に異常をもたらすことを計算モデルを用いて示しました
- 正常な発達においてアクセルとブレーキのバランスは保たれますが、統合失調症やDYT1ジストニアではバランスが崩れていることが分かりました。
- ドーパミン異常に伴う様々な精神疾患・運動障害の原因の理解・新たな治療法の開発に役立つことが期待されます。
用語解説
注1)シナプス可塑性:神経細胞(ニューロン)は、多数の他ニューロンからシナプスを介して伝達信号を受けるが、その伝達強度が特定の刺激に応じて可塑的に変化する現象のこと。学習・記憶に重要であると考えられている。ここでは、特に線条体側坐核におけるD2Rを発現する中型有棘神経細胞への興奮性シナプス入力に対するシナプス長期増強のことを指す。
注2)線条体:大脳皮質と視床・脳幹を結びつけている神経核のひとつ。報酬に関わる学習に深く関係していることが知られている。
図1 ドーパミン減少信号の検出にはブレーキ分子D2Rとアクセル分子RGSのバランスが必要。
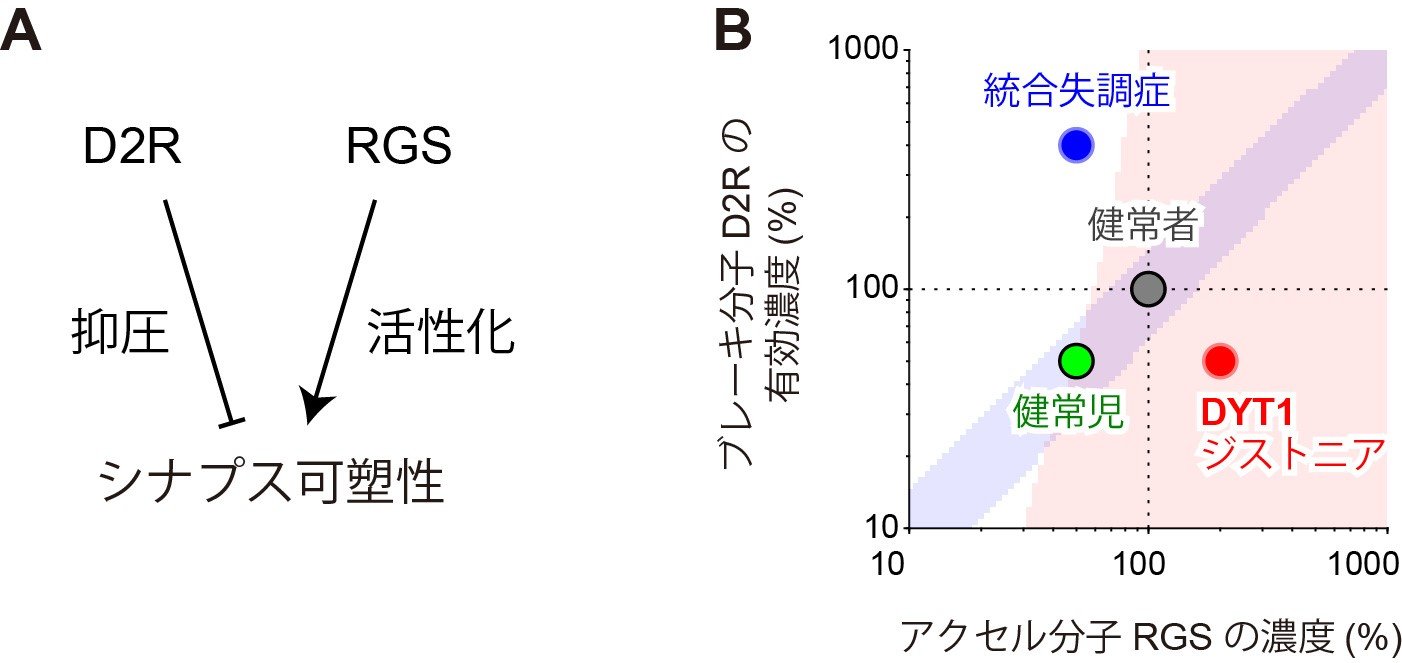
(A)ブレーキ分子D2Rとアクセル分子RGSの作用。
(B)正常なシナプス可塑性のためには、(1)RGSとD2Rの濃度のバランスが保たれていること(青領域)、(2)RGSの濃度が十分に高いこと(赤領域)が必要。正常な発達(緑点→灰点)ではバランスが保たれているが、統合失調症(青点)とDYT1ジストニア(赤点)はバランスが崩れている。
(B)正常なシナプス可塑性のためには、(1)RGSとD2Rの濃度のバランスが保たれていること(青領域)、(2)RGSの濃度が十分に高いこと(赤領域)が必要。正常な発達(緑点→灰点)ではバランスが保たれているが、統合失調症(青点)とDYT1ジストニア(赤点)はバランスが崩れている。
論文情報
The critical balance between dopamine D2 receptor and RGS for the sensitive detection of a transient decay in dopamine signal.
Hidetoshi Urakubo, Sho Yagishita, Haruo Kasai, Yoshiyuki Kubota, Shin Ishii.
PLoS Computational Biology. (日本時間2021年10月1日午前3時掲載)
Hidetoshi Urakubo, Sho Yagishita, Haruo Kasai, Yoshiyuki Kubota, Shin Ishii.
PLoS Computational Biology. (日本時間2021年10月1日午前3時掲載)
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 脳機能・計測支援センター電子顕微鏡室
特任助教 浦久保秀俊 (ウラクボヒデトシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
東京大学国際高等研究所 ニューロインテリジェンス国際研究機構 広報担当
自然科学研究機構 生理学研究所 脳機能・計測支援センター電子顕微鏡室
特任助教 浦久保秀俊 (ウラクボヒデトシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
東京大学国際高等研究所 ニューロインテリジェンス国際研究機構 広報担当

