慢性痛発症の「グリアスイッチ」発見
-難治性疼痛の治療法開発と脳回路の基本原理解明に期待-
概要
山梨大学医学部薬理学講座及び同山梨GLIAセンターの小泉修一教授及び医学部医学科5年生檀上洋右さんらのグループは、原因や治療法が不明な慢性痛である「神経障害性疼痛を引き起こす「スイッチ」を発見しました。自然科学研究機構生理学研究所 鍋倉淳一所長、福井大学医学部 深澤有吾教授、金沢大学医薬保健研究域医学系 石川達也助教らが協力しました。
神経障害性疼痛1)は本邦で600万人以上もの方が苦しんでいる難治性の慢性痛です。この疼痛の原因には不明点が多く、また治療法も確立されていません。研究チームは、神経障害性疼痛モデルマウスを用いた研究により、この慢性痛の引き金となるスイッチの役割を果たす「mGluR52)」というタンパク質を見出しました。このmGluR5は、末梢の知覚神経が傷害されたときに、大脳皮質一次体性感覚野(S1)3)のアストログリア4)と呼ばれるグリア細胞で選択的に発現することでアストログリアの機能をONにするグリアスイッチで、これによりアストログリアはシナプスをつなぎ替える物質を産生し、S1の神経回路の繋がり方を変えることで、脳が痛みを感じてしまう状況を作りだしていることがわかりました。
グリアスイッチmGluR5をコントロールすることができれば、難治性の慢性痛の治療薬開発、さらにシナプス可塑性に直結する脳機能制御法の開発に繋がることが期待されます。
本研究成果は、Journal of Experimental Medicine(米国ロックフェラー大学プレス医学雑誌)に掲載されますが、2022年3月24日(日本時間)に、オンライン版として先行発表されました(Online ahead of print)。
神経障害性疼痛1)は本邦で600万人以上もの方が苦しんでいる難治性の慢性痛です。この疼痛の原因には不明点が多く、また治療法も確立されていません。研究チームは、神経障害性疼痛モデルマウスを用いた研究により、この慢性痛の引き金となるスイッチの役割を果たす「mGluR52)」というタンパク質を見出しました。このmGluR5は、末梢の知覚神経が傷害されたときに、大脳皮質一次体性感覚野(S1)3)のアストログリア4)と呼ばれるグリア細胞で選択的に発現することでアストログリアの機能をONにするグリアスイッチで、これによりアストログリアはシナプスをつなぎ替える物質を産生し、S1の神経回路の繋がり方を変えることで、脳が痛みを感じてしまう状況を作りだしていることがわかりました。
グリアスイッチmGluR5をコントロールすることができれば、難治性の慢性痛の治療薬開発、さらにシナプス可塑性に直結する脳機能制御法の開発に繋がることが期待されます。
本研究成果は、Journal of Experimental Medicine(米国ロックフェラー大学プレス医学雑誌)に掲載されますが、2022年3月24日(日本時間)に、オンライン版として先行発表されました(Online ahead of print)。
論文情報
論文タイトル
Transient astrocytic mGluR5 expression drives synaptic plasticity and subsequent chronic pain in mice
著者
Yosuke Danjo, Eiji Shigetomi, Yukiho J Hirayama, Kenji Kobayashi, Tatsuya Ishikawa, Yugo Fukazawa, Keisuke Shibata, Kenta Takanashi, Bijay Parajuli, Youichi Shinozaki, Sun Kwang Kim, Junichi Nabekura and Schuichi Koizumi*
掲載誌:
Journal of Experimental Medicine誌 (2022年3月24日(日本時間)オンライン版にて先行発表されます)
Transient astrocytic mGluR5 expression drives synaptic plasticity and subsequent chronic pain in mice
著者
Yosuke Danjo, Eiji Shigetomi, Yukiho J Hirayama, Kenji Kobayashi, Tatsuya Ishikawa, Yugo Fukazawa, Keisuke Shibata, Kenta Takanashi, Bijay Parajuli, Youichi Shinozaki, Sun Kwang Kim, Junichi Nabekura and Schuichi Koizumi*
掲載誌:
Journal of Experimental Medicine誌 (2022年3月24日(日本時間)オンライン版にて先行発表されます)
背景
痛みは大きく分類すると、急性痛と慢性痛に分けられます。神経障害性疼痛(神経因性疼痛)は難治性の慢性痛で、原因には不明点が多く残されたままです。また神経障害性疼痛は、切り傷、擦り傷等の急性痛の治療によく用いられる非ステロイド性抗炎症薬(NSAID)と呼ばれる薬剤が殆ど効かず、さらにモルヒネ等の麻薬性鎮痛薬にも抵抗性を示す場合が多いことから、痛みのコントロールが大変難しい疼痛です。従って、一日も早い病気の原因解明と治療法開発が待たれています。
急性痛は、手や足の傷から放出された痛み物質を痛み受容体5)が感知して知覚神経を興奮させることで起こります。従って、痛み受容体や末梢の知覚神経そのものが治療の標的となり、実際NSAIDは痛み受容体やそのシグナルを抑制して痛みが伝わることを抑制しています。しかし神経障害性疼痛などの慢性痛は、手足等の傷、末梢神経細胞の傷等、最初の原因となった傷が治っているにもかかわらず、痛みが続いてしまいます。従って、痛み受容体や知覚神経細胞よりも、それらを知覚中枢に伝える脊髄や脳の神経回路に異常が起きていると考えられます。
脳や脊髄には、1,000億個もの神経細胞が存在して、これらが複雑なネットワークを構築することで、様々な情報を感知し、発信しています。しかし最近、脳・脊髄には、神経細胞よりも多い数のグリア細胞6)と呼ばれる細胞が存在し、脳の情報処理・発信で重要な役割を果たしていることが明らかになってきました。また、グリア細胞が異常になることで、脳の機能に異常が起こることも明らかとなり、現在グリア細胞は、様々な脳の病気(精神疾患、神経変性疾患)の原因を解き明かす鍵となる細胞であるとして、多くの研究者が注目しています。神経障害性疼痛などの慢性痛においてもグリア細胞が重要な役割を果たしていることが明らかにされ、特に脊髄ミクログリア6)の役割に多くの注目が集まっています。研究チームは、脊髄より上位の中枢である脳の体性感覚野に注目した研究を続け、今回S1アストログリアが慢性痛制御のキープレーヤーであること、そのスイッチが「mGluR5」というタンパク質であることを見いだしました。S1アストログリアのmGluR5は、難治性の神経障害性疼痛の理解及び今後の新しい治療戦略開発に大きく貢献することが期待されます。
急性痛は、手や足の傷から放出された痛み物質を痛み受容体5)が感知して知覚神経を興奮させることで起こります。従って、痛み受容体や末梢の知覚神経そのものが治療の標的となり、実際NSAIDは痛み受容体やそのシグナルを抑制して痛みが伝わることを抑制しています。しかし神経障害性疼痛などの慢性痛は、手足等の傷、末梢神経細胞の傷等、最初の原因となった傷が治っているにもかかわらず、痛みが続いてしまいます。従って、痛み受容体や知覚神経細胞よりも、それらを知覚中枢に伝える脊髄や脳の神経回路に異常が起きていると考えられます。
脳や脊髄には、1,000億個もの神経細胞が存在して、これらが複雑なネットワークを構築することで、様々な情報を感知し、発信しています。しかし最近、脳・脊髄には、神経細胞よりも多い数のグリア細胞6)と呼ばれる細胞が存在し、脳の情報処理・発信で重要な役割を果たしていることが明らかになってきました。また、グリア細胞が異常になることで、脳の機能に異常が起こることも明らかとなり、現在グリア細胞は、様々な脳の病気(精神疾患、神経変性疾患)の原因を解き明かす鍵となる細胞であるとして、多くの研究者が注目しています。神経障害性疼痛などの慢性痛においてもグリア細胞が重要な役割を果たしていることが明らかにされ、特に脊髄ミクログリア6)の役割に多くの注目が集まっています。研究チームは、脊髄より上位の中枢である脳の体性感覚野に注目した研究を続け、今回S1アストログリアが慢性痛制御のキープレーヤーであること、そのスイッチが「mGluR5」というタンパク質であることを見いだしました。S1アストログリアのmGluR5は、難治性の神経障害性疼痛の理解及び今後の新しい治療戦略開発に大きく貢献することが期待されます。
研究成果
これまでに本研究チームは、神経障害性疼痛「アロディニア1)」を起こすモデルマウスを用いた研究で、大脳皮質一次体性感覚野(S1)のアストログリアが異常な活動性(Ca2+濃度増大)を起こすことを発見しました (Kim et al, J Clin Invest 2016)。このS1アストログリア異常活動のメカニズム解析により、これらが興奮を伝える神経伝達物質「グルタミン酸」とその受容体「代謝型グルタミン酸受容体5(mGluR5)2)」により惹起されていることを明らかにしました。図左上に示すように、mGluR5は正常な大人のアストログリアには存在しませんが、坐骨神経を結紮する等で神経障害性疼痛を発症させる処理を行うと、S1アストログリア選択的に発現してきます(図中)。そこで研究グループは、mGluR5をアストログリア選択的に欠損させたマウス(mGluR5-cKO)を作成して解析を行ったところ、mGluR5-cKOマウスではアロディニアが発症することは有りませんでした。さらにmGluR5の活性化からどのようにアロディニアが発症するのかを研究し、以下のことを明らかにしました。つまり(1)mGluR5活性化によりS1アストログリアのCa2+シグナル上昇、(2)S1アストログリアがCa2+依存的にシナプス新生因子、thrombospondin-1(TSP1)、Hevin及びGlypican-47)を産生・放出、(3)S1において無秩序なシナプス新生が惹起、(4)本来は独立している触覚回路と疼痛回路の誤接続が、が起こります。これらにより神経障害性疼痛「アロディニア」が発症し、また一端誤接続されたS1の新しい回路が維持されるためにアロディニアが持続的で難治性となることが解りました(図参照)。
このように、神経障害性疼痛の直接の原因は末梢における神経や組織が傷害されることで起こるのですが、それが強すぎたり持続しすぎたりすると、脳のS1アストログリアのグリアスイッチが入ってしまいます。これにより、S1神経回路がつなぎ替えられて、本来独立している触覚回路と疼痛回路が混線してアロディニアが引き起こされます。非常に重要なことは、このようなS1神経回路の再編が、神経細胞自身により行われるのではなくて周りの細胞「アストログリア」によって引き起こされているということです。さらに、このアストログリアを神経回路再編型に変化させるスイッチがmGluR5であることが解りました。グリアスイッチmGluR5をよく理解し、コントロールする技術を開発することで、正体がよくわからなかった神経障害性疼痛の分子病態が理解され、またその治療薬・治療法開発されることが期待されます。
このように、神経障害性疼痛の直接の原因は末梢における神経や組織が傷害されることで起こるのですが、それが強すぎたり持続しすぎたりすると、脳のS1アストログリアのグリアスイッチが入ってしまいます。これにより、S1神経回路がつなぎ替えられて、本来独立している触覚回路と疼痛回路が混線してアロディニアが引き起こされます。非常に重要なことは、このようなS1神経回路の再編が、神経細胞自身により行われるのではなくて周りの細胞「アストログリア」によって引き起こされているということです。さらに、このアストログリアを神経回路再編型に変化させるスイッチがmGluR5であることが解りました。グリアスイッチmGluR5をよく理解し、コントロールする技術を開発することで、正体がよくわからなかった神経障害性疼痛の分子病態が理解され、またその治療薬・治療法開発されることが期待されます。
今後の展開
神経障害性疼痛のような慢性痛の原因が、傷口から遠く離れた知覚情報を感知する脳部位S1に起因していること、さらにそれがS1のグリアスイッチmGluR5にあることが解りました。またグリアスイッチONにより、シナプス再編が起こり、神経回路同士のつなぎ替えが起こることもわかりました。シナプス再編及び神経回路のつなぎ替えは、慢性痛だけでなく他の多くの脳の疾患と大きく関連しています。従ってグリアスイッチmGluR5は、種々の脳疾患の病態解明にも役立つと考えられ、脳疾患研究に大きな波及効果をもたらすことが予想されます。さらに、シナプス再編及び神経回路再編は、脳機能の最も重要かつ基本的な基盤であることから、本成果が脳の基本原理解明においても重要な知見になると考えられます。今後は、病気の時にmGluR5がアストログリアで発現してくるメカニズムを解明し、また一度誤接続してしまった神経回路を解除したり、正常化する方法の開発等を行い、治療に直結する成果、さらに神経回路再編の基本原理を解き明かす成果を発信したいと考えています。
本研究は、科研費 学術変革領域(A)「グリアデコード」(JP20H05902)、新学術領域研究「MANネットワークの異常と脳情報動態学研究」(JP20H05060)、基盤研究(A)「網膜グリア細胞による眼の生理機能・病態制御機構の解明」(JP21H04786)、ABiS(JP16H06280)、三菱財団、武田科学財団、山梨GLIAセンター研究助成(小泉修一)、による支援を受けて行われました。
本研究は、科研費 学術変革領域(A)「グリアデコード」(JP20H05902)、新学術領域研究「MANネットワークの異常と脳情報動態学研究」(JP20H05060)、基盤研究(A)「網膜グリア細胞による眼の生理機能・病態制御機構の解明」(JP21H04786)、ABiS(JP16H06280)、三菱財団、武田科学財団、山梨GLIAセンター研究助成(小泉修一)、による支援を受けて行われました。
用語説明
[1] 神経障害性疼痛/アロディニア
末梢及び中枢神経細胞の傷害及び機能障害により起こる慢性疼痛。交通事故、手術、糖尿病、癌の浸潤、ヘルペスウィルス(帯状疱疹後神経痛)等が原因で発症することが知られ、国内には600万人以上が本疾患で苦しんでいます。痛覚過敏や自発痛などと共に、アロディニア(異通症)等の症状が知られています。アロディニアは、触った等の軽い刺激(非侵害生刺激)が激痛となって伝わってしまう症状です。いずれの症状に対しても、通常の鎮痛薬(非ステロイド性抗炎症薬;NSAID)は殆ど効果が無く、モルヒネ等の麻薬性鎮痛薬でも効かない例が多いことから、治療に難渋している疾患で、一日も早い病因の解明と治療薬・治療法の開発が待たれています。
[2] mGluR5
興奮性の神経伝達物質であるグルタミン酸を受け取るタンパク質(受容体)の一つ。グルタミン酸がmGluR5を刺激すると、細胞内のCa2+濃度が上昇し、Ca2+依存的に活性化する酵素反応や遺伝子発現等々、様々な細胞応答が起こります。mGluR5は、生後初期にはアストログリアに存在していますが、成長とともに減少し、大人のアストログリアにはほぼ発現していません。しかし、神経障害性疼痛のような病態時には、アストログリア特異的に発現が亢進します。
[3] 大脳皮質一次体性感覚野(S1)
大脳皮質は、脳の最外側を覆っている6層からなる脳部位で、触覚・痛覚等の知覚情報を含む外界からの情報を識別し、それに応じた運動を命じ、さらに記憶、情動、認知等の高次脳機能制御を担う役割を果たす非常に大事な脳部位です。感覚情報は、情報の種類毎に大脳皮質の異なる脳部位で感知されています。このうち、手や足等からの知覚情報を感知する脳部位が一次体性感覚野(Primary Somatosensory Cortex; S1)と呼ばれています。
[4] アストログリア
グリア細胞([6]参照)の1種で脳内では最も大きく数の多い細胞です。アストロサイトとも呼ばれます。古典的には、神経細胞の物理的な支持、老廃物や過剰神経伝達物質の排除、血管からのエネルギー物質補給等の役割が知られていました。最近は、化学伝達物質(グリア伝達物質)を放出し、シナプス伝達等の神経細胞の活動を制御すること、さらにシナプス新生分子放出により新しいシナプスを作って神経細胞回路をつなぎ替えるネットワーク再編で中心的な役割を果たしていることが明らかになってきました。
[5] 痛み受容体
切り傷等により細胞が壊れた際に放出される分子や、物理的な刺激、熱等を感知して、知覚神経(一次求心性神経)を興奮させる受容体。痛みセンサーとも呼ばれます。代表的なものに、カプサイシン受容体TRPV1(2021年ノーベル生理学・医学賞の対象となった)をはじめとするTRPファミリー、機械刺激を感知するPiezo、H+を感知するASIC(酸感受性イオンチャネル)、ATPを感知するP2受容体(P2X及びP2Y)などがあります。
[6] グリア細胞
神経膠細胞と呼ばれる脳細胞の一種。大きくわけて、アストログリア、オリゴデンドログリア、ミクログリアがあります(アストログリアは[4]を参照)。オリゴデンドログリアは、神経細胞の軸索に巻き付き、ミエリン鞘と呼ばれる絶縁体構造を作り、跳躍伝導と呼ばれる神経細胞の早い伝導を可能とする細胞です。他にも、神経細胞同士を束ねたり、神経細胞間の興奮性を同期させたりする作用も有しています。ミクログリアは脳内唯一の免疫細胞で、自然免疫を担当しています。しかし、細菌やウィルスに対する防御機能だけでなく、神経細胞の活動や脳内環境の変化を感知し、それらに応答してシナプスの除去・構築、死細胞や断片の除去、さらに脳内炎症の制御等、多彩な作用を有し脳機能制御で重要な役割を担っています。
[7] シナプス新生因子
神経細胞は、シナプスという神経細胞と神経細胞の継ぎ目で、化学物質を使って次の神経細胞に情報を伝えます。シナプス新生因子は、このシナプスを新しく作る分子の総称で、thrombospondin-1(TSP-1)、Hevin及びGlypican-4などの分子が知られています。アストログリアは、これらシナプス新生因子を産生・放出する細胞として注目されています。
末梢及び中枢神経細胞の傷害及び機能障害により起こる慢性疼痛。交通事故、手術、糖尿病、癌の浸潤、ヘルペスウィルス(帯状疱疹後神経痛)等が原因で発症することが知られ、国内には600万人以上が本疾患で苦しんでいます。痛覚過敏や自発痛などと共に、アロディニア(異通症)等の症状が知られています。アロディニアは、触った等の軽い刺激(非侵害生刺激)が激痛となって伝わってしまう症状です。いずれの症状に対しても、通常の鎮痛薬(非ステロイド性抗炎症薬;NSAID)は殆ど効果が無く、モルヒネ等の麻薬性鎮痛薬でも効かない例が多いことから、治療に難渋している疾患で、一日も早い病因の解明と治療薬・治療法の開発が待たれています。
[2] mGluR5
興奮性の神経伝達物質であるグルタミン酸を受け取るタンパク質(受容体)の一つ。グルタミン酸がmGluR5を刺激すると、細胞内のCa2+濃度が上昇し、Ca2+依存的に活性化する酵素反応や遺伝子発現等々、様々な細胞応答が起こります。mGluR5は、生後初期にはアストログリアに存在していますが、成長とともに減少し、大人のアストログリアにはほぼ発現していません。しかし、神経障害性疼痛のような病態時には、アストログリア特異的に発現が亢進します。
[3] 大脳皮質一次体性感覚野(S1)
大脳皮質は、脳の最外側を覆っている6層からなる脳部位で、触覚・痛覚等の知覚情報を含む外界からの情報を識別し、それに応じた運動を命じ、さらに記憶、情動、認知等の高次脳機能制御を担う役割を果たす非常に大事な脳部位です。感覚情報は、情報の種類毎に大脳皮質の異なる脳部位で感知されています。このうち、手や足等からの知覚情報を感知する脳部位が一次体性感覚野(Primary Somatosensory Cortex; S1)と呼ばれています。
[4] アストログリア
グリア細胞([6]参照)の1種で脳内では最も大きく数の多い細胞です。アストロサイトとも呼ばれます。古典的には、神経細胞の物理的な支持、老廃物や過剰神経伝達物質の排除、血管からのエネルギー物質補給等の役割が知られていました。最近は、化学伝達物質(グリア伝達物質)を放出し、シナプス伝達等の神経細胞の活動を制御すること、さらにシナプス新生分子放出により新しいシナプスを作って神経細胞回路をつなぎ替えるネットワーク再編で中心的な役割を果たしていることが明らかになってきました。
[5] 痛み受容体
切り傷等により細胞が壊れた際に放出される分子や、物理的な刺激、熱等を感知して、知覚神経(一次求心性神経)を興奮させる受容体。痛みセンサーとも呼ばれます。代表的なものに、カプサイシン受容体TRPV1(2021年ノーベル生理学・医学賞の対象となった)をはじめとするTRPファミリー、機械刺激を感知するPiezo、H+を感知するASIC(酸感受性イオンチャネル)、ATPを感知するP2受容体(P2X及びP2Y)などがあります。
[6] グリア細胞
神経膠細胞と呼ばれる脳細胞の一種。大きくわけて、アストログリア、オリゴデンドログリア、ミクログリアがあります(アストログリアは[4]を参照)。オリゴデンドログリアは、神経細胞の軸索に巻き付き、ミエリン鞘と呼ばれる絶縁体構造を作り、跳躍伝導と呼ばれる神経細胞の早い伝導を可能とする細胞です。他にも、神経細胞同士を束ねたり、神経細胞間の興奮性を同期させたりする作用も有しています。ミクログリアは脳内唯一の免疫細胞で、自然免疫を担当しています。しかし、細菌やウィルスに対する防御機能だけでなく、神経細胞の活動や脳内環境の変化を感知し、それらに応答してシナプスの除去・構築、死細胞や断片の除去、さらに脳内炎症の制御等、多彩な作用を有し脳機能制御で重要な役割を担っています。
[7] シナプス新生因子
神経細胞は、シナプスという神経細胞と神経細胞の継ぎ目で、化学物質を使って次の神経細胞に情報を伝えます。シナプス新生因子は、このシナプスを新しく作る分子の総称で、thrombospondin-1(TSP-1)、Hevin及びGlypican-4などの分子が知られています。アストログリアは、これらシナプス新生因子を産生・放出する細胞として注目されています。
図とその説明
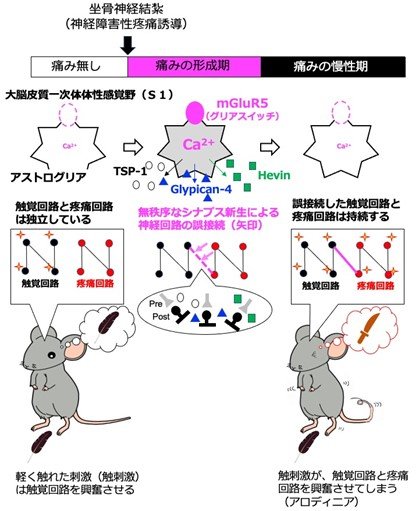
図 神経障害性疼痛モデル(坐骨神経結紮)によりS1アストログリアで起こる変化の模式図
図左:正常の大人のアストログリアはmGluR5を発現していない。また触覚回路と疼痛回路は独立しているため、触刺激は触覚回路のみを興奮させて、触覚として感知される。
図中:坐骨神経を軽く結紮すると(神経傷害性モデル)、S1アストログリア選択的にmGluR5というタンパク質が発現する。mGluR5はスイッチとして機能し、mGluR5が活性化すると(スイッチON)、アストログリア内のCa2+が上昇し、これによりthrombospondin-1(TSP-1)、Hevin及びGlypican-4と呼ばれるシナプス新生分子が産生・放出される。これらのシナプス新生因子が無秩序にシナプスを作ることにより、通常は独立している触覚回路と疼痛回路が間違って接続されてしまう(矢印)。これにより、触刺激が、触覚回路も疼痛回路も興奮させてしまい、痛みとして感知されてしまう(アロディニア)。
図右:慢性期になると、mGluR5はアストログリアから消失してしまうが、触覚回路と疼痛回路の誤接続は維持されるため、アロディニアが持続する(慢性痛となる)。
お問い合わせ先
<研究に関する問合せ>
国立大学法人山梨大学 医学部 薬理学講座
教授 小泉 修一(コイズミ シュウイチ)
自然科学研究機構生理学研究所
所長 鍋倉 淳一(ナベクラ ジュンイチ)
国立大学法人福井大学 医学部
教授 深澤 有吾(フカザワ ユウゴ)
国立大学法人金沢大学 医薬保健研究域医学系
助教 石川 達也(イシカワ タツヤ)
<報道に関する問合せ>
国立大学法人山梨大学 総務部総務課広報企画室
自然科学研究機構 生理学研究所 研究力強化戦略室
国立大学法人福井大学 広報センター
国立大学法人金沢大学 医薬保健系事務部総務課総務係
国立大学法人山梨大学 医学部 薬理学講座
教授 小泉 修一(コイズミ シュウイチ)
自然科学研究機構生理学研究所
所長 鍋倉 淳一(ナベクラ ジュンイチ)
国立大学法人福井大学 医学部
教授 深澤 有吾(フカザワ ユウゴ)
国立大学法人金沢大学 医薬保健研究域医学系
助教 石川 達也(イシカワ タツヤ)
<報道に関する問合せ>
国立大学法人山梨大学 総務部総務課広報企画室
自然科学研究機構 生理学研究所 研究力強化戦略室
国立大学法人福井大学 広報センター
国立大学法人金沢大学 医薬保健系事務部総務課総務係
リリース元




国立大学法人山梨大学
自然科学研究機構生理学研究所
国立大学法人福井大学
国立大学法人金沢大学

