滑らかな運動はどう実現されるのか
~大脳基底核の視床下核が運動を制御するメカニズム~
概要
|
大脳基底核(用語解説参照)の視床下核は小さな神経核ですが、損傷により不随意運動を引き起こします。また、パーキンソン病患者では症状を緩和させるための脳深部刺激療法のターゲットであることから、運動制御に関して重要な役割があると考えられてきましたが、具体的にどのような役割を果たしているかは不明でした。 今回、自然科学研究機構生理学研究所の長谷川拓研究員・知見聡美助教・小林憲太准教授・南部篤教授の研究チームが、神経活動を可逆的に操作する化学遺伝学的手法を使い、サルの視床下核を抑制したところ、不随意運動が起き、運動実行が不安定になることを明らかにしました。さらに、視床下核が大脳基底核の出力を安定化させることにより、滑らかな運動を実現していることを突き止めました。本研究成果はNature Communications誌(日本時間2022年4月25日18時)に公開されました。 |
研究の背景
私たちが日常生活において、例えば何か物を掴む際には肩、腕、手首、指を協調して動かすことが必要です。上肢の複数の筋肉が連続的に滑らかに収縮・弛緩することによってこのような運動を実現しますが、そのためには大脳皮質の運動野の指令が時空間的に精密に制御されてなければなりません。運動野と相互に投射を行っている大脳基底核がこの運動野の指令の生成に関わっていると考えられています。大脳基底核の神経ネットワークにある視床下核は小さな神経核ですが、損傷すると、損傷した脳半球とは反対側の手足が大きく揺れ動くバリズムと呼ばれる不随意運動を引き起こします。また、パーキンソン病患者において、視床下核を小さく壊す凝固術や24時間連続して電気刺激を与える脳深部刺激療法は運動障害を緩和させることが知られています。このように視床下核は運動制御に深く関わっていると考えられてきましたが、その具体的な役割は明らかにされていませんでした(図1)。
今回の研究について
これまで、神経活動と行動の関係を調べるために、神経活動を可逆的に操作する化学遺伝学(あるいは、DREADD)と呼ばれる技術が開発され、多くの研究で利用されています。この技術では、人工的な受容体を対象のニューロンに発現させ、その受容体に特異的に結合する薬剤を投与します。受容体が薬剤に結合すると、細胞内のシグナルを介して、神経活動を興奮または抑制します。本研究でもDREADDを利用し、視床下核の神経活動を人為的に抑制させたときのサルの行動の変化や、周辺領域の神経活動を調べました。
まず研究チームは、ウイルスベクターによって抑制型DREADD受容体をニホンザルの視床下核に発現させ、ニューロンの活動が実際に抑制される様子を電気生理学的に確認することに成功しました(図2)。そこで、視床下核を抑制した際に、サルの行動がどのように変化するかを検証したところ、手が勝手に動く不随意運動が起き、目標に手を伸ばす運動が不安定になることを明らかにしました。
次に、研究チームは視床下核から情報を受け取る淡蒼球内節に着目しました。淡蒼球内節は大脳基底核の情報を選択して視床へ情報を送るための出力核です。視床下核を抑制している場合と抑制しない場合で、淡蒼球内節の神経活動を計測・比較したところ、神経細胞の活動の大きさはあまり変化しませんでしたが、発火パターンの変動は、視床下核が抑制されている場合に増大することが分かりました(図3)。さらに、この発火の変動は特に運動がうまくいかない試行では大きくなっていることや、不随意運動の直前に神経活動が変動していることを突き止めました。視床下核が抑制されることで、淡蒼球内節で意図しない神経活動の変化が起き、不随意運動を引き起こしていると考えられます。
これらの結果は、視床下核が大脳基底核の出力を安定化させることで、滑らかな運動を実現していることを示しています(図4)。本研究により、視床下核の運動制御機構に関する理解が進み、パーキンソン病に対してより良い療法の開発につながることが期待されます。
<助成金など>
本研究は文部科学省科学研究費補助金(新学術領域研究「オシロロジー」、基盤研究、若手研究)、AMED「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」「戦略的国際脳科学研究推進プログラム(国際脳)」、CREST「オプトバイオ」、武田科学振興財団の補助を受けて行われました。
今回の発見
- 霊長類において、化学遺伝学的な手法によって視床下核の神経活動を操作し、その神経活動を電気的に記録することに成功しました。
- 大脳基底核の視床下核を抑制することで、手の不随意運動が誘導され、運動が不安定になることを明らかにしました。
- 視床下核は、大脳基底核の出力部の神経活動を安定化させることで、滑らかな運動を実現していると考えられます。
図1 大脳基底核の神経回路と運動制御
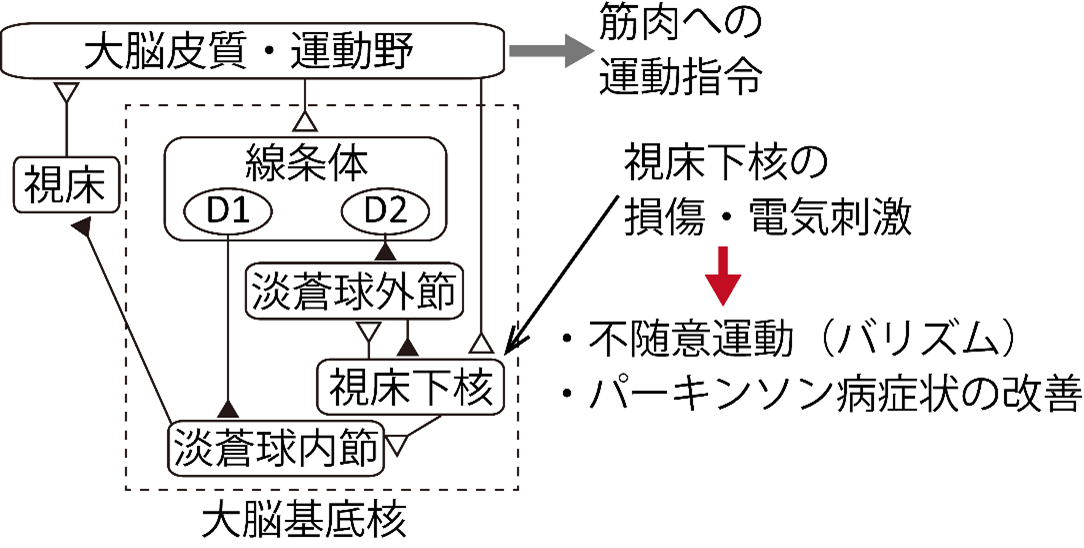
大脳基底核は大脳皮質運動野とループ状の神経ネットワークを形成しています。線条体と視床下核が大脳皮質から直接入力を受け、淡蒼球内節から視床を介して大脳皮質へ出力しています。白の三角(△)は興奮性投射、黒の三角(▲)は抑制性投射を示します。
図2 化学遺伝学による視床下核の神経活動抑制
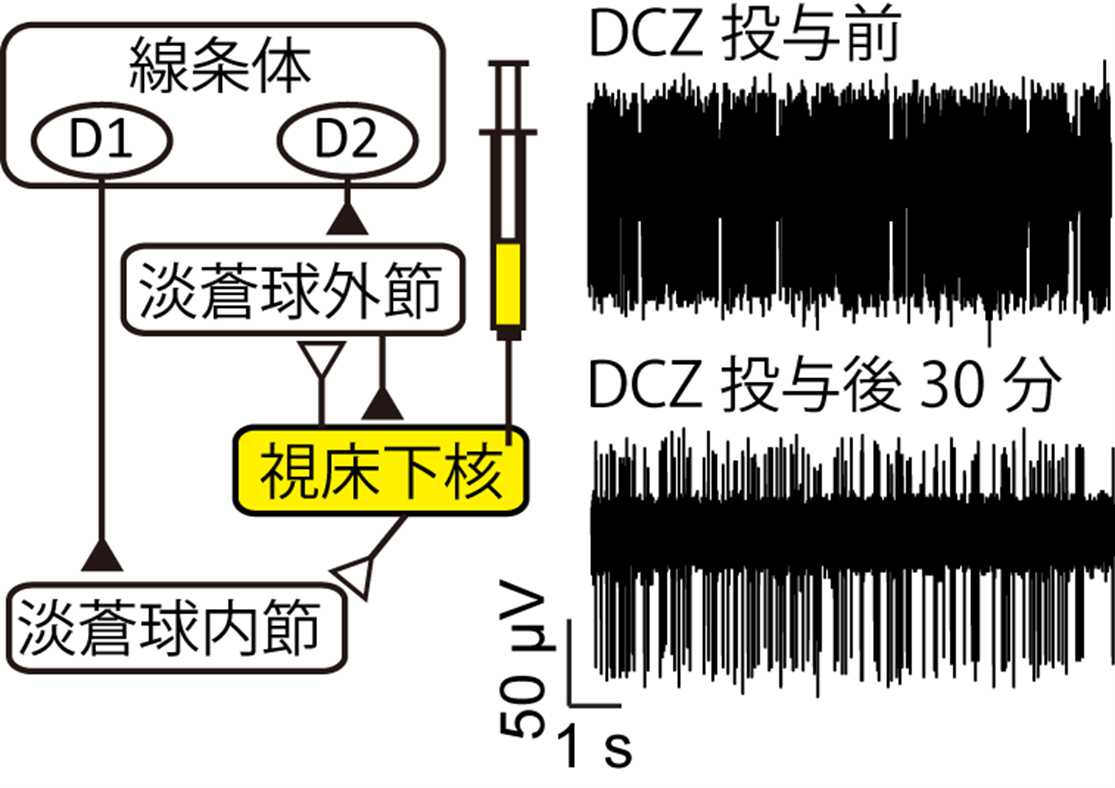
ウイルスベクターによってニホンザルの視床下核に抑制型DREADD受容体を発現させました(左)。視床下核から神経活動を記録しながら薬剤(DCZ; Deschloroclozapine)を全身投与すると神経活動の抑制が見られました(右)。
図3 視床下核の抑制による大脳基底核の出力の変化
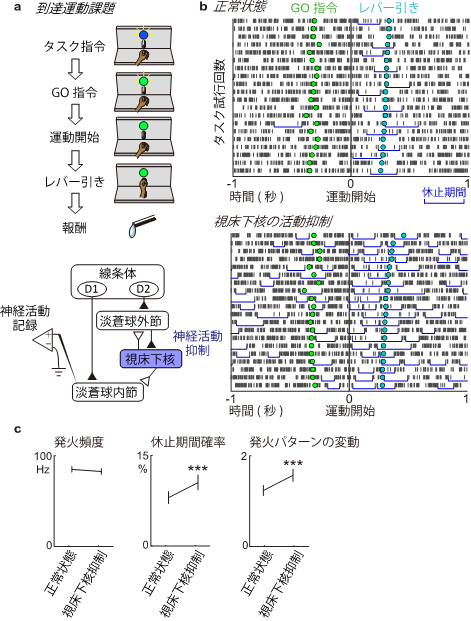
a, サルに手を伸ばしてレバーを引く到達運動課題を行わせながら、淡蒼球内節から神経活動記録を行いました。視床下核を抑制する前後での神経活動の変化を調べました。b, 淡蒼球内節ニューロンの神経発火の時間経過を運動開始の時点で揃えて表示したものです。短い縦線は神経発火を示し、青い横線は神経発火の一過性の休止期間を示しています。視床下核を抑制する前は、休止期間が運動開始直後に観察されましたが、視床下核を抑制すると運動していない時にも休止期間が起きるようになりました。c, 運動中のサルから記録された83個の淡蒼球内節のニューロンの解析を行いました。DCZ投与によって発火頻度には変化が見られませんでしたが、休止期間が増え、発火パターンの変動(ファノ因子)が増大しました。
図4 視床下核による運動制御のモデル
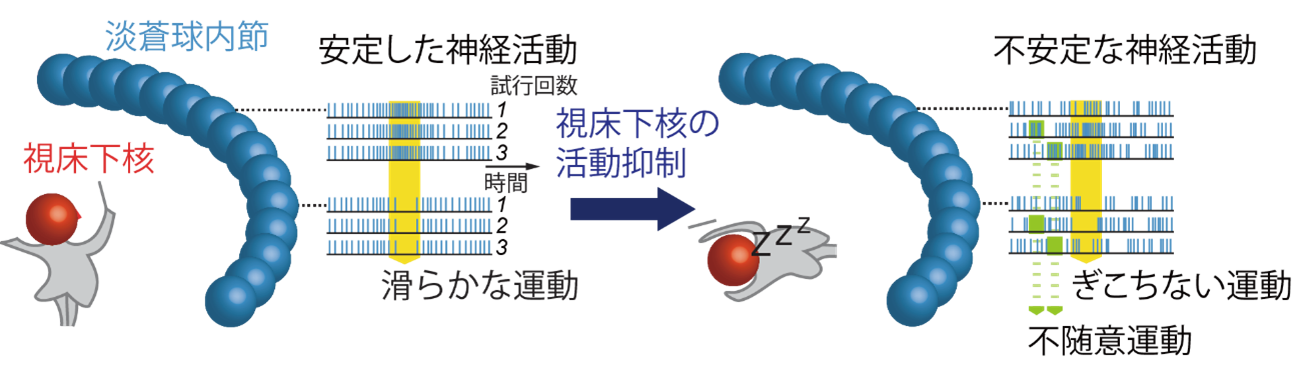
正常な状態では、運動実行の際に視床下核が活動し、淡蒼球内節の活動を安定化することで滑らかな運動を実現すると考えられます(左)。視床下核を抑制すると、淡蒼球内節の活動が不安定になり、不随意運動が起きたり、運動がぎこちなくなったりすると考えられます(右)。
この研究の社会的意義
不随意運動が起きている最中の大脳基底核の神経活動はこれまで知られていませんでしたが、今回の研究で視床下核の損傷によってなぜ不随意運動が起きるのかを明らかにすることができました。視床下核の運動制御機構の理解が進むことで、パーキンソン病に対してより適した脳深部刺激療法の開発が期待できます。用語解説
大脳基底核:大脳の深部に存在する一連の神経細胞群で、線条体、淡蒼球、視床下核、黒質などからなる。運動をコントロールしており、その不調により、パーキンソン病、ジストニア、バリズムなどを来す。論文情報
Subthalamic nucleus stabilizes movements by reducing neural spike variability in monkey basal ganglia: chemogenetic study.Taku Hasegawa, Satomi Chiken, Kenta Kobayashi, Atsushi Nambu.
Nature Communications.
日本時間2022年 4月25日18時解禁
DOI: https://doi.org/10.1038/s41467-022-29750-2.
お問い合わせ
<研究について>自然科学研究機構 生理学研究所
生体システム研究部門
教授 南部 篤(ナンブ アツシ)
助教 知見 聡美(チケン サトミ)
研究員 長谷川 拓(ハセガワ タク)
ウイルスベクター開発室
准教授 小林 憲太(コバヤシ ケンタ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
<AMED事業に関すること>
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳とこころの研究推進プログラム
(革新的技術による脳機能ネットワークの全容解明プロジェクト)
リリース元


自然科学研究機構 生理学研究所
日本医療研究開発機構

