3生体情報研究系
3.1感覚認知情報研究部門
感覚認知情報部門は視知覚および視覚認知の神経機構を研究対象としている。主に無麻酔行動下のサルの大脳視覚野ニューロン活動を調べている。本年度は具体的な課題として、(1) 初期視覚野における輪郭とその折れ曲がりの表現、(2) 下側頭皮質における色情報の表現、(3) 刺激をどのような行動に用いるかによる視覚野ニューロン活動の課題依存的修飾、(4) 視覚関連領野における要素的な刺激のグルーピングのメカニズムなどに関する研究を行った。またサルのfMRI実験を進めており、(5) 色刺激、形刺激に選択的に活動する領域の同定、(6) 周囲と異なる刺激に位置選択的に活動する領域の同定を試みた。
2007年に上記の(2)について発表した論文を紹介する。
Koida K & Komatsu H. Effects of task demands on the responses of color-selective neurons in the inferior temporal cortex. Nature Neuroscience 10: 108-116, 2007
同じ名前の色でも、さまざまに異なる色を含む。例えば我々は枝豆の色もホウレン草の色もどちらも「緑色」という同じカテゴリーとして扱う。一方、食べ物や洋服を選ぶ時のように、よく似た同じ名前の色でも細かく見分ける場合もある。必要に応じて、これら二つの色の見方、つまりカテゴリー判断と細かい弁別の機能を我々は使い分けている。
色覚におけるこれら二つの働きが脳内でどのように行われているかを調べるために、同じ色刺激のセットに対してカテゴリー判断または細かい弁別を行っているときのニューロン活動を測定し比較した。われわれは二頭のサルにカテゴリー課題、弁別課題の二種類の認知課題を訓練し、記録は下側頭皮質の色選択ニューロンから行った。いずれの課題でも赤から緑まで等間隔で分布した11個の色刺激セットを用いた。カテゴリー課題では、11色のうちの一つがサンプル色刺激として呈示された後、サンプル色刺激が赤のカテゴリーの色ならNO-GO応答(固視を続ける)緑ならGO応答(目を動かす)をすることでカテゴリー判断を行わせた。弁別課題では、サンプル色刺激の後に二つのわずかに異なる色のターゲット刺激が呈示され、最初に呈示された色と同じターゲット刺激に目を向ける必要がある。そのためにサルは同じカテゴリー内でもサンプル色刺激の色を細かく識別する必要がある。
下側頭皮質からサンプル色刺激に選択的な応答を示した124個のニューロンを記録し、サンプル色刺激呈示期間中の活動を課題間で比較したところ、多くの細胞が課題に依存して有意な活動の変化を示した (n=79/124; 64%)。 そしてその多くはカテゴリー課題を行っているときに活動が強かった (n=61/79; 77%)。 また、カテゴリー課題で強く活動する細胞は、赤または緑といったそれぞれのカテゴリーを最もよく表す両極端の色で最大応答を示すことが多かった。課題間で応答強度に違いの見られた細胞では、色選択性そのものには課題間ではっきりした違いは見られなかった。
これらの結果は、動物のおかれた状況を表現する内的な信号によって、視覚野の感覚情報を表現するニューロン活動が制御されていることを示している.そのような制御は下側頭皮質の色選択ニューロンにおいては、色のカテゴリー判断を行う時に活動を増強し、細かい識別を行う時には抑制するように働いていた.このことは下側頭皮質が色のカテゴリー判断に重要な役割を果たすことを示唆している。
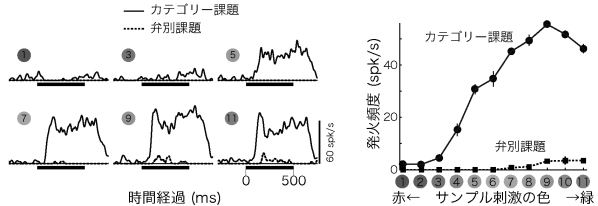
図 課題依存的な活動変化を示した色選択性ニューロンの例
(左)6つのグラフはそれぞれサンプル刺激(1:赤~11:緑)への神経応答の時間変動(ヒストグラム)を示している。 (右)色選択性と課題依存性のまとめ。サンプル刺激に対する応答強度を、50 msから550 msまでの期間の平均発火頻度であらわした。
3.2神経シグナル研究部門
神経シグナル部門では、神経回路機能の理解をめざしてボトムアップ的な研究を行っている。主な研究手法は、脳スライスを用いた電気生理学であるが、遺伝子改変マウスを用いた機能分子、シナプス機能、行動の解析や、生体マウス脳からのシングルユニット記録等も行なっている。具体的なターゲットは、視床、大脳皮質、小脳、海馬など幅広い領域にわたるが、基本的方針として、分子の細部に入っていくのではなく、個体との関係においてできるだけ生理学的意義のある現象を追うことにしている。残念ながら、今年は論文発表にまでいたった研究がなかったが、下記の研究はいずれも学会発表をおこない現在論文を準備中あるいは投稿中のものである。
Ca2+/カルモジュリン依存性プロテインキナーゼⅡによる海馬シナプス可塑性の制御
海馬CA1領域におけるシナプスの長期増強(LTP)は、高次脳機構のひとつである学習・記憶の細胞・分子メカニズムを解明するための基本モデルと考えられ、LTPに関与する分子について、多くの研究が進められてきた。中でも、Ca2+/カルモジュリン依存性プロテインキナーゼII(CaMKII)はLTPに必要な分子として注目を集めている。私たちは、CaMKIIαのATP結合に必要なアミノ酸残基を置換することにより不活性型としたノックインマウス(K42R)を新たに開発し、このマウスを用いてCaMKIIが上記機能に果たす役割について、検討を進めている。具体的には、海馬組織を用いた生化学的解析、海馬スライス標本を用いた電気生理学的解析、海馬培養神経細胞を用いた細胞生物学的解析、マウスの行動学的解析といった多方面からのアプローチを駆使することにより、総合的な理解を目指している。
小脳顆粒細胞-介在ニューロン間興奮性シナプス伝達のペアパルス増強
小脳スライス‐パッチクランプ法を用いて、顆粒細胞軸索(上向性線維および平行線維)の電気刺激に伴い分子層介在ニューロンから記録される興奮性シナプス後電流(EPSC)の性質を調べている。30~100 ms間隔で2発のペアパルス刺激を与えると、2発目EPSCの振幅値と減衰時定数が著しく増大した。薬理学的検討や量子解析を行い、EPSC振幅増大はシナプス小胞の放出確率および放出多重性の増強、減衰時間増大は遅延したシナプス小胞放出の増強により惹起されたことを示唆する結果を得ている。
皮質視床シナプスによる視床投射細胞への興奮性-抑制性の調節機構
皮質視床シナプスは視床投射細胞に興奮性シナプスを形成すると同時に、その側枝は、抑制性細胞である網様体細胞にシナプスを形成し、網様体細胞から視床投射細胞に抑制性シナプスを作ることで、皮質視床シナプスは視床に対しfeed forward inhibitionも与える。皮質視床シナプスの興奮性-抑制性入力の精巧なバランス調節が、感覚情報処理に重要と考えられているが、その調節機構はシナプスレベルで殆ど明らかになっていない。私たちは皮質視床シナプスのカイニン酸受容体によるシナプス前性機構に着目し、視床投射細胞と網様体細胞から皮質視床シナプスEPSCを同時に記録した。外液に極薄い濃度のカイニン酸投与すると、カイニン酸受容体を介するシナプス前性作用が、投射細胞に対してはシナプス伝達を抑制し、網様体細胞に対しては促進した。
2種類の同期タイミングを識別する神経回路
神経回路は、神経細胞とシナプスによって構築される。神経回路における信号処理能力は、そのシナプス配線ルールに強く依存する。すなわち、どのようなシナプス配線図が、どのような信号処理能力を有しているのか対応させていくことは重要である。私たちは、視床-大脳皮質神経回路に着目し、視床由来の2種類の同期的入力(同時入力と時間のずれた入力)を識別することが可能な神経回路の配線ルールを探索した。その識別は、収束性と発散性が組み合わさった特徴的なフィードフォワード抑制回路で達成可能であることがわかった。その神経回路配線図において、もし大脳皮質抑制神経細胞である fast-spiking (FS) 細胞が脱分極していた場合、同時入力の方がより強く大脳皮質4層主要細胞を興奮させた。しかしながら、同一神経回路にもかかわらず、もしFS細胞が比較的過分極していた場合、時間のずれた入力の方がより強く大脳皮質4層主要細胞を興奮させた。