2 細胞器官研究系
2.1 生体膜研究部門
生体膜研究部門では脳の情報処理メカニズムを分子レベルで解明し、また、その破綻がどのようにして‘てんかん’等の疾患をもたらすのかを明らかにする。当研究部門では最近同定した1)パルミトイル化脂質修飾酵素P-PAT、および2)てんかん関連リガンドLGI1を起点としてシナプス可塑性の根幹を成すと考えられているAMPA型グルタミン酸受容体を介したシナプス伝達の制御機構を統合的に解明することを目指している。さらに、神経機能に限らず、3)様々な細胞機能におけるパルミトイル化脂質修飾酵素の役割を国際共同研究を交え解明することを目指している。これらの中で、2008年に発表した論文を中心に紹介する。
Tsutsumi R, Fukata Y, Noritake J, Iwanaga T, Perez F & Fukata M (2008) Identification of G-protein α subunit palmitoylating enzyme. Mol Cell Biol (in press).
3量体Gタンパク質αサブユニットの局在を決定する脂質修飾酵素の同定
Gタンパク質共役型受容体(GPCR)はヒトでは700種類以上存在し、神経シナプス伝達や平滑筋収縮等、様々な生理機能を制御する。3量体G蛋白質Gαは可逆的なパルミトイル化脂質修飾を介して細胞膜に局在し、GPCRを介した外界シグナルを細胞内の標的蛋白質に伝達する。しかし、Gαのパルミトイル化反応は酵素に依存しないという説が古くから提唱されるなど、その存否には議論が絶えなかった。今回、私共は23種のDHHCパルミトイル脂質転移酵素群を独自に開発してきたスクリーニング法によりスクリーニングし、DHHC3およびDHHC7がGα(Gα q、GαsおおびGαi2)のパルミトイル化レベルを著しく亢進させることを突き止めた。また、DHHC3およびDHHC7をノックダウン法により発現抑制させるとGα q/11のパルミトイル化レベルが低下し、Gαq/11が細胞膜から細胞質へ移行することを見出した。
一方、光変換(photoconversion)技術を用いてGα qの細胞内動態の解析を行ったところ、Gαqは細胞膜に静的に存在するのではなく、細胞膜とDHHC3 / 7が局在するゴルジ装置の間をパルミトイル化依存的に双方向に行き来することを見出した(図)。さらに、DHHC3 / 7のパルミトイル化酵素活性がGPCRの一つであるα1Aアドレナリン受容体/Gαq/11を介した情報伝達に必須であることを見出した。以上の結果より、パルミトイル化脂質酵素DHHC3 / 7がGαの細胞内局在を規定することによりGPCRを介した情報伝達を新たな機構で制御していることが明らかとなった。
また、私たちはAMPA受容体をシナプスにアンカリングする足場蛋白質PSD-95に焦点を当て研究をしており、今年度1)パルミトイル化酵素P-PATがAMPA受容体の恒常性維持(synaptic
scaling)に必須であることを明らかにしつつある。さらに、てんかん関連リガンドLGI1の個体レベルでの解析を進めており、新規リガンドLGI1によるAMPA受容体制御機構とてんかん発症メカニズムを明らかにしつつある。
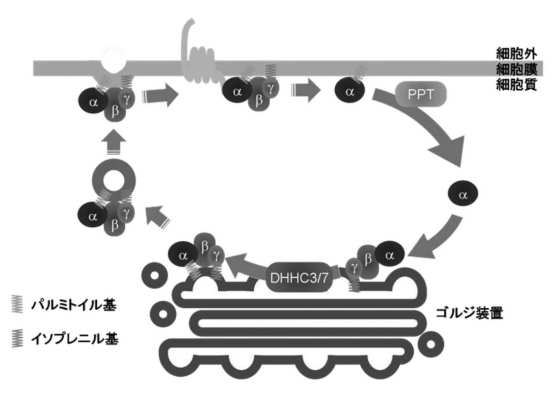
図 パルミトイル化を介したGα細胞内動態モデル
細胞膜上のGαは脱パルミトイル化されて細胞質に移行し、ゴルジ装置に存在するDHHC3 およびDHHC7により再パルミトイル化され一時的にゴルジ装置に集積する。Gαはその後Gβ γ とともに小胞輸送などにより細胞膜に移行する。PPT: 脱パルミトイル化酵素
2.2 機能協関研究部門
私達の部門は1992年以来、容積調節や吸収・分泌機能や環境情報受容などのようにすべての細胞種が持っている最も一般的で基本的な細胞機能とそのメカニズムを、チャネル、トランスポータ、センサーなどの膜機能分子の働きとして統合的に解明すると共に、細胞死誘導のメカニズムをそれらの異常として把握することを目標に研究している。2008年度は、主として次の3研究課題に取組んだ。
1.細胞容積調節の分子メカニズムとメカノセンサーカチオンチャネル
細胞はその容積を正常に維持する能力を持ち、膨張後の調節はRegulatory Volume Decrease(RVD)、縮小後の調節はRegulatory Volume Increase(RVI)と呼ばれる。これらのメカニズムには種々のチャネルやトランスポータやレセプターの働きが関与する。上皮細胞のRVDの最も初期に細胞膨張をセンスして開口し、Ca2+流入をもたらすのはTRPM7であることを昨年度明らかにした。本年度はこのメカノセンサーカチオンチャネルTRPM7のCa2+やMg2+の透過性を決定するポアのアミノ酸部位は、その選択性フィルターに存在するD1054であると同定した(Numata & Okada, 2008, Channels)。また、本チャネルが酸性条件下においてはアルカリカチオン透過性を失ってプロトンチャネルにモーダルシフトすること、そしてそのキーとなるアミノ酸部位もまたD1054であることを明らかにした(Numata & Okada, 2008, J Biol Chem)。
2.細胞死の誘導メカニズムと細胞容積調節破綻
アポトーシスの初期過程に伴われる持続性の容積縮小はApoptotic Volume Decrease(AVD)、ネクローシスに伴われる持続性膨張はNecrotic Volume Increase(NVI)と呼ばれ、これらのメカニズムにも種々のチャネルやトランスポータが関与する。ミトコンドリア仲介性アポトーシス刺激の場合も、デスレセプター仲介性アポトーシス刺激の場合も、抗癌剤シスプラチンによる癌細胞のアポトーシスの場合にもAVDを実現するための細胞外Cl-流出を担うアニオンチャネルは容積感受性外向整流性Cl-チャネル(VSOR)であることをこれまで明らかにしてきた。本年度は、類上皮癌KB細胞のシスプラチン耐性の獲得の原因が、VSORの機能発現欠失化によることを明らかにし、ヒストンデアセチラーゼ阻害剤による遺伝子発現の促進によってVSOR活性の復活が見られ、それと共にシスプラチン感受性もまた復活することを明らかにした(Lee et al., 2007, J Cell Physiol; Shimizu et al., 2008, Anticancer Res)。更に驚いたことに、VSORとパラレルに活性化されて両者でKClを流出させてAVDを実現するK+チャネルIK1もまた、このシスプラチン耐性癌細胞では欠失していることを明らかにした(Lee et al. 2008 Am J Physiol Cell Physiol)。RVIをもたらすNaCl流入路は、高浸透圧刺激によって活性化されるカチオンチャネルHypertonicity-Induced Cation Channel (HICC)、Na+/H+アンチポータ(NHE)とCl-/HCO3-アンチポータ(AE)によって与えられることがわかっているが、本年度はこのHICCの活性化が(おそらくAVDに拮抗して)スタウロスポリンによって誘導されるアポトーシスに対して防御的に働くことを明らかにした(Numata et al., 2008, Apoptosis)。
3.ストレスシグナル伝達と細胞外シグナル放出性アニオンチャネル
ストレス時に細胞から放出されたATPが細胞間シグナル伝達に重要な役割を果たすことは、多くの組織で知られている。その放出機序としてはエキソサイトーシス性のものとそうでないものがあるが、後者へのマキシアニオンチャネルの関与をこれまでに証明してきた。昨年度から本年度にかけて、グリア細胞においてもマキシアニオンチャネルが虚血性ATP放出にも(Liu et al., 2008, Purinergic Signal)、低浸透圧性ATP放出にも(Liu et al., 2008, Cell Res)関与することを明らかにし、成熟心筋細胞のマキシアニオンチャネルの分布はT管開口部に限局し、ATP放出サイトの分布とよく一致することを明らかにした(Dutta et al., 2008, Biophys J)。そして、このマキシアニオンチャネルの生物物理学的特性と生理学的役割を要約し(Sabirov & Okada, in press, J Physiol Sci)、このチャネル分子がTweetyホモログとも異なり、未同定であることを明らかにした(Okada et al., in press, “Physiology and Pathology of Chloride Transporters and Channels in the Nervous System”)。
2.3 細胞生理研究部門
痛み刺激受容・温度受容・体温調節の分子機構の解析を富永真琴が中心となって、睡眠覚醒の調節機構の解析を山中章弘が中心となって進めている。また、神経細胞発生に関わるCa2+動態とTRPチャネルの解析を柴崎貢志が進めている。
痛み刺激受容の分子機構の解析
侵害刺激受容体TRPA1が細胞内のアルカリ化によって活性化する初めてのアルカリセンサーであることを見いだし、その構造基盤も明らかにした。(J. Clin. Invest., 2008)低酸素・高グルコース環境下でPKCεによってTRPV1のリン酸化が促進し、TRPV1の機能増強が起こることを見いだした。これは、糖尿病性神経症の分子メカニズムの一つと考えられる。(論文投稿中)
TRPM2チャネル活性とグルコース代謝
膵臓β細胞に発現しているTRPM2が体温で活性化してインスリン分泌に関わっていることを以前に報告した。共同研究で、TRPM2欠損マウスの解析を行い、その単離膵β細胞で温度依存性の細胞内Ca2+濃度増加が見られないこと、経口グルコース負荷試験で野生型マウスに比べて血糖増加が大きく、正常化が遅いことを観察した。
酸味受容体の構造・機能解析
PKD2L1/PKD1L3ヘテロマーが酸刺激(pH 3.0以下)に暴露されないと活性化しないが、チャネル開口は酸刺激をoffにしたときに起こる(off channel)ことを発見し、その構造基盤を明らかにした(EMBO Report, 2008)。
ショウジョウバエPainlessの解析
ショウジョウバエで侵害性熱刺激受容に関わると推定されているPainlessが42度以上の熱によって活性化する熱活性化チャネルであり、細胞内外のCa2+濃度によって活性が制御されることを発見し、その構造基盤を明らかにした(J. Neurosci., 2008)。
表皮ケラチノサイトに発現する温度受容体TRPV3, TRPV4の解析
TRPV4がケラチノサイトでβカテニンと結合してケラチノサイトのタイトジャンクション機能の強化を介して細胞接着ひいては皮膚のバリアー機能の維持に関与することを明らかにした(論文投稿中)。また、ケラチノサイトで主にTRPV3が温度刺激で活性化して細胞内Ca2+濃度の増加からATPを放出し、温度情報を感覚神経に伝えていることを明らかにした(論文投稿中)。
神経発生における温度感受性TRPチャネルの役割の解析
マウス胎生期脊髄および後根神経節における温度感受性TRPチャネルの発現解析を行い、異なった時期に発現することを見いだした。特に、TRPV2は胎生初期に感覚神経のみならず運動神経にも発現して、その活性化が神経軸索の伸展を引き起こすことを発見した(論文投稿中)。
膀胱伸展の感知機構の解析
マウス膀胱移行上皮細胞にTRPV4が発現しており、細胞伸展に応じてTRPV4が活性化して細胞内Ca2+濃度の増加からATP放出をもたらしていることを発見した。
細胞運動の分子機構の解析
低分子 G蛋白質Rhoの標的蛋白質である mDiaと結合するDIPのノックアウトマウスの線維芽細胞(MEF)の解析を行い、DIP欠損MEFが野生型に比べて運動能、細胞接着能が有意に減弱していることを見いだした(論文投稿中)。
睡眠覚醒の調節機構の解析
オレキシン神経に光活性化蛋白質を発現するマウスを作成した。神経活動を光で制御することによってマウスの睡眠覚醒を人為的に制御することを試みている。