2 細胞器官研究系
2.1 生体膜研究部門
生体膜研究部門では脳のシナプス伝達制御メカニズムを分子レベルで解明し、また、その破綻がどのようにして‘てんかん’等の疾患をもたらすのかを明らかにする。当研究部門では最近同定した1)パルミトイル化脂質修飾酵素P-PAT、および2)てんかん関連リガンドLGI1を起点としてシナプス可塑性の根幹を成すと考えられているAMPA型グルタミン酸受容体を介したシナプス伝達の制御機構を統合的に解明することを目指している。これらの中で、2009年に発表した以下の論文を中心に紹介する。Noritake J et al, (2009) J Cell Biol 186:147-160.
神経活動依存的なPSD-95のパルミトイル化はAMPA受容体の恒常性維持に必須である
パルミトイル化脂質修飾は多くの機能蛋白質に見られる翻訳後修飾で、蛋白質の細胞内局在や機能を制御する。私どもはAMPA受容体のシナプスでの機能発現に必須であるパルミトイル化蛋白質PSD-95に着目し、PSD-95パルミトイル化酵素P-PATファミリー(DHHC2,3,7,15)を同定した。今年度は全反射蛍光顕微鏡と生化学的手法(ABE法)を用いて、海馬神経細胞におけるPSD-95のパルミトイル化動態をモニタリングした。その結果、神経活動を低下させた際にPSD-95のパルミトイル化レベルが大きく上昇して、シナプスにおけるPSD-95量が増加した。興味深いことに、P-PATのうちDHHC3は細胞体ゴルジ装置に限局し神経活動とは無関係に機能するが、DHHC2は樹状突起内に存在し、神経活動感受的にシナプス膜近傍に移動することが分かった。さらに、神経活動抑制下では、AMPA受容体のシナプス発現量が上昇することが知られているが(AMPA受容体の恒常性維持機構)、DHHC2のRNA干渉実験の結果、DHHC2によるPSD-95のパルミトイル化が、神経活動抑制によって誘導されるAMPA受容体のシナプス後膜への集積に必須であることが明らかとなった。以上の結果から、1)PSD-95のパルミトイル化レベルは、P-PATの分子種によって異なる制御を受けること、2)P-PATのひとつであるDHHC2は神経活動の低下を感知してシナプス膜近傍に移動し、パルミトイル化PSD-95量を増加させること、3)この制御系はAMPA受容体の恒常性維持の表現型であるSynaptic scalingに必須であることが明らかになった。パルミトイル化酵素ファミリー分子の局在多様性が、極性化した神経細胞における基質蛋白質の局在を巧妙に制御していることを示唆する。
一方、私どもはてんかん関連リガンドLGI1によるAMPA受容体制御機構とその破綻によるてんかん発症の分子メカニズムに関しても検討した。
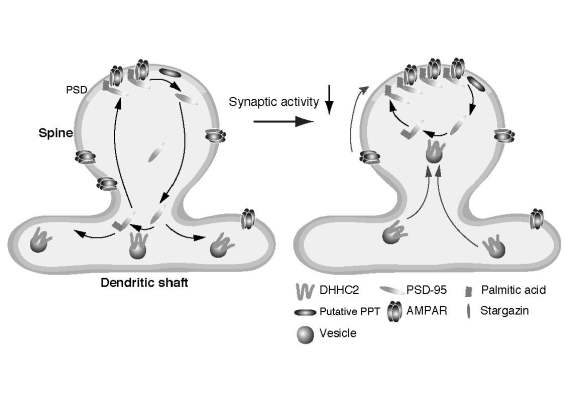
図5.2. パルミトイル化酵素DHHC2によるAMPA受容体恒常性維持機構モデル PSD-95は主に樹状突起内に存在するDHHC2によるパルミトイル化とシナプス膜での脱パルミトイル化により、シナプス膜と樹状突起内をサイクルする(左)。神経活動低下時には、DHHC2が素早くシナプス膜近傍に移動し、効率良くPSD-95をパルミトイル化し、シナプスPSD-95
量さらにはAMPA受容体量を増加させる。
2.2 機能協関研究部門
私達の部門は1992年以来、容積調節や吸収・分泌機能や環境情報受容などのようにすべての細胞種が持っている最も一般的で基本的な細胞機能とそのメカニズムを、チャネル、トランスポータ、センサーなどの膜機能分子の働きとして統合的に解明すると共に、細胞死誘導のメカニズムをそれらの異常として把握することを目標に研究している。2009年度は、主として次の2研究課題に取組んだ。
1.細胞死の誘導メカニズムと細胞容積調節破綻
細胞死誘導過程においては細胞容積調節が破綻している。アポトーシスの初期過程に伴われる持続性の容積縮小はApoptotic Volume Decrease(AVD)、ネクローシスに伴われる持続性膨張はNecrotic Volume Increase(NVI)と呼ばれ、これらのメカニズムにも種々のチャネルやトランスポータが関与する。特に、容積感受性外向整流性アニオンチャネル(VSOR)は、多くの生理的/病態生理的条件下において誘導されるAVDやNVIに対して、それぞれCl-の流出及び流入の通路を与える役割を果たすことを私達は明らかにしてきた。抗癌剤シスプラチン刺激下での癌細胞アポトーシスや虚血・再灌流条件下での脳・心臓細胞アポトーシス、そして乳酸アシドーシス時のグリア細胞ネクローシスやグルタミン酸過興奮毒性下での脳神経細胞ネクローシスにおけるVSORの役割を要約し、このチャネル分子の同定が極めて重要であることを明らかにした(Okada et al., 2009, J Physiol)。
細胞縮小時の容積調節はRegulatory Volume Increase (RVI)と呼ばれるが、AVD時にはこのRVI能が障害されていることを以前示した。今回、そのシグナルメカニズムを調べたところ、上皮細胞RVI時には蛋白キナーゼAkt1の活性化が重要な役割を果たしていること、そしてスタウロスポリンによるアポトーシス誘導時にはROS産成とそれに伴うMAPKKキナーゼASK1の活性化が見られ、この活性型ASK1によるAkt1活性化の抑制がRVI障害の原因となることを明らかにした(Subramanyam et al., J Biol Chem, in press)。
2.ストレスシグナル伝達と細胞外シグナル放出性アニオンチャネル
ストレス時に細胞から放出されたATPが細胞間シグナル伝達に重要な役割を果たすことは、多くの組織で知られている。その放出機序としてはエキソサイトーシス性のものとそうでないものがあるが、後者へのマキシアニオンチャネルの関与をこれまでに証明してきた。今回、このマキシアニオンチャネルの活性化メカニズムにチロシン脱リン酸化が関与していること、そしてマウス線維芽細胞の場合にはその反応にレセプラー型チロシン脱リン酸化酵素RPTPζが関与することを明らかにした(Toychiev et al., 2009, Am J Physiol Cell Physiol)。
一方、細胞間シグナル伝達は種々の経路から細胞外へと放出されるグルタミン酸によっても担われる。例えば、炎症時初期に生成されるブラジキニンによる刺激によってアストロサイトからグルタミン酸が放出され、隣接ニューロンに情報伝達することが知られている。今回、そのグルタミン酸放出の通路を調べたところ、ブラジキニンの作用によりアストロサイト内に生成されたROSが直接VSORを活性化し、このVSORを通ってアニオンであるグルタミン酸が放出されることが明らかになった(Liu et al., 2009, J Physiol)。
2.3 細胞生理研究部門
痛み刺激受容・温度受容・機械刺激受容・体温調節の分子機構の解析を富永真琴が中心となって、睡眠覚醒調節の分子機構の解析を山中章弘が中心となって進めている。
痛み刺激受容の分子機構の解析
低酸素・高グルコース環境下でPKCεによってTRPV1のセリン残基のリン酸化が促進し、TRPV1の機能増強(細胞外Ca2+依存性脱感作の抑制)が起こることを見いだしたが、この応答には主に低酸素なかんずくHIF-1αが関与することを見いだした。また、PKCεの形質膜移行の促進も低酸素でHIF-1α依存的に進むことが明らかになった(論文投稿中)。
体温と糖・脂質代謝 25度から20度への5度という小さな環境温度低下が、交感神経機能亢進によるインスリン分泌低下を介した耐糖能の異常をもたらすことを見いだした。また、熱産生をあまりもたらさないものの、糖の取り込みと脂肪酸代謝に関わる分子の皮下白色脂肪特異的な発現増加を発見し、皮下白色脂肪特異的な脂肪酸合成が惹起することを見いだした(論文投稿中)。
表皮ケラチノサイトから感覚神経への温度情報伝達
ケラチノサイトには温度感受性TRPV3, TRPV4チャネルが発現している。イオンチャネル型ATP受容体2X2を強制発現させたHEK293細胞をバイオセンサーとして用いて、温度刺激したケラチノサイトからATPが局所放出されることを見いだした。TRPV3,
TRPV4欠損ケラチノサイトを用いた解析で、主にTRPV3が関わっていることが明らかになった(European J. Physiol., 2009)。
膀胱伸展の感知機構の解析 マウス膀胱移行上皮細胞にTRPV4が発現しており、機械伸展刺激(あらたにシリコン膜上に細胞を培養して伸展刺激を加える装置を開発した)に応じてTRPV4が活性化して細胞内Ca2+濃度の増加からATP放出をもたらしていることを発見した。この応答は野生型マウスの膀胱上皮細胞では観察されるが、TRPV4欠損マウスでは観察されず、TRPV4に強く依存することが明らかになった(J. Biol. Chem., 2009)。
細胞運動の分子機構の解析
低分子 G蛋白質Rhoの標的蛋白質である mDiaと結合するDIPのノックアウトマウスを作製して解析を行った。DIP欠損線維芽細胞が野生型線維芽細胞に比べて運動能、細胞接着能が有意に減弱していることを、細胞運動の経時解析・細胞播種後の接着性解析・細胞運動や接着に関与する分子の発現解析等によって明らかにした(Genes
to Cells, 2009)。
昆虫温度感受性TRPチャネルの解析
名古屋大学門脇辰彦博士との共同研究によって、キョウソヤドリバチのTRPチャネルを複数クローニングし、そのうちNvHsTRPAチャネルに温度感受性があることを発見した(BMC Evolutionary Biology, 2009)。
睡眠覚醒の調節機構の解析
オレキシン神経に光活性化蛋白質(チャネルロドプシン、ハロロドプシン、メラノプシン)を発現するマウスを作成した。それらのマウス視床下部に特異的な波長の光をあてて、オレキシン神経を脱分極あるいは過分極させることに成功した。神経活動を光で制御することによってマウスの睡眠覚醒を人為的に制御することを試みている。