2 細胞器官研究系
2.1 生体膜研究部門
生体膜研究部門では脳のシナプス伝達制御メカニズムを分子レベルで解明し、また、その破綻がどのようにして`てんかん'等のシナプス疾患を引き起こすのかを明らかにする。当研究部門では独自に同定した 1)てんかん関連リガンドLGI1、および2) パルミトイル化脂質修飾酵素DHHC蛋白質を起点としてシナプス可塑性の根幹を成すと考えられているAMPA型グルタミン酸受容体を介したシナプス伝達の制御機構を解明することを目指している。これらの中で、2010年に発表した以下の論文を中心に紹介する。Fukata Y et al (2010) Proc Natl Acad Sci USA 107:3799-3804.
LGI1が仲介する蛋白質質複合体の破綻はシナプス伝達異常とてんかんを引き起こす
てんかんは人口の約1%に見られる一般的な神経疾患で、神経細胞、神経回路の異常発火が主たる原因と考えられている。LGI1はヒトのある種の家族性部分てんかん家系で変異が見られる神経系に特異的な分泌蛋白質であるが、その機能に関しては殆ど分かっていない。私共は2006年にラット脳組織から足場蛋白質PSD-95を含むシナプス蛋白質複合体を精製し、LGI1とその受容体ADAM22を同定した。しかし、その生理機能に関しては不明であった。
今回、私どもはLGI1遺伝子欠損(KO)マウスを作成し、全てのKOマウスが生後2--3週間で致死性のてんかん発作を呈することを見出した。また、LGI1の脳内の主な受容体が、てんかん関連蛋白質ADAM22とその類縁蛋白質ADAM23であることを見出した。興味深いことにADAM22、ADAM23のKOマウスもLGI1 KOマウス同様、致死性てんかんを引き起こすことが報告されていた。LGI1はADAM22とADAM23の3者からなる蛋白質複合体を形成するが、LGI1 KOマウスではシナプスにおけるこの複合体形成が阻害され、てんかんが起こると考えられた(図)。さらに、このLGI1 KOマウスの海馬では、脳内の主要な興奮性神経伝達を司るAMPA型グルタミン酸受容体を介したシナプス伝達の異常(低下)が認められた。このように、LGI1は細胞外から脳の興奮性を調節して、てんかんの発症を防ぐ役割をする重要な分泌蛋白質であると考えられた。さらに、LGI1 KOマウスはヒトのてんかんモデルマウスとしても有用であると考えられる。
一方、私どもは神経細胞における興奮性シナプスの代表的な足場蛋白質であるPSD-95のパルミトイル化修飾の可視化を試み有望なプローブを得た。本プローブを用いてシナプス形成、可塑性の分子機構についても検討した。
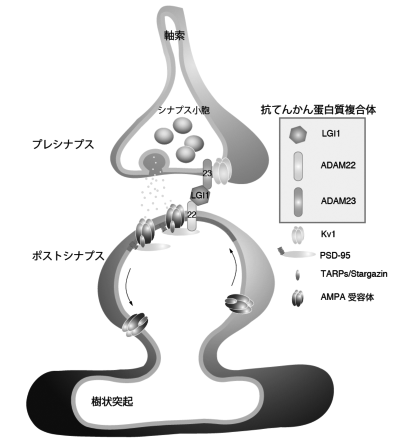
図. LGI1-ADAMから成る抗てんかん蛋白質複合体
LGI1はシナプス間隙に分泌され、ADAM22, ADAM23と複合体を形成し、プレシナプスとポストシナプスを架橋すると考えられる。その結果、AMPA受容体機能を制御し、精緻なシナプス伝達を可能とする。LGI1がなくなったり、分泌が減ると、3者の結合が減少し、てんかん発作(ヒトでは家族性特発性部分てんかん)が引き起こされる。
2.2 機能協関研究部門
私達の部門は1992年以来、容積調節や吸収・分泌機能や環境情報受容などのようにすべての細胞種が持っている最も一般的で基本的な細胞機能とそのメカニズムを、チャネル、トランスポータ、センサーなどの膜機能分子の働きとして統合的に解明すると共に、細胞死誘導のメカニズムをそれらの異常として把握することを目標に研究している。また最近では、網膜における視覚情報処理のメカニズムを解明するための研究も開始している。2010年度は、主として次の3研究課題に取組んだ。
1.細胞容積調節とその破綻としての細胞死誘導のメカニズム
細胞死誘導過程においては細胞容積調節が破綻している。アポトーシスの初期過程に伴われる持続性の容積縮小はApoptotic Volume Decrease(AVD)、ネクローシスに伴われる持続性膨張はNecrotic Volume Increase(NVI)と呼ばれ、これらのメカニズムにも種々のチャネルやトランスポータが関与する。
細胞縮小時の容積調節はRegulatory Volume Increase(RVI)と呼ばれるが、AVD時にはこのRVI能が障害されていることを以前示した。今回、そのシグナルメカニズムを調べたところ、ヒト上皮細胞RVI時には蛋白キナーゼAkt1の活性化が不可欠であること、そしてスタウロスポリンによるアポトーシス誘導時にはROS産成とそれに伴うMAPKKキナーゼASK1の活性化が見られ、この活性型ASK1によるAkt1活性化の抑制がRVI障害の原因となることを明らかにした(Subramanyam et al., 2010, J Biol Chem)。
細胞膨張時の容積調節はRegulatory Volume Decrease(RVD)と呼ばれるが、そのときの容積調節性Cl-流出路を与えるのが容積感受性外向整流性アニオンチャネル(VSOR)である。今回、東京医大の小西教授のグループとの共同研究によって、白色脂肪細胞にもVSORが発現しており、RVDを担うこと、そして糖尿病マウスの脂肪細胞ではこのVSORの発現が低下しており、RVD能も抑制されていることを明らかにした(Inoue et al., 2010, Am J Physiol Cell Physiol)。
2.バイオ分子センサーチャネルの分子メカニズムの解明
イオンチャネルはイオン輸送や電気信号発生のみならず、環境因子に対するセンサーとしての機能も果たしている。
PKA賊活性アニオンチャネルCFTRは、上皮のみならず心臓にも発現しており、虚血情報を検知するバイオ分子センサーであることをこれまで明らかにしてきた。今回、このCFTRが、モルモット心室筋細胞膜上でクラスター状に発現することを明らかにした(James et al., 2010, Biochem Biophys Res Commun)。
ASICは酸をセンスするNa+チャネルであるが、今回、産業医大の上田教授のグループとの共同研究によって、低酸素状態における乳酸増を検知してバソプレッシン神経を興奮させ、バソプレッシン分泌を高めることを明らかにした(Ohbuchi et al., 2010, J Physiol)。
3.網膜における視覚情報処理のメカニズム解明
網膜はただ光を感じて電気信号に変換しその情報を脳中枢につたえているだけでなく、それぞれの視覚情報から色や形、動きなどの特徴抽出を行う情報処理を担っている。しかしこれまでそうした特徴抽出を担う網膜内神経回路の解析はほとんど進んでこなかった。特に動きを検知する神経回路の詳細については、いまだ議論があり、小泉らは計算機シミュレーションモデルから、抑制性神経回路が、動きの検知感度を高めている可能性を示唆した(Koizumi et al., 2010, J Integ Neurol)。こうした網膜内神経回路の機能解析のためのツールとして、これまでに光感受性センサータンパク質であるメラノプシンに注目し、メラノプシンの遺伝子導入により網膜神経回路の特定の細胞を光によって刺激することにより神経回路の解析を進めてきた。そのために、今回、網膜への遺伝子導入法と簡便なスクリーニング法の開発のためげっ歯類網膜の組織培養法を確立した(Moritoh
et al., 2010, PLoS One)。この培養法により、遺伝子銃を用いた改変メラノプシンの遺伝子導入にも成功した。
2.3 細胞生理研究部門
痛み刺激受容・温度受容・機械刺激受容・体温調節の分子機構の解析を富永真琴が中心となって、睡眠覚醒調節の分子機構の解析を山中章弘が中心となって進めている。
神経に発現するTRPV2チャネルの機械刺激感受性の解析
マウス胎生期での温度感受性TRPチャネル遺伝子の発現解析から、TRPV4 mRNAがTRPV1, TRPM8よりかなり早く胎生期10日頃から脊髄前角運動神経と後根神経節細胞に発現していることが判明した。TRPV2蛋白質の発現、機能的発現も確認し、TRPV2が機械伸展刺激を感知して軸索伸展をもたらしていることを見いだした (J Neurosci, 2010)。
腸管神経叢の抑制性運動神経にもTRPV2が発現していることを遺伝子および蛋白質レベルで確認し、nNOSとの共発現を観察した。腸管抑制性運動神経のTRPV2は機械刺激によって活性化した。TRPV2刺激薬でマウス小腸の収縮力がNO依存的に減弱し、TRPV2刺激薬は腸管からのNO放出を促進した。TRPV2刺激薬によってマウス腸管内の物質移動は著しく促進された。食塊による腸管壁伸展を抑制性運動神経のTRPV2が感知し、Ca2+流入からNO産生をもたらして肛門側の腸管弛緩を導いているものと考えられた (J Neurosci, 2010)。
表皮ケラチノサイトに発現するTRPV4の解析
TRPV4の表皮ケラチノサイトでの機能を明らかにする目的でケラチノサイトcDNAライブラリーからTRPV4と結合する蛋白質を探索し、βカテニンが結合することを見いだした。TRPV4欠損皮膚では細胞間接着構造が乱れ、タイトジャンクションの形態、機能異常から水分の漏出が起こり、皮膚のバリア機能が大きく減弱していることが明らかになった。皮膚温でTRPV4が活性化して細胞内へCa2+を流入させ、細胞骨格編成からアドヘレンスジャンクション機能、タイトジャンクション機能を増強しているものと考えられた (J Biol Chem, 2010)。
酸味受容に関与するPKD2L1/PKD1L3複合体の解析
TRPPチャネルに属するPKD2L1とPKD1L3は複合体を形成して酸受容(オフ応答)に関わることが知られている。マウス舌有郭乳頭において、PKD2L1/PKD1L3複合体がオフ応答を示す酸受容体として機能していることを細胞染色法、Ca2+イメージング法、パッチクランプ法を用いて明らかにした (J Biol Chem, 2010)。
昆虫温度感受性TRPチャネルの解析
ミツバチは特異な温度依存性社会行動をとることが知られている。ミツバチのTRPチャネルを探索し、いくつかのTRPチャネル遺伝子を得た。そのうち、ミツバチに特異的なTRPAチャネルが34度を超える温度刺激や昆虫忌避剤あるいは防虫剤として知られる複数の化学物質によっても活性化することを見いだした。ミツバチを使った行動解析でも、熱刺激や活性化能が明らかになった化学物質刺激に対して、ミツバチが忌避行動をとることが判明した (J Neurosci, 2010)。
睡眠覚醒の調節機構の解析
睡眠 覚醒調節に重要な視床下部のオレキシン神経細胞が、覚醒を維持するメカニズムを神経細胞レベルにおいて明らかにした。オレキシン神経特異的に 緑色蛍光タンパク質(EGFP)を発現する遺伝子改変マウスとオレキシン受容体欠損マウスを用い、オレキシン神経細胞がオレキシン2受容体を 介してオレキシンによって活性化されることを見いだした。免疫電子顕微鏡を用いた解析によって、オレキシン神経細胞同士が直接シナプス様構造 によって連絡していることを明らかにしたことより、オレキシン神経間のポジティブフィードバックによるオレキシン神経活動の持続が覚醒の維持 に重要な役割を担っていることを明らかにした (J Neurosci, 2010)。
睡眠覚醒調節に重要な視床下部のオレキシンペプチド産生神経に光活性化蛋白質(チャネルロドプシン、ハロロドプシン、メラノプシン)を発現する遺伝子改変マウスを作成した。それらのマウス視床下部に光ファイバーを用いて様々な波長の光を照射し、オレキシン神経を脱分極あるいは過分極させることに成功した。神経活動を光で制御することによって、マウスの睡眠覚醒を人為的に制御制御に成功した(論文投稿中)。
Copyright (C) 2010 NIPS