2)多角形の上皮細胞の角:トリセルラージャンクションの分子構築と機能の研究
|
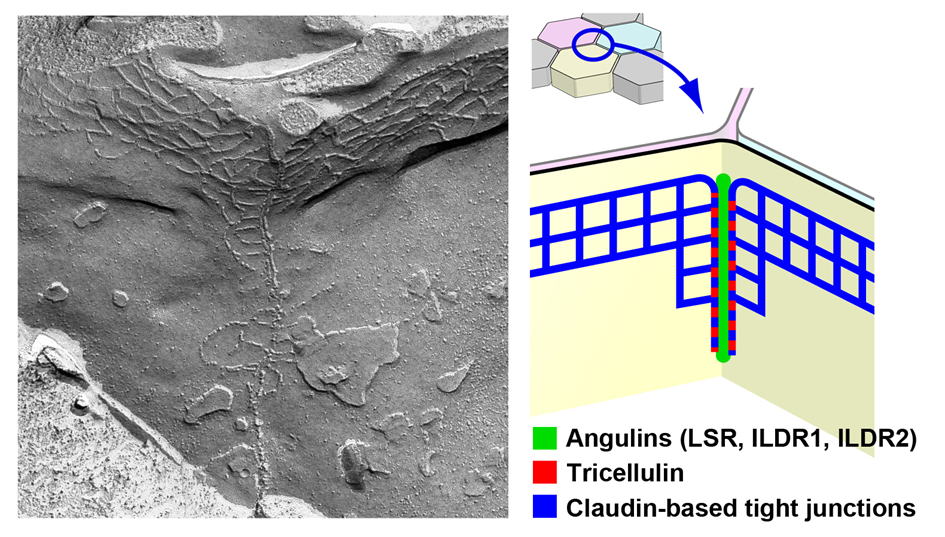
タイトジャンクションはクローディンが2細胞間につくるジッパー状の構造ですが、3つの細胞の角(かど)が接する領域には、トリセルラータイトジャンクションとよばれる特殊な形態のタイトジャンクションが存在して、この部分からの漏れを防いでいます。2005年にトリセルラータイトジャンクションの構成分子としてトリセルリンが初めて同定されました。トリセルリンは、トリセルラータイトジャンクションの形成と上皮バリア機能に重要な役割を果たす膜タンパク質ですが、トリセルリンの詳細な機能やトリセルラー領域に局在する機構はよくわかっていませんでした。最近私たちは、細胞内局在を指標とした発現クローニング法によるスクリーニングを続ける過程で、トリセルラータイトジャンクションに濃縮する新規膜タンパク質LSRを同定することに成功しました。さらに、LSRの相同分子ILDR1, ILDR2もトリセルラータイトジャンクションに局在することを見出し、これらをまとめてアンギュリンファミリーangulin family(angulus:「角」のラテン語)とよぶことを提唱しています。これまでにアンギュリンファミリーは上皮の十分なバリア機能に必要であること、トリセルリンをトリセルラー領域にリクルートする役割があることを明らかにしました。上皮細胞の角の部分の構造やふるまいは上皮機能にとって潜在的に重要であると思われているものの、この部分に着目した分子レベルの研究はトリセルリンを除いてほとんど例がありません。私達が見出したアンギュリン--トリセルリン系の上流と下流を研究することにより、トリセルラージャンクションの形成機構と機能の分子基盤を明らかにしたいと考えています。 |
 |
|
| (左)マウス小腸上皮上皮細胞のトリセルラータイトジャンクションの凍結割断レプリカ像 (右)我々の研究によるトリセルラータイトジャンクションの構造モデル | |
|
|
 |
|
|
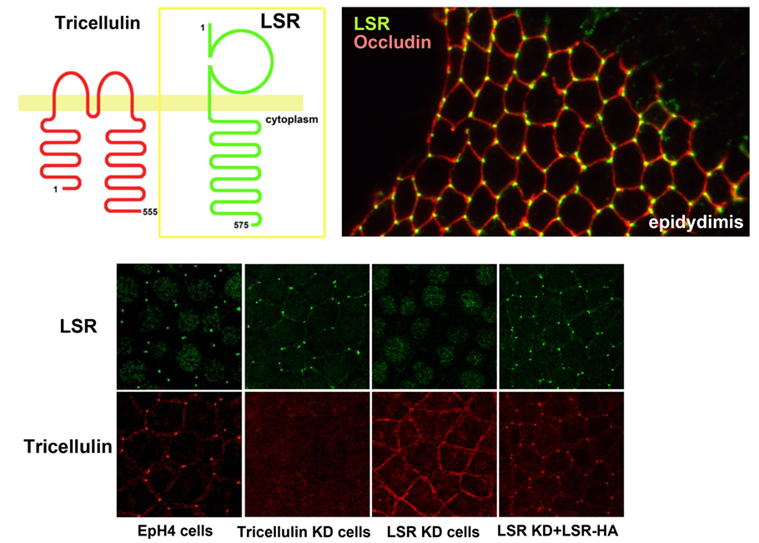
LSRは細胞外にIg-likeドメインを持つ膜タンパク質で(左上)、様々な上皮細胞のトリセルラータイトジャンクションに局在する(右上)。トリセルリンをノックダウンした培養上皮細胞においてLSRはトリセルラーコンタクトすなわち細胞の角の領域に局在するが、LSRをノックダウンした細胞ではトリセルリンの局在が乱れ、この細胞にLSRを強制発現により戻すとトリセルリンの局在が回復する(下)。したがって、LSRはトリセルリンの局在を規定することにより、トリセルラータイトジャンクション形成と十分な上皮バリア機能にきわめて重要な役割を果たしていると考えられる。 |
|
|
|
|
 |
|
|
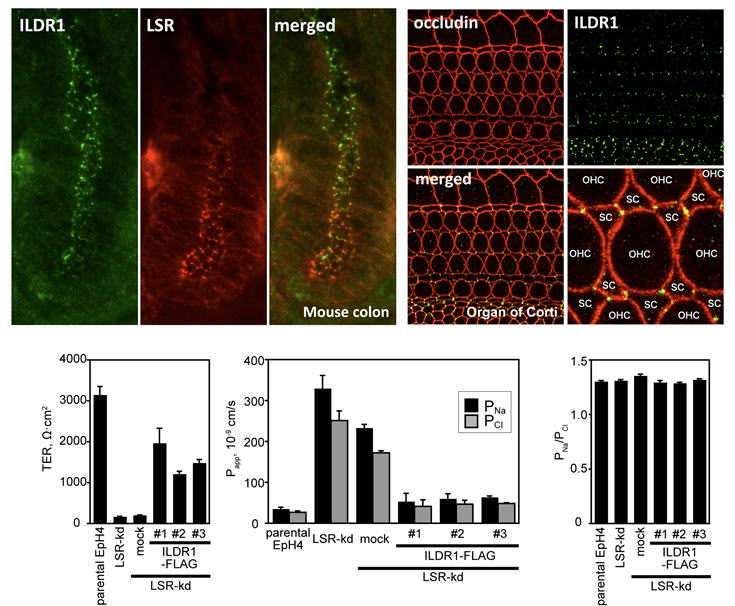
(左上)マウス大腸陰窩におけるLSR/angulin-1とILDR1/angulin-2の発現。(右下)マウス内耳コルチ器におけるILDR1/angulin-2の発現。ILDR1遺伝子の変異がヒト遺伝性難聴DFNB42の原因となることが報告されている。(下)ILDR1は上皮細胞シートのバリア機能に関与する。 |
|