パルミトイル化サイクルによるシナプス・ナノドメイン構築機構の解明
[背景]
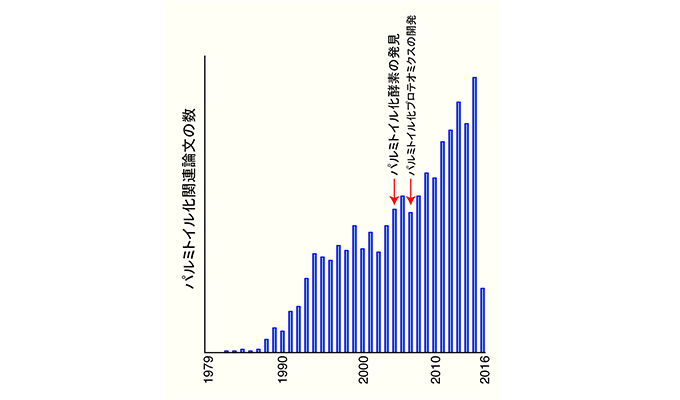
蛋白質パルミトイル化修飾は、リン酸化やユビキチン化と同様に蛋白質の機能を制御する翻訳後修飾の一つで、1979年にSindbis ウイルス蛋白質で発見されました。パルミトイル化修飾は蛋白質のシステイン残基にパルミチン酸を付加することで、蛋白質の疎水性を増加させ、蛋白質の局在や機能を制御します。重要なことに、この脂質修飾はリン酸化と同様に可逆反応であり、外界刺激依存的にそのサイクルが制御されています。代表的な基質蛋白質としては、3量体G蛋白質αサブユニット、低分子量G蛋白質HRasや様々なGPCR等の膜蛋白質が報告されています。1998年にBredt博士らにより、シナプスの中心的足場蛋白質PSD-95がパルミトイル化修飾を受け、神経活動依存的にPSD-95のパルミトイル化サイクルが制御されていることが報告され、そのシナプス機能における重要性が提唱されました。
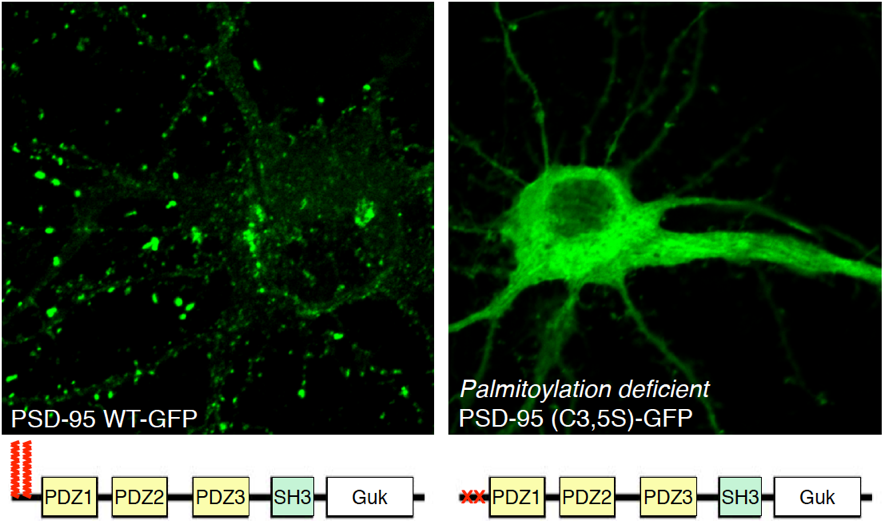
図1 野生型PSD-95はシナプス後膜(PSD)でクラスターを形成するのに対し(左)、 パルミトイル化されないPSD-95は細胞質に局在し(右)、足場蛋白質としての機能を失います。このようにパルミトイル化は 蛋白質の局在と機能を制御します。
[当研究室における研究の経緯]
1) PSD-95パルミトイル化酵素の同定 2004年に酵母の遺伝学的知見を基に、哺乳動物におけるパルミトイル化酵素ファミリーをゲノムワイドに単離し、PSD-95パルミトイル化酵素を同定しました。
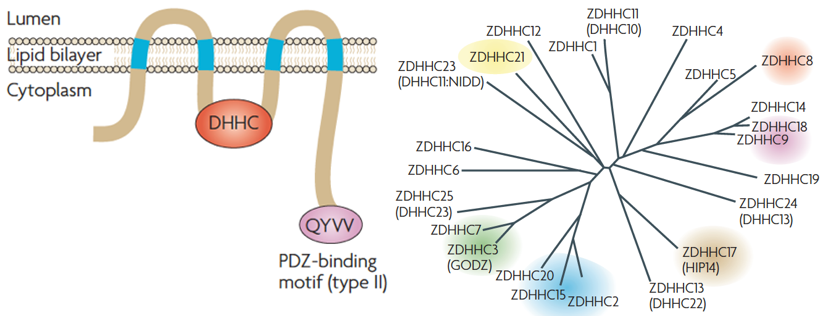
図2 DHHCパルミトイル化酵素群は、酵母から線虫、植物、マウス、ヒトに至るまで広く保存されている酵素ファミリーです。哺乳動物では23種類の DHHCパルミトイル化酵素が存在し、サブファミリー毎に局在や基質特異性が異なります。
2) DHHC酵素ライブラリーによる様々な基質—酵素ペアの同定と機能解析 世界中の研究者との共同研究により、パルミトイル化酵素の様々な細胞、組織における生理機能を明らかにし、当該分野を牽引してきました。
3) PSD-95パルミトイル化酵素DHHC2とDHHC3による異なる制御機構 海馬神経細胞におけるPSD-95パルミトイル化酵素(DHHC2とDHHC3)の解析を通じて、パルミトイル化酵素が、分子種に応じて異なる細胞内局在、制御機構を有することを報告しました。
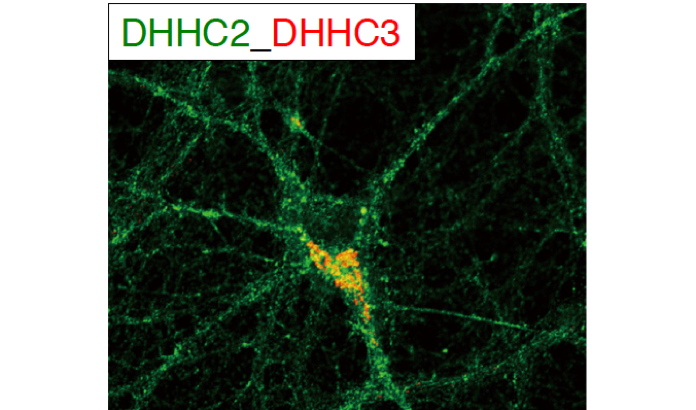
図3 DHHC3は細胞体のゴルジ装置に存在しているのに対し、DHHC2は樹状突起内の小胞やスパイン膜に存在し、神経活動依存的にその活性が制御されていることが分かりました
4) PSDナノドメインの発見と局所パルミトイル化サイクル説の提案 超解像イメージングとパルミトイル化PSD-95可視化プローブを用いて、PSDナノドメインを発見し、このPSDナノドメインがAMPA受容体を捕捉する基本単位であることを見出しました。そして、PSDナノドメインの構築、維持、再編には、シナプス後膜に局在するパルミトイル化酵素DHHC2が必須であることを見出しました。
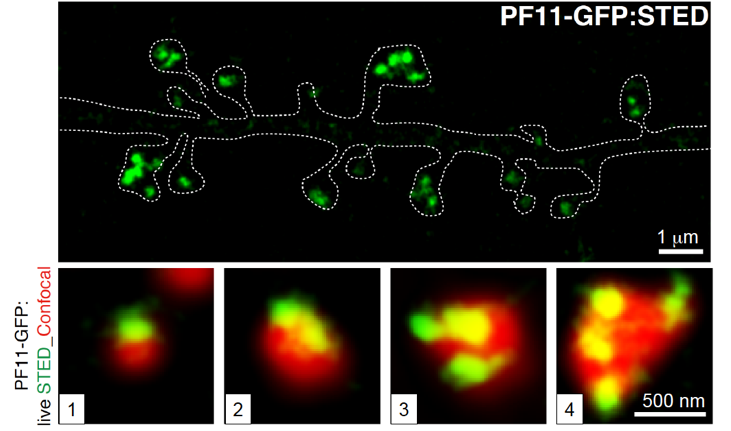
図4 パルミトイル化PSD-95は、共焦点顕微鏡では1つの塊として観察されますが(赤色)、STED顕微鏡で観察すると直径200 nm前後のPSDナノドメインの集合体として存在していることが分かりました。
5) 脱パルミトイル化酵素の同定と、パルミトイル化蛋白質の定量法の開発 PSD-95脱パルミトイル化酵素を同定し、その神経細胞における機能を解析しています(in revision)。
6) 今後の展開 a) 個体におけるPSD-95(脱)パルミトイル化酵素の神経生理機能の解明 b) パルミトイル化サイクルの意義の解明とその破綻による病態機構の解明 c) パルミトイル化サイクルの時空間的操作技術の開発 d) PSD-95(脱)パルミトイル化酵素の活性制御機構の解明
[研究の意義、波及効果]
1)シナプス形成や、AMPA受容体を介したシナプス伝達の制御機構の解明が期待できます。 2)蛋白質の細胞内局在決定機構および特殊膜ドメイン形成機構の解明に貢献できると思われます。 3)ウイルス構成蛋白質の多くは宿主細胞のパルミトイル化酵素によりパルミトイル化修飾を受けます。このパルミトイル化はウイルスの出芽・感染過程に必須であることから、パルミトイル化関連酵素は抗ウイルス薬の標的となる可能性があります。
パルミトイル化は、最近、多くの研究者が注目するホットな研究分野になりつつありますが、詳細な制御メカニズムは、まだまだ明らかになっていません。私たちとパルミトイル化のパイオニアとして、最前線で一緒に研究をしてみませんか?