脇道にそれる例として私たちは、脳幹の下オリーブ核から小脳プルキンエ細胞(Purkinje cell)に投射する登上線維(climbing fiber)の興奮性伝達物質 (グルタミン酸と推定)が、分子層介在ニューロン(molecular layer interneuron)から同じプルキンエ細胞に入力するGABA作動性のシナプス伝達を抑圧することを見出しました(図1)。 抑制性入力が減弱するため、登上線維入力を受けて興奮したプルキンエ細胞の興奮性は、 さらに強化される[即ち、脱抑制(disinhibition)]と考えられます(Satake et al., 2000)。
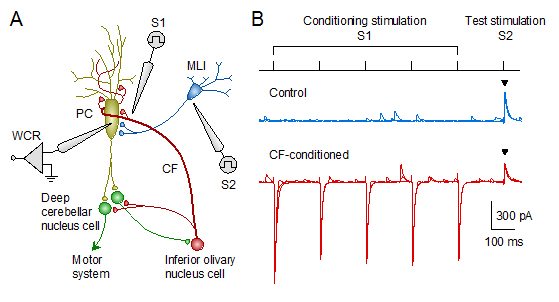
| 図1:小脳皮質の異種シナプス間拡散性クロストーク。 (A)全細胞パッチクランプ法(whole-cell recording, WCR)により、プルキンエ細胞(PC)からシナプス後電流を記録する。 ガラス電極(S1)を用いて登上線維(CF)に条件刺激を与えた後、別のガラス電極(S2)にて介在ニューロン(MLI)軸索にテスト刺激を付加した。 (B)登上線維の反復刺激(5ヘルツで1秒間)に伴い、介在ニューロン−プルキンエ細胞間のGABA作動性伝達(抑制性シナプス後電流)が減弱した(▼印)。 |
また、ニューロン型グルタミン酸輸送体EAAT4(プルキンエ細胞特異的に発現)とグリア型グルタミン酸輸送体GLAST[シナプスを被覆するバーグマングリア(Bergmann glia)に発現]は、 グルタミン酸が登上線維終末から籠細胞終末に拡散していく過程をそれぞれ独立に制御できることを明らかにしました(Satake et al., 2010)。プルキンエ細胞は小脳皮質で唯一の出力細胞です。 また、登上線維−プルキンエ細胞間の興奮性シナプスは極めて強固なため、世界中で古くから研究されてきた重要なシナプスです。この重要なシナプスが、同時に異種シナプス抑制を 起こすことにより小脳出力を強化するという巧妙な仕掛けを併せ持つことの意義を考えると、 (伝達物質が)脇道にそれる現象を研究することも、(脳の情報処理機構を理解するには)あながち脇道にそれた研究ではないのではないかと思えてきます。
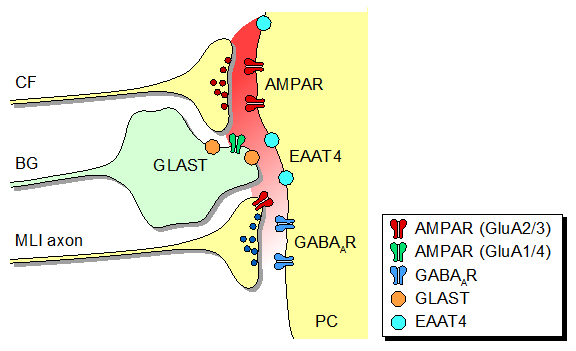
| 図2:登上線維(CF)から放出された興奮性伝達物質は、 後シナプス性AMPA受容体を活性化してプルキンエ細胞を興奮させるとともに、シナプス間隙の外にまで拡散する。 拡散した伝達物質は、介在ニューロン(MLI)軸索終末の前シナプス性AMPA受容体(GluA2/3)に作用することにより、 介在ニューロンのGABA放出を抑制する。こうしたシナプス外拡散は、プルキンエ細胞やバーグマングリア(BG)の グルタミン酸輸送体(EAAT4/GLAST/GLT-1)によって常に阻害されているものの、反復刺激に伴い大量に放出された登上線維伝達物質は、 輸送体の回収能を超えて介在ニューロンのAMPA受容体に到達する。 |
2.シナプス小胞の多重性放出
中枢神経の軸索終末では、活動電位の伝播に伴い、1個のシナプス小胞が開口放出されると考えられてきました[単一性放出(univesicular release)]。 その一方で、1回の活動電位当たり、複数のシナプス小胞が複数の放出部位から同期的に、もしくは単一の放出部位から連続的に放出される、多重性放出(multivesicular release)の存在も指摘されています。シナプス小胞の単一性/多重性放出の違いは、神経終末のCa2+動態や放出機構の性質の違いによって生じると推定されてきました。 しかし、神経終末のシナプス小胞放出ダイナミクスを制御するメカニズムは、まだほとんど解明されていません。私たちは、ラット小脳顆粒細胞(granule cell)から分子層介在ニューロンへの興奮性シナプスにおいて、顆粒細胞の2回パルス刺激(30〜100ミリ秒間隔)に伴い、 介在ニューロンから記録される興奮性シナプス後電流(excitatorypostsynaptic current, EPSC)の2回目の振幅値と減衰時定数(t)が、 刺激間隔に依存して一過性に増大する現象を発見しました(図3)。減衰時間のペアパルス増大は、シナプス小胞の放出多重性に伴う 興奮性神経伝達物質グルタミン酸のシナプス間蓄積によって引き起こされたと推定しています(Satake et al., 2012)。
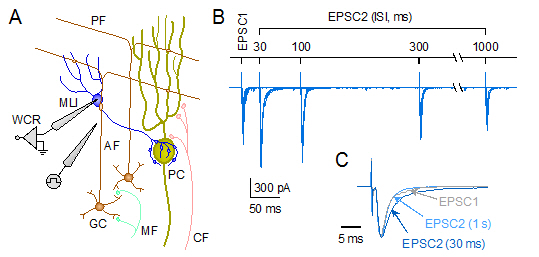
| 図3:小脳顆粒細胞−介在ニューロン間興奮性シナプスにおけるペアパルス増強。 (A)顆粒細胞(GC)軸索(上行性線維:ascending fiber,
AF)を電気刺激し、介在ニューロン(MLI)からEPSCを記録する。 (B)2回のパルス刺激に伴い、2回目EPSC(EPSC2)の振幅値と減衰時定数(t)が一過性に1回目EPSC(EPSC1)より増大する。苔状線維mossy
fiber, MF、平行線維parallel fiber, PF。(C)振幅を揃えたEPSCトレース[灰色:EPSC1、濃青色:EPSC2(ISI
= 30 ms)、薄青色:EPSC2(ISI = 1 s)]。 |
しかし、EPSCの減衰時間が多重性放出によって決定されるという現象はこれまで報告がなく、 その分子的背景も明らかでありませんでした。そこで、EPSC減衰時間のペアパルス増大を実験モデルとして、 多重性放出の発現メカニズムを追究しました。その結果、顆粒細胞の多重性放出は、 (1)複数のCav2.1チャネルを介して顆粒細胞の軸索終末に流入したCa2+が流入部位から周囲に拡散して蓄積すること、 (2)蓄積したCa2+がチャネル近傍に局在するシナプス小胞/Ca2+センサー複合体のみならず、 (3)遠位の小胞/Ca2+センサー複合体にも作用して複数のシナプス小胞を放出させることによって惹起されたことなどが明らかになりました (Satake and Imoto., 2014)。Ca2+チャネルサブタイプに依存した異なるシナプス小胞放出過程(単一性放出と多重性放出)の発見は、 脳の情報処理プロセスに多様性を生み出すメカニズムの一つとして、今後の神経回路研究に新しい道を拓くと期待されます(Satake et al., 2015)。
参考文献
Satake S., Saitow F., Yamada J.,Konishi S. (2000) Synaptic activation of AMPA receptors inhibits GABA release from cerebellar interneurons. Nat. Neurosci. 3, 551-558. [PubMed]
Satake S., Saitow F., Rusakov D.,Konishi S. (2004) AMPA receptor-mediated presynaptic inhibition at cerebellar GABAergic synapses: a characterization of molecular mechanisms. Eur. J. Neurosci. 19, 2464-2474. [PubMed]
Satake S., Song S.-Y., Cao Q., Satoh H., Rusakov D. A., Yanagawa Y., Ling E.-A., Imoto K.,Konishi S. (2006) Characterization of AMPA receptors targeted by the climbing fiber transmitter mediating presynaptic inhibition of GABAergic transmission at cerebellar interneuron-Purkinje cell synapses. J. Neurosci. 26, 2278-2289. [PubMed]
Satake S., Song S.-Y., Konishi S.,Imoto K. (2010) Glutamate transporter EAAT4 in Purkinje cells controls intersynaptic diffusion of climbing fiber transmitter mediating inhibition of GABA release from interneurons. Eur. J. Neurosci. 32, 1843-1853. [PubMed]
Satake S., Inoue T.,Imoto K. (2012) Paired-pulse facilitation of multivesicular release and intersynaptic spillover of glutamate at rat cerebellar granule cell-interneurone synapses. J. Physiol. 590, 5653-5675. [PubMed]
Satake S., Imoto K. (2014) Cav2.1 channels control multivesicular release by relying on their distance from exocytotic Ca2+ sensors at rat cerebellar granule cells. J. Neurosci. 34, 1462-1474. [PubMed]
Satake S., Inoue T., Imoto K. (2015) Synaptic multivesicular release in the cerebellar cortex: its mechanism and role in neural encoding and processing. Cerebellum in press. [PubMed]
----------------------------------------
もとに戻る