大脳基底核とはOn the Basal Ganglia
- ポイント Point
- 1. 大脳基底核を構成する核 english
- 2. 大脳基底核の神経回路 english
- 3. 大脳基底核の機能 english
- 4. 大脳基底核疾患の病態 english
- 5. 定位脳手術の治療メカニズム english
- 文献 literature
大脳皮質 − 大脳基底核ループと大脳基底核疾患
English Title * now under construction.
ポイント
- 大脳基底核の神経回路は、ハイパー直接路・直接路・間接路から成り立っている。
- ハイパー直接路・直接路・間接路を介するシグナルは、必要な運動を適切なタイミングで引き起こすとともに、不必要な運動を抑制するのに役立っている。
- 大脳基底核疾患の病態は、ハイパー直接路・直接路・間接路の活動性のバランスが崩れることによって説明することができる。
- 脳深部刺激療法(DBS)をはじめとする定位脳手術の治療メカニズムは、未だ不明なことが多い。
1. 大脳基底核を構成する核
大脳基底核は、以下の4つの神経核から構成されている(図1)。
- 線条体(striatum):尾状核(caudate nucleus)、被殻(putamen)、腹側線条体(ventral striatum)からなる。
- 淡蒼球(globus pallidus):淡蒼球外節(external segment of the globus pallidus, GPe)と淡蒼球内節(internal segment of the globus pallidus, GPi)からなる。
- 視床下核(subthalamic nucleus, STN)
- 黒質(substantia nigra): 黒質網様部(substantia nigra pars reticulata, SNr)と黒質緻密部(substantia nigra pars compacta, SNc)からなる。
図1 大脳基底核を構成する核
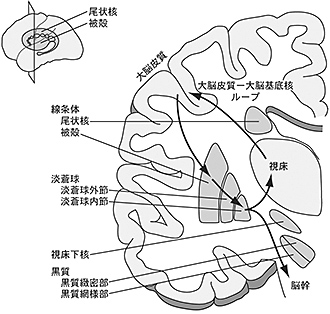
ヒトの大脳基底核を前額断と側面からの透視図(左上)で示す。大脳基底核は、大脳皮質から入力を受け、情報処理の後、視床を介して大脳皮質に戻す(大脳皮質 − 大脳基底核ループ)とともに、脳幹にも投射している。
2. 大脳基底核の神経回路
大脳基底核を構成する核のうち線条体と視床下核が大脳基底核の入力部であり、大脳皮質の広い領域から興奮性入力を受けている。一方、淡蒼球内節と黒質網様部が出力部であり、視床(thalamus)、脳幹に投射している。以下の3経路によって、入力部の情報は、出力部に送られる(図2)1,2)。
- ハイパー直接路(hyperdirect pathway):大脳皮質から入力を受けた視床下核ニューロンが、直接、淡蒼球内節・黒質網様部に投射している経路。大脳皮質からの興奮性入力を、以下に述べる直接路、間接路よりも速く、淡蒼球内節・黒質網様部に伝えている。
- 直接路(direct pathway):線条体の投射ニューロンのうち、GABA(γアミノ酪酸、γ-aminobutyric acid)、P物質(substance P)、ドパミンD1受容体を持っているニューロンが、直接、淡蒼球内節・黒質網様部に投射している経路。
- 間接路(indirect pathway):線条体の投射ニューロンのうち、GABA、エンケファリン(enkephalin)、ドパミンD2受容体を持っているニューロンが、淡蒼球外節に投射し、淡蒼球外節から視床下核を順に経由して、多シナプス性に淡蒼球内節・黒質網様部に至る経路。
図2 大脳基底核の神経回路
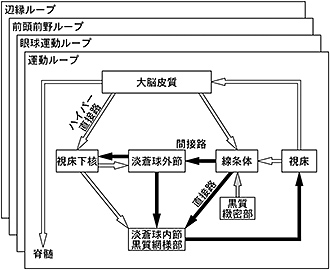
大脳基底核は、ハイパー直接路・直接路・間接路より成り立っている。グルタミン酸作動性の興奮性投射を白い矢印、GABA作動性の抑制性投射を黒い矢印、ドパミン作動性投射を灰色の矢印で示す。(Nambu A, et al. Neurosci Res 2002 2)より)
大脳基底核で処理された情報は、一部は脳幹に下行するものの、大部分は視床を介して前頭葉を中心に大脳皮質に戻る。したがって、大脳皮質とくに前頭葉と大脳基底核は大脳皮質—大脳基底核ループ(cortico-basal ganglia loop)を構成している(図1, 2)1)。このような大脳皮質—大脳基底核ループは、上下肢や体幹の運動をコントロールしている運動ループ(motor loop)以外に、眼球運動ループ(oculomotor loop)、前頭前野ループ(prefrontal loop)、辺縁ループ(limbicloop)など、それぞれ対応する大脳皮質領野と、大脳基底核、視床亜核からなるループが存在している1,3)。このようなループを通して、大脳基底核は上下肢の運動ばかりでなく、眼球運動や高次脳機能、情動などもコントロールしている。
一方、黒質緻密部はドパミン作動性ニューロンより構成されており、主に線条体に投射している(図2)。ドパミンは、線条体の直接路ニューロンに対してはドパミンD1受容体を介して興奮性に、間接路ニューロンに対してはD2受容体を介して抑制性に働く1,4)。
3. 大脳基底核の機能
大脳基底核の出力部である淡蒼球内節・黒質網様部は、GABA作動性の抑制性ニューロンで成り立っており、高頻度(数十Hz)で持続的に発射しているので、投射先である視床や脳幹のニューロンは、常に抑制された状態にある(図3)。大脳皮質からの入力によって、線条体ニューロンが活動すると、線条体—淡蒼球内節・黒質網様部投射は抑制性なので、淡蒼球内節・黒質網様部ニューロンは一時的に抑制される。その結果、出力部からの連続した抑制が一時的に除かれ(脱抑制、disinhibition)、投射先である視床ニューロンや、その先にある大脳皮質が興奮する。その結果、必要な運動が引き起こされる5)。
一方、ハイパー直接路や間接路は、淡蒼球内節・黒質網様部に興奮性の作用をもたらし、視床ニューロンに対する抑制を強めるように働く。各経路を介する伝達速度を考えると、まず、ハイパー直接路を介した情報が視床の活動を抑制し、次に直接路を介した情報が脱抑制し、最後に間接路を介した情報が抑制することになる。したがって、ハイパー直接路と間接路は、直接路によって引き起こされる運動の開始と終止を明確にしている(図3)2,6)。
ハイパー直接路・直接路・間接路は、このように時間的に働くばかりでなく、空間的にも働いている。直接路は視床の限られた領域を脱抑制するのに対し、ハイパー直接路や間接路のように視床下核を経由する経路は、淡蒼球内節・黒質網様部の広い領域を興奮させ、したがって視床の広い領域を抑制することになる。すなわち、ハイパー直接路や間接路を介するシグナルは、引き起こされる運動とは関わらない視床の周辺領域を抑制し、不必要な運動を抑制している(図3)2,6,7)。
このように、ハイパー直接路・直接路・間接路を介するシグナルは、時間的、空間的に視床・大脳皮質の活動に影響を与え、必要な運動を適切なタイミングで引き起こし、逆に不必要な運動を抑制するのに役立っている、すなわち運動の選択を行っている。このような機能は、運動ループだけでなく、眼球運動、前頭前野、辺縁ループにも存在し、同様なメカニズムで、それぞれの機能を制御している。
図3 大脳基底核の機能

随意運動の際の、線条体、視床下核、淡蒼球内節・黒質網様部、視床の活動性の時間的変化を図の両側に、空間的分布を図の中央に示す。直接路は、淡蒼球内節・黒質網様部のうち、必要な運動に関連している領域(中央部分)を抑制し、その結果、視床を脱抑制することによって必要な運動のみを引き起こす。ハイパー直接路・間接路は、淡蒼球内節・黒質網様部に、時間的・空間的に広い興奮をもたらす。その結果、視床の中央部においては、運動の開始と終了を明確化するとともに、視床の周辺部においては抑制を強め、不必要な運動を抑制している。興奮性ニューロンを白で、抑制性ニューロンを黒で示す。(Nambu A. ProgBrain Res 20026)より)
4. 大脳基底核疾患の病態
大脳基底核疾患は、運動の多寡によって、パーキンソン病(Parkinson's disease)のように無動・寡動を来す運動減少症(hypokinetic disorder)と、ヘミバリスム(hemiballism)、ハンチントン病(Huntington's disease)、ジストニア(ジストニー、dystonia)などのように不随意運動を伴う運動過多症(hyperkinetic disorder)とに大別される。さらに、筋緊張が亢進あるいは低下しているのかを考えて、大脳基底核疾患を運動と筋緊張の平面上にプロットすると、統一的に分類できる(図4)。大脳基底核疾患の病態は、ハイパー直接路・直接路・間接路の活動性のバランスが崩れ大脳基底核の出力部の発射頻度が変化することにより、説明することができる(図5)4)。
図4 大脳基底核疾患の分類
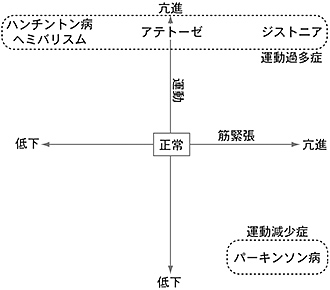
縦軸は運動の多寡を、横軸は筋緊張の増減を表す平面上に、大脳基底核疾患をプロットして分類した。
パーキンソン病の場合、黒質緻密部のドパミン作動性ニューロンが変性・脱落し、ドパミンによる線条体の直接路ニューロンへの興奮性入力と、間接路ニューロンへの抑制性入力がなくなる4)。その結果、運動遂行時に大脳皮質から線条体に入力が入っても、直接路ニューロンが十分、興奮しなくなる。一方、間接路ニューロンが大きく興奮するようになる。このような変化によって、淡蒼球内節の抑制が減少し、また周辺の興奮が増大し、その結果、視床を十分、脱抑制できなくなり、運動減少となる(図5A)8)。
ヘミバリスムは視床下核の出血や梗塞で起こり、ハイパー直接路・間接路を介するシグナルが減少している。ハンチントン病では線条体の間接路ニューロンが脱落し、間接路を介するシグナルが減少している。これらの経路は、運動を明確に終止したり不必要な運動を抑制する機能を持っているので、運動過多になる(図5B)4)。ジストニアの場合は、直接路・間接路を介するシグナルが増強している。運動遂行時に線条体から淡蒼球内節への抑制性入力が増大し、淡蒼球内節が強く抑制される。その結果、視床・大脳皮質が大きく脱抑制され、運動過多になる(図5C)9)。また、増大した抑制性入力は広く淡蒼球内節を抑制し、主働筋と拮抗筋の共収縮や運動に必要のない遠隔筋の収縮(オーバーフロー現象)を引き起こす。ジスキネジア(dyskinesia)の場合は、線条体でドパミンが過剰に働き、直接路と間接路のバランスがパーキンソン病とは逆の状態になり、運動過多になる。
大脳基底核疾患では身体症状が強調されるが、このような変化は運動ループ以外の他ループにも起こっており、上下肢の運動ばかりでなく、眼球運動、高次機能、情動なども障害される。例えばパーキンソン病では認知機能障害、うつが、ドパミン補充療法、脳深部刺激療法(deep brain stimulation, DBS)の副作用として脱抑制性の行動異常(病的賭博、性行動亢進、反復常同行動、L-ドパ依存など)が出現する。
図5 大脳基底核疾患の病態
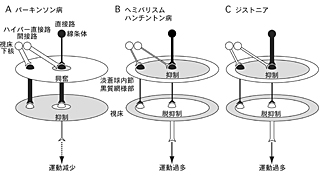
大脳基底核のダイナミックな活動変化で説明。活動性の亢進、低下を、投射の太さで示す。
- パーキンソン病の場合は、直接路の活動性低下、ハイパー直接路・間接路の活動性亢進により、淡蒼球内節・黒質網様部の抑制が減少し、その結果、視床の脱抑制が減少し、運動を起こせなくなり運動減少(無動)を生じる。
- ヘミバリスム、ハンチントン病の場合は、視床下核から淡蒼球内節・黒質網様部への興奮性入力が減少し、その結果、運動を明確に終止したり不必要な運動を抑制できなくなり、運動過多(不随意運動)を生じる。
- ジストニアの場合は、直接路の活動性亢進により、淡蒼球内節・黒質網様部の抑制が亢進し、その結果、視床の脱抑制が亢進し、運動過多(不随意運動)を生じる。
5. 定位脳手術の治療メカニズム
パーキンソン病に対して淡蒼球内節や視床下核をターゲットとしたDBSが広く行われるようになってきた。パーキンソン病モデルサルの視床下核を破壊すると、症状が改善することがわかり、定位脳手術が再評価されるきっかけのひとつとなった。パーキンソン病では運動時の視床下核・淡蒼球内節の活動性が増強しているため、視床下核・淡蒼球内節を破壊(凝固術)することにより、症状が改善されると考えられる。
しかし、DBSの作用メカニズムは良くわかっていない10, 11)。DBSには、持続時間の短い(数十µs)高頻度(100Hz以上)刺激が用いられるが、このような高頻度連続刺激が、局所のニューロン活動を抑制することによって症状を改善させるという説と、興奮させることによって症状を改善させるという説がある。パーキンソン病では運動時の視床下核・淡蒼球内節の活動性が亢進しているが、高頻度連続刺激を加えることにより、このような亢進した活動が次の核に伝達されるのを遮断すると解釈した方が良いかもしれない12)。
一方、全身性ジストニアとくにDYT1ジストニアに対して、淡蒼球内節をターゲットとしたDBSが著効を示すことがわかり、治療の第一選択となりつつある。ジストニアの場合、淡蒼球内節の活動性が低下しているので、高頻度連続刺激が活動性を上げていると単純に考えてよいか不明である。ジストニアの症状が改善するには、数週から数ヶ月かかることから、何らかの可塑的な変化を伴っているのかもしれない。
now under construction.
文献 literature
- Alexander GE, CrutcherMD. Functional architecture of basal ganglia circuits: neural substrates ofparallel processing. Trends Neurosci 1990; 13: 266-271.
- Nambu A, et al.Functional significance of the cortico-subthalamo-pallidal 'hyperdirect'pathway. Neurosci Res 2002; 43: 111-117.
- Alexander GE, etal. Parallelorganization of functionally segregated circuits linking basal ganglia andcortex. Annu Rev Neurosci 1986, 9: 357-381.
- DeLong MR. Primatemodels of movement disorders of basal ganglia origin. Trends Neurosci1990; 13: 281-285.
- Hikosaka O, et al. Roleof the basal ganglia in the control of purposive saccadic eye movements. PhysiolRev 2000; 80: 953-978.
- Nambu A, Globus pallidus internalsegment. GABA and the Basal Ganglia: From Molecules to Systems. ProgBrain Res 2007; 160: 135-150. Elsevier, Amsterdam.
- Mink JW. The basalganglia: focused selection and inhibition of competing motor programs. ProgNeurobiol 1996; 50: 381-425.
- Nambu A. A new approach to understand the pathophysiologyof Parkinson's disease. J Neurol 2005; 252[Suppl4]: 1-4.
- Nambu A,et al. Reduced pallidal output causes dystonia. Front Syst Neurosci 2011; 5: 89.
- Lozano AM, et al. Deep brain stimulation for Parkinson's disease:disrupting the disruption. Lancet Neurol 2002; 1: 225-231.
- Nambu A. Seven problems on thebasal ganglia. Curr Opin Neurobiol 2008; 18: 595-604.
- Chiken S, Nambu A.High-frequency pallidal stimulation disrupts information flow through the pallidumby GABAergic inhibition. J Neurosci 2013; 33:2268-2280.
