ホルモンや神経伝達物質をはじめとする種々のシグナル分子は、細胞表面の受容体に結合し、細胞内のセカンドメッセンジャーを活性化することによって、細胞に様々な反応を引き起こします。中でも細胞内のカルシウムイオン(Ca2+)増加とそれに引き続くプロテインキナーゼ(タンパク質リン酸化酵素)の活性化は、脳内でいくつもの重要な機能を担っています。
そのうち特に重要な経路のひとつが、Ca2+/カルモジュリン依存性プロテインキナーゼII(CaMKII)の活性化です。CaMKIIは神経細胞に豊富に存在し、神経伝達物質合成酵素やシナプス小胞結合蛋白、イオンチャネル、神経伝達物質受容体などをリン酸化することによって、それらタンパク機能を調節し、シナプス伝達の可塑性、さらには、学習・記憶をはじめとする高次脳機能に重要な役割を果たすと考えられています。
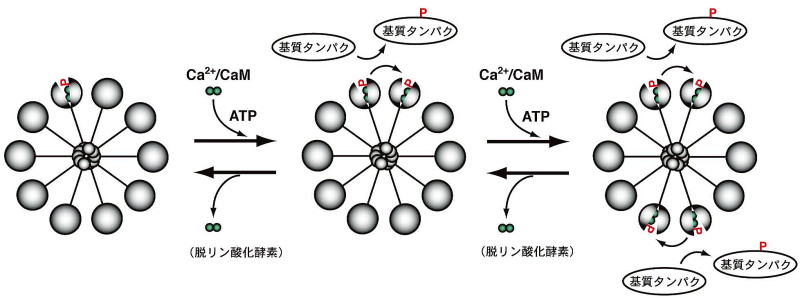
図1に示すように、CaMKIIは、複数の相同なサブユニットから構成された多量体として存在します。細胞内Ca2+の上昇によって活性化したカルモジュリン(Ca2+/カルモジュリン)が結合すると、その立体構造に変化が生じて、活性部位が露出し、ATP存在下で隣接するサブユニットのリン酸化(自己リン酸化)と基質タンパクのリン酸化を起こします。自己リン酸化を起こしたCaMKIIはCa2+/カルモジュリンをトラップし、活性化状態が一定期間持続することが知られています。しかしながら、実際の生体内におけるCaMKIIの活性制御については、不明な点が多く、動物個体レベルでの研究もごくわずかでした。

図1:CaMKIIの活性制御機構
通常の神経活動状態では、細胞内のCa2+/カルモジュリン(Ca2+/CaM)濃度、CaMKII自身の活性、脱リン酸化酵素であるフォスファターゼ(phosphatases)活性のバランスによって、CaMKIIの活性状態は平衡状態に保たれています。自己リン酸化の増大は、CaMKIIの活性化を反映します。
(Large figure)
私たちは、次の2つの方法によって生体内におけるCaMKIIの役割を明らかにしようとしています。
これまでCaMKIIの生体内における機能を調べるため、CaMKIIの前脳における主要なサブユニットであるCaMKIIαをノックアウトしたマウス、すなわちCaMKIIαそのものを持たないマウスが作成され、解析されてきました。しかし、図2に示すように、CaMKIIには、
(1) プロテインキナーゼとしての役割以外に、
(2) Ca2+/カルモジュリン結合タンパク、
(3) 多量体構造をとる構造タンパクとしての機能
など様々な機能があり、(1)〜(3)のすべてが失われたノックアウトマウスの解析では、これら複数のタンパク機能のうちどれが生体内においてどのような機能を果たしているのか、明らかにできません。
そこで、これらの機能が、CaMKII分子の、それぞれ別の領域(ドメイン)によって担われていることに着目し、特定の領域のみを特異的に阻害する機能的ノックアウトの作製・解析がより重要であると考えました。そして、上記3つのタンパク機能のうち、ATPの結合に必要な42番目のリシン残基(Lys)をアルギニン残基(Arg)に置き換えることにより、(1)のキナーゼ活性のみを障害したK42Rノックインマウスの作成に取り組みました(図2,左上)。
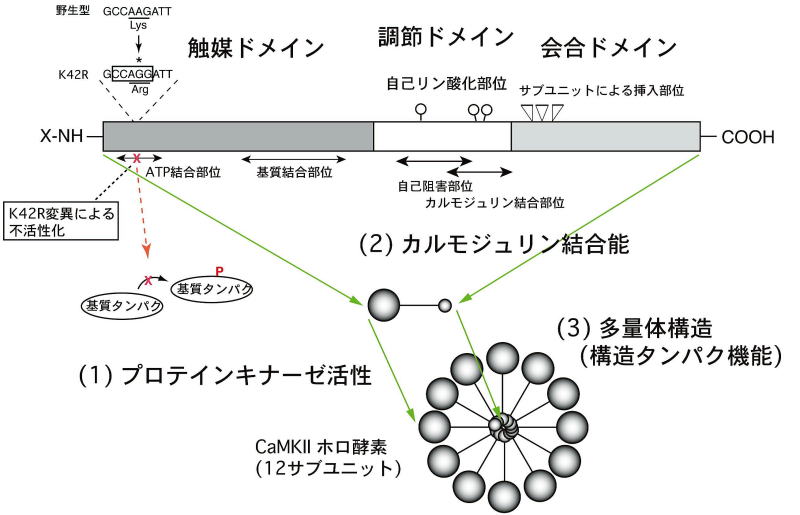
図2:CaMKIIの分子構造と点変異導入による酵素機能の不活性化
CaMKIIの各サブユニット分子(α, β, γ, δ)は共通の領域(ドメイン、domain)構造を示し、異なるドメインが異なるタンパク機能を担っています。今回、CaMKIIαのキナーゼ活性ドメインにあるアミノ酸のうち、ATPの結合に必要な42番目のリシン残基(Lys-42)をアルギニン残基(Arg-42)に置き換えることにより、キナーゼ活性を失ったK42Rノックインマウスを作成しました。この変異マウスのCaMKIIα分子では、Ca2+/カルモジュリン結合タンパクとしての機能、多量体を構成する構造タンパクとしての機能は保たれています。
(Large figure)
その結果、タンパクとしてのCaMKIIはきちんと発現しているけれど、キナーゼ活性のみが消失しているという不活性型CaMKIIα(K42R)ノックインマウスの作成に成功しました(文献1)。このマウスを用いて海馬シナプスの解析を行ったところ、シナプス後神経細胞において、神経活動に依存してCaMKIIαタンパクがシナプス後部へ移行する性質は保たれていましたが、強い刺激が加わった際に起こる樹状突起スパインの増大とシナプス伝達の長期増強は著しく障害されていました(図3)。また、このマウスを用いて海馬依存性の学習・記憶テストを行ったところ、著しい学習障害が認められました(図4)。これらの結果から、CaMKIIαのキナーゼ活性が、海馬のシナプス可塑性と学習・記憶の形成に不可欠であることが判明しました(図5)。
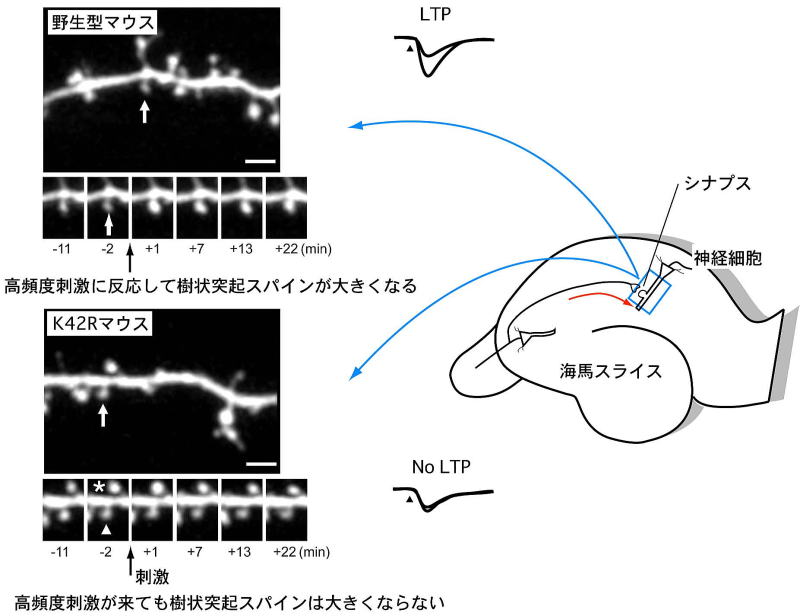
図3 :CaMKIIα(K42R)ノックインマウスにおける海馬シナプス可塑性の障害
海馬神経細胞に、シナプス可塑性を引き起こす高頻度反復刺激(テタヌス刺激)を与えたところ、CaMKIIα(K42R)ノックインマウスでは、シナプス後神経細胞の樹状突起の増大も、シナプスの長期増強(LTP)も起こりませんでした。
(Large figure)
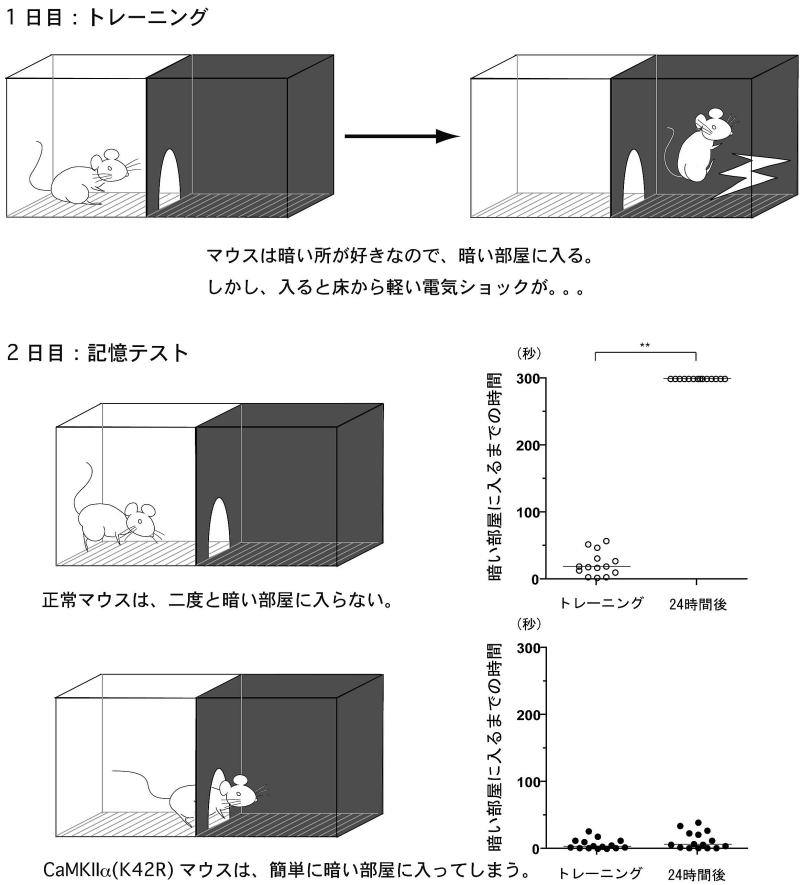
図4 :CaMKIIα(K42R)ノックインマウスにおける学習・記憶の障害
海馬依存性の学習・記憶テスト(受動的回避テスト)を行ったところ、CaMKIIα(K42R)ノックインマウスは、暗い部屋で電気ショックを受けたことを全く覚えていませんでした。
(Large figure)
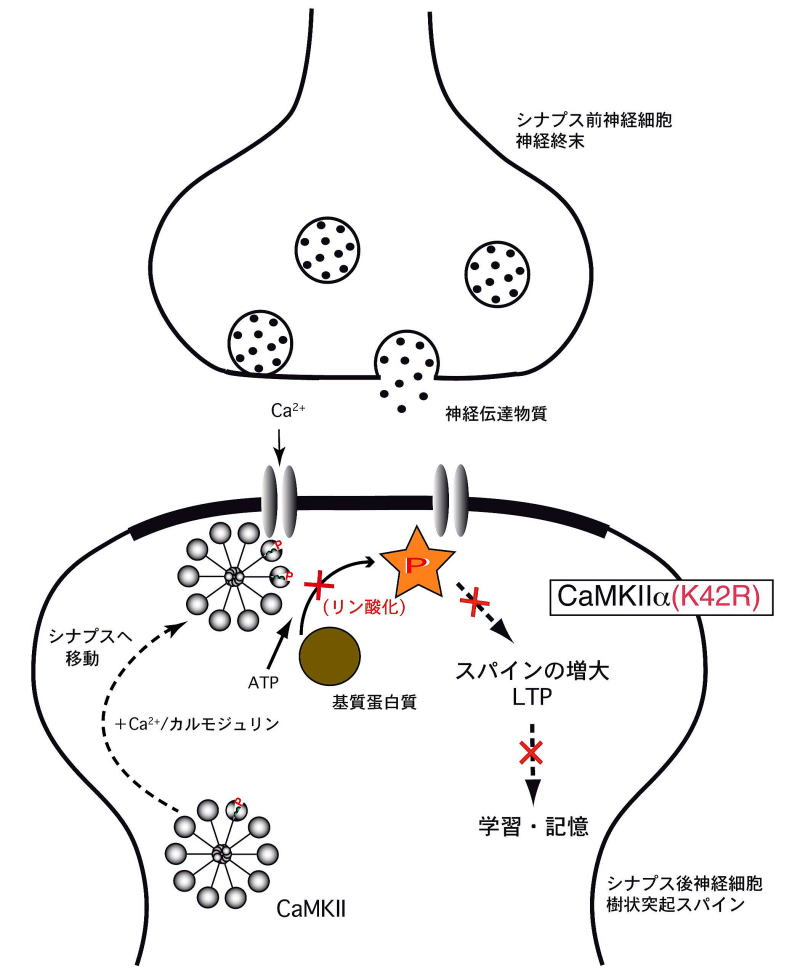
図5 : CaMKIIαのキナーゼ活性は、シナプス可塑性、学習・記憶に不可欠
CaMKIIα(K42R)ノックインマウスでは、シナプスの活性化に伴って、CaMKIIαタンパク分子のシナプス部への移行は起こりますが、そこで基質タンパクをリン酸化することができないために、シナプス可塑性が起こらず、学習・記憶も成立しないと考えられます。
(Large figure)
今後は、さらに行動レベルでの詳しい解析を行うと共に、CaMKIIαのキナーゼ活性異常が、どのような機序でこのような障害を引き起こすのかなどのメカニズムについても明らかにしていこうと考えています。
〔プレスリリース〕
http://www.nips.ac.jp/contents/release/entry/2009/06/post-7.html
〔英文プレスリリース〕
http://www.nips.ac.jp/eng/contents/release/entry/2009/06/post-7.html
〔せいりけんニュース2009.9号、2009.11号、ブレイン・ミステリー〕
http://www.nips.ac.jp/nipsquare/sknews/series/entry/2009/09/9-.html
http://www.nips.ac.jp/nipsquare/sknews/series/entry/2009/11/post-2.html
生体における神経活動活性化のモデルとしてラットを用いたけいれん活動を取り上げ、CaMKIIの活性状態を検討しています。
通常の神経細胞の興奮では、細胞外からのCa2+の流入によってCaMKIIの自己リン酸化が増大すると同時に、キナーゼ活性も上昇します(図1)。しかしながら、神経細胞の過剰興奮状態であるけいれん時には、こういった活性制御機構とは異なる状態が生じていることを見いだしました(文献2,3)。
図6に示すように、けいれんなどの過剰な神経活動の際には、神経細胞内に大量のCa2+が流入し、多数のカルモジュリンがCa2+を結合することにより活性化し、そのCa2+/カルモジュリンが一斉にCaMKIIに結合します。それに伴い、一部の自己リン酸化が起こりますが、相対的にATPが不足するため、基質タンパクのリン酸化はかえって進みません。また、けいれん時には細胞内の酸塩基平衡が通常よりも酸性側に傾くために、Ca2+/カルモジュリンが結合した不安定な形のCaMKIIがCaMKII同士の結合によって巨大な集合体を形成する、あるいは元々結合しやすいシナプス後肥厚部に存在する受容体などの膜タンパクに結合するものと考えられます(図6,右上)。
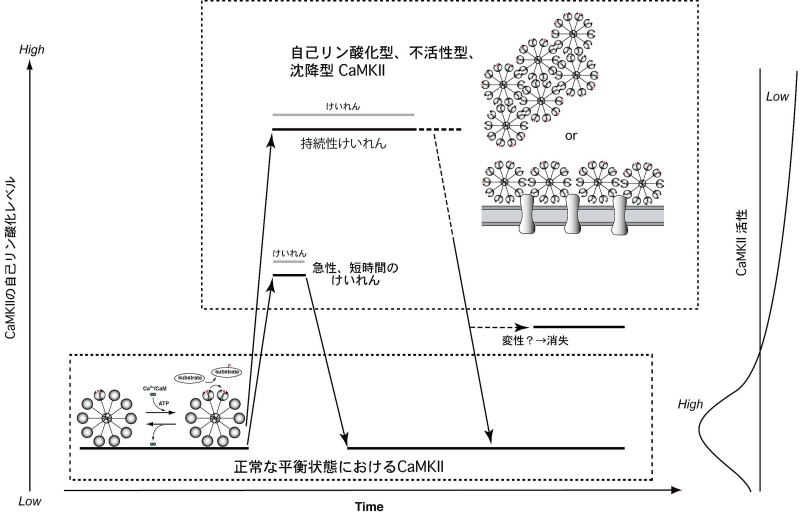
図6:生体内における神経過剰興奮時のCaMKIIの活性制御機構
神経細胞の過剰な興奮状態であるけいれん時には、急激に大量のCa2+が細胞内に流入し、大量の活性化カルモジュリン(Ca2+/カルモジュリン)がCaMKIIに結合することによって、通常と異なる活性制御機構が働くと考えられます。このような場合には、CaMKIIの自己リン酸化の程度とキナーゼ活性が乖離し、かえってタンパクのリン酸化は進みません。このような活性制御機構は、過剰なCa2+/カルモジュリンをトラップすると同時に、CaMKIIによる基質タンパクの過剰なリン酸化を阻止することによって、神経細胞を正常な状態に保つ上で重要な役割を果たしていると考えられます。(文献2より改変・転載)
(Large figure)
このような形状を取るCaMKIIは最早、通常のキナーゼ活性を発揮することができなくなり、さらに、フォスファターゼ(脱リン酸化酵素)の活性が増大することによって、基質タンパクのリン酸化が減少します。一方、けいれんの初期に起こった自己リン酸化は、このような形状変化によって、フォスファターゼの作用を受けにくくなります。図6に示すように、けいれんの程度が強ければ強いほど、また長ければ長いほど、自己リン酸化の程度とキナーゼ活性が乖離するという現象が生じるものと考えています。
けいれんが終息すると、このような形状のCaMKIIは検出できなくなり、通常の活性状態に戻ることから、過剰な神経活動の興奮が起こった場合には、CaMKIIがむしろ単なるCa2+/カルモジュリン結合タンパクとして作用し、かつCaMKIIを起点とする細胞内のシグナル伝達経路を遮断するような活性制御機構が、生体内で働いていると思われます。
今後は、こういったCaMKII集合体の形成メカニズムやその機能について、上記の不活性型ノックインマウスなども用いて、さらに調べたいと考えています。
参考文献
1.Yamagata Y, et al, J Neurosci, 29: 7607-7618, 2009
2.Yamagata Y, et al, Neuroscience, 140: 981-992, 2006
3.Yamagata Y and Obata K, J Neurochem, 91: 745-754, 2004
updated 28-Oct-2011
もとに戻る