電子顕微鏡を用いて生体分子、生体構分子複合体および細胞内の構造を解析し、その構造と機能の関係を研究しています。また、電子顕微鏡法および画像解析技術の研究も行っています。

アルツハイマー病の原因物質であるアミロイドβ(Aβ)の家族性変異「Tottori型(D7N変異)」について、国際宇宙ステーションの微小重力環境を活用した実験により、世界で初めてその線維構造の解明に成功しました。
Yagi-Utsumi M, Yanaka S, Burton-Smith RN, Song C, Ganser C, Yamazaki C, Kasahara H, Shimazu T, Uchihashi T, Murata K, Kato K (2025) Microgravity-Assisted Exploration of the Conformational Space of Amyloid β Affected by Tottori-Type Familial Mutation D7N. ACS Chem Neurosci 16(14) 2682-2690. WEB

渦鞭毛虫オキシリス・マリナの核の構造をボリュームEM法を用いて詳細に解析し、本種に特有の染色体(dinokaryon)が400本近くあることを初めて明らかにしました。
Fukuda Y, Suzaki T, Murata K, Chihong S (2025) Novel ultrastructural features of the nucleus of the ancestral dinoflagellate Oxyrrhis marina as revealed by freeze substitution fixation. Front Protistol 3 1512258. WEB

ISSの微重力環境と同様な方法で地上で形成させた野生型Aβ(1-40)繊維はクライオ電顕による構造解析の結果、新規なJ型の構造を示しました。
Burton-Smith RN, Yagi-Utsumi M, Yanaka S, Song C, Murata K, Kato K (2025) Elucidating the Unique J-Shaped Protomer Structure of Amyloid-β(1-40) Fibril with Cryo-Electron Microscopy. Int J Mol Sci 26(3) 1179. WEB

メドゥーサウイルスのキャプシド構造をクライオ電子顕微鏡を用いて7Å分解能で解析し、粒子形成過程に伴うカプシドの構造変化を明らかにしました。
Watanabe R, Song C, Takemura T, Murata K* (2024) Subnanometer structure of medusavirus capsid during maturation using cryo-electron microscopy. J Virol 98(9), e0043624. WEB
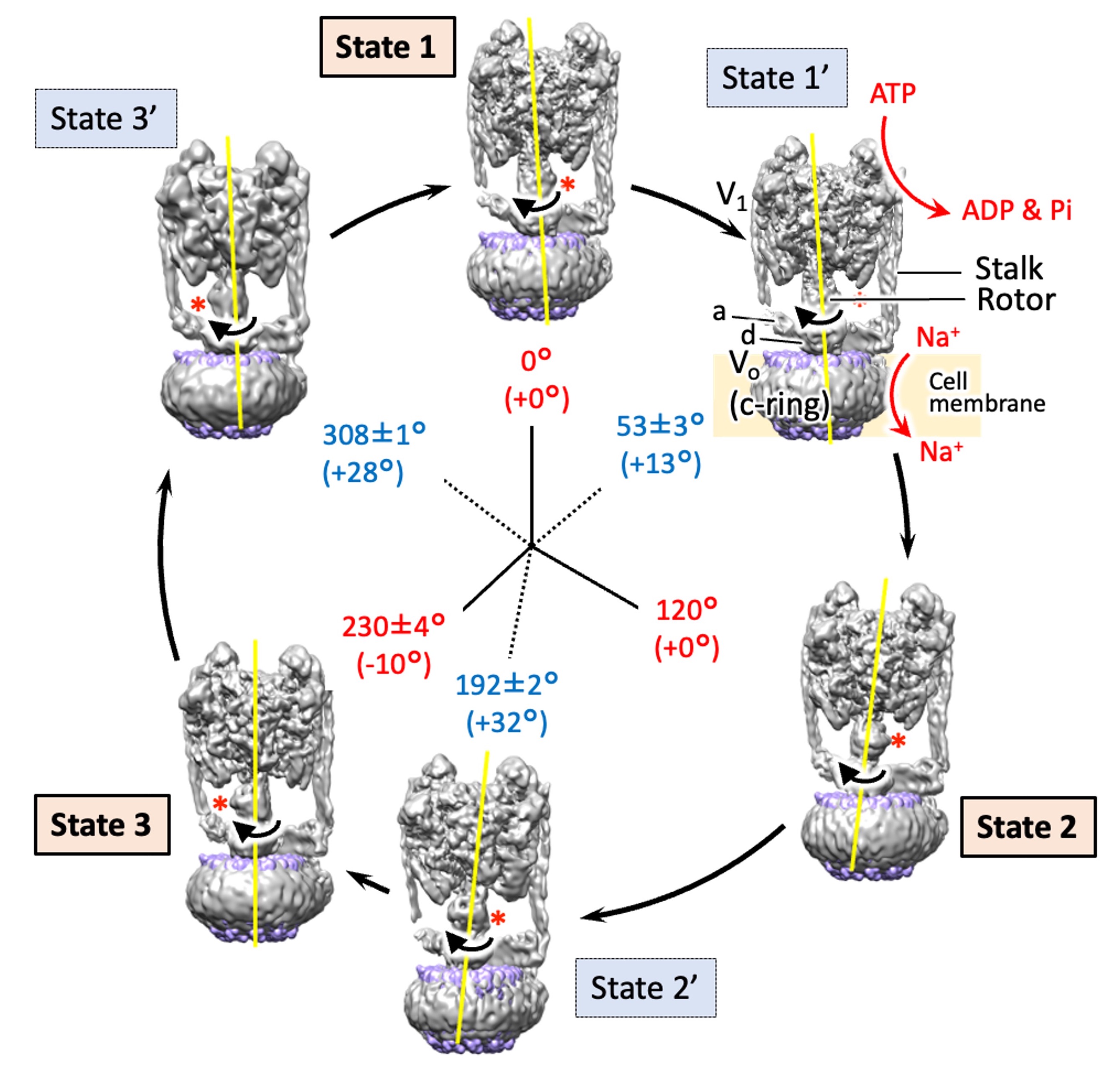
腸球菌が持つ回転式ナトリウムイオンポンプの6つの中間構造すべてを立体構築することに成功し、ATPを加水分解してナトリウムを輸送する分岐機構を明らかにしました。
Raymond N. Burton Smith, Chihong Song, Hiroshi Ueno, Takeshi Murata, Ryota Iino, Kazuyoshi Murata* (2023) Six states of Enterococcus hirae V-type ATPase reveals non-uniform rotor rotation during turnover. Comm Bio 6 755. WEB
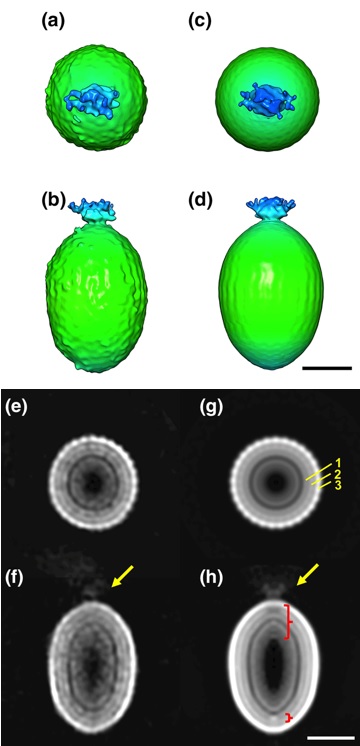
タナイウイルスの詳細な粒子構造をクライオ電子顕微鏡を用いて解析し、感染に伴うカプシドのダイナミックな構造変化を明らかにしました。
Kenta Okamoto*, Chihong Song, Han Wang, Miako Sakaguchi, Christina Chalkiadaki, Naoyuki MIyazaki, Takeshi Nabeshima, Kouichi Morita*, Shingo Inoue, and Kazuyoshi Murata (2023) Structure and its transformation of elliptical nege-like virus Tanay virus. J Gen Vir 104(6),001863. WEB
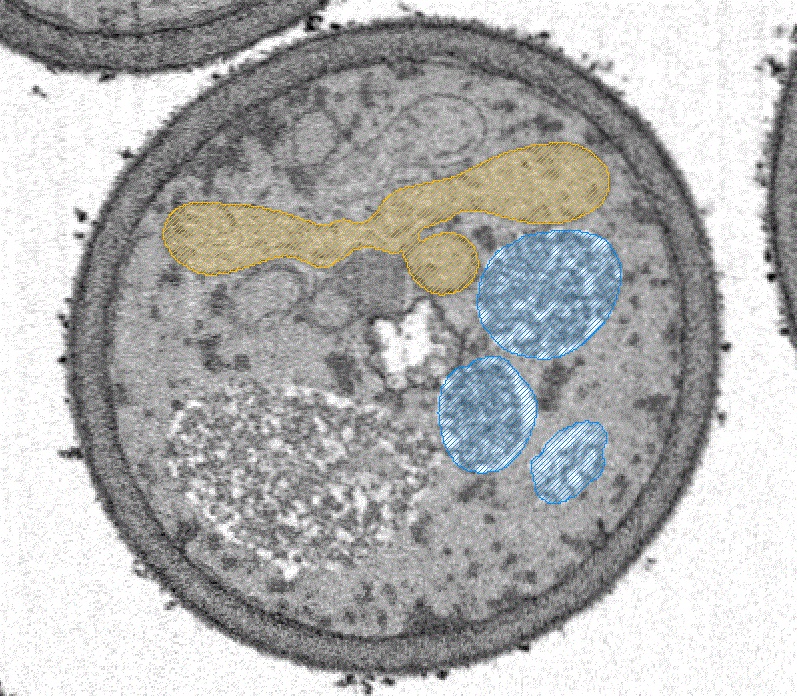
新規ミトコンドリア分裂因子を発見し、分裂の様子を3D-SEMを用いて確認しました。
Tomoyuki Fukuda#, Kentaro Furukawa#, Tatsuro Maruyama#, Shun-Ichi Yamashita, Daisuke Noshiro, Chihong Song, Yuta Ogasawara, Kentaro Okuyama, Jahangir Md. Alam, Manabu Hayatsu, Tetsu Saigusa, Keiichi Inoue, Kazuho Ikeda, Akira Takai, Lin Chen, Vikramjit Lahiri, Yasushi Okada, Shinsuke Shibata, Kazuyoshi Murata, Daniel J. Klionsky, Nobuo N. Noda*, Tomotake Kanki* (2023) The mitochondrial intermembrane space protein mitofissin drives mitochondrial fission required for mitophagy. Mol Cell 83(12),2045-2058. WEB
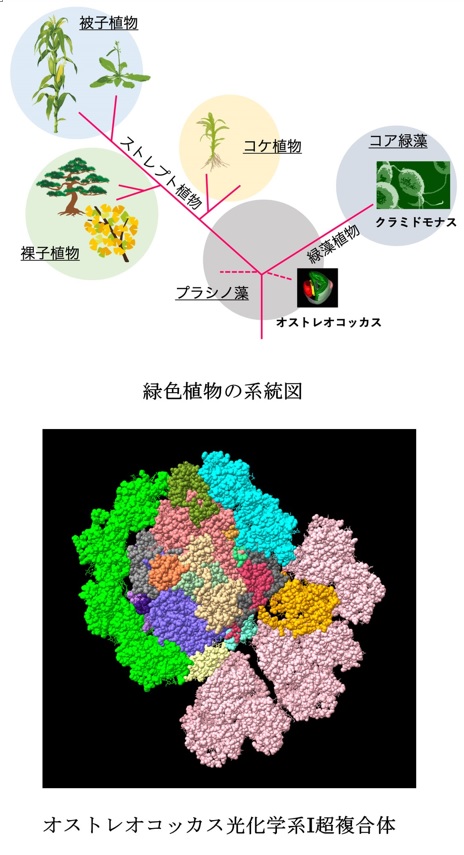
先祖型PSIのユニークな構造をクライオ電子顕微鏡で明らかにしました。
Asako Ishii, Jianyu Shan, Xin Sheng, Eunchul Kim, Akimasa Watanabe, Makio Yokono, Chiyo Noda, Chihong Song, Kazuyoshi Murata, Zhenfeng Liu, Jun Minagawa (2023) The photosystem I supercomplex from a primordial green alga Ostreococcus tauri harbors three light-harvesting complex trimers. eLife 84488. WEB
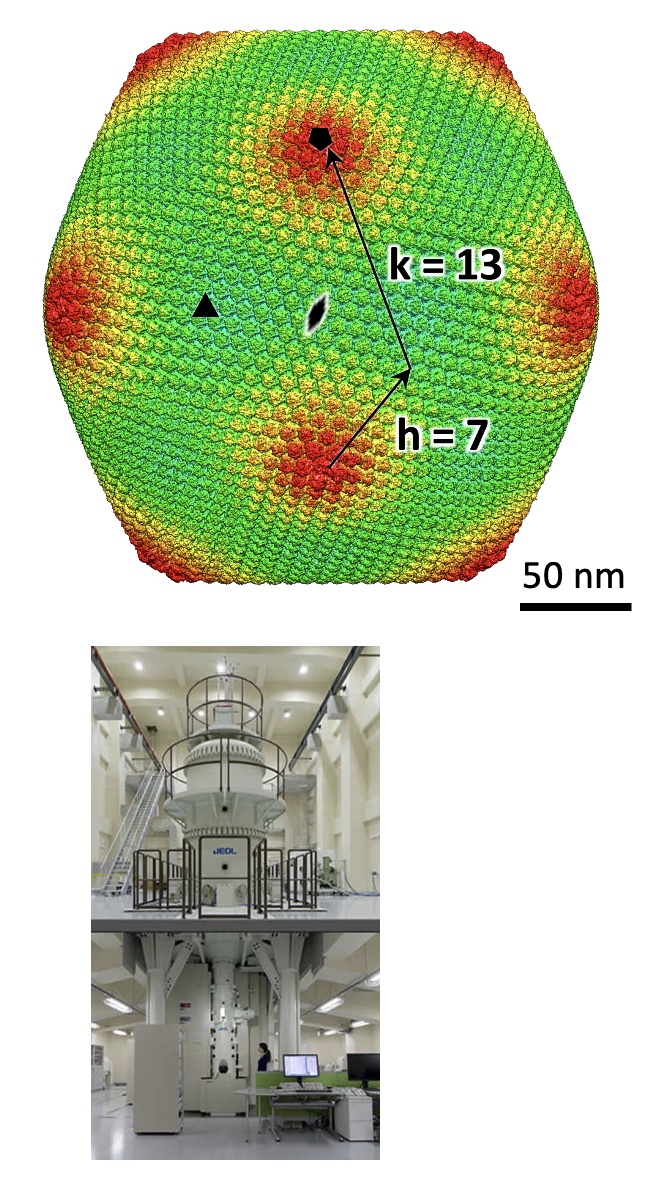
巨大ウイルスの一つトーキョーウイルスの構造をクライオ超高圧電顕による単粒子解析を用いて7.7Å分解能で明らかにしました。
Chihara A, Burton-Smith RN, Kajimura N, Mitsuoka K, Okamoto K, Song C, Murata K (2022) A novel capsid protein network allows the characteristic inner membrane structure of Marseilleviridae giant viruses. Sci Rep 12(1):21428. WEB
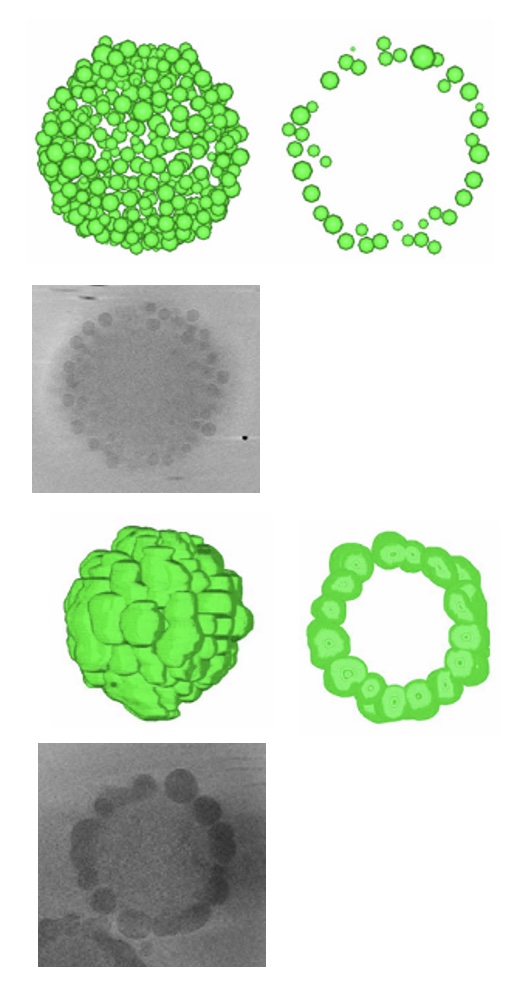
異なる組成で作成されたナノコンポジットマイクロゲルの水和構造をクライオ電顕トモグラフィーにより明らかにしました。
Nishizawa Y, Watanabe T, Noguchi T, Takizawa M, Song C, Murata K, Minato H, Suzuki D (2022) Durable gelfoams stabilized by compressible nanocomposite microgels. Chem Commun (Camb) 58, 12927-12930. WEB
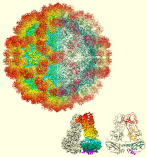
集団性下痢症の原因ウイルスの一つサポウイルスの殻(カプシド)の構造を世界で初めて原子レベルで明らかにしました。
Miyazaki N, Song C, Oka T, Miki M, Murakami K, Iwasaki K, Katayama K, Murata K* (2022) Atomic structure of human sapovirus capsid by single particle cryo-electron microscopy revealed a unique capsid protein conformation in caliciviruses. J Virol 96(9), e0029822. WEB
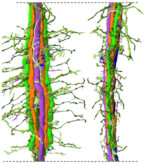
アゲハの複眼から入った光の情報が最初に処理される脳領域の配線(コネクトミクス)をSBF-SEMを用いて明らかにしました。
Matsushita A, Stewart F, Ilić M, Chen PJ, Wakita D, Miyazaki N, Murata K, Kinoshita M, Belusic G, Arikawa K (2022) Connectome of the lamina reveals the circuit for early color processing in the visual pathway of a butterfly. Cur biology S0960-9822(22), 00506-1. WEB
国内で採取された巨大ウイルスであるメドゥーサウイルスが、一見非効率的なウイルス形成過程を示すことを電子顕微鏡による解析から明らかにしました。
Watanabe R, Song C, Kayama Y, Takemura M, Murata K* (2022) Particle morphology of Medusavirus inside and outside cells reveals new maturation process of giant virus. J Viol 96(7), e0185321. WEB

クライオ電子顕微鏡(TITAN Krios G4, TFS社)は300kV C-FEG、ポストカラム エネルギーフィルター(Selectris X)を備えた現在世界最高水準の装置です。単粒子解析に加え、電子線トモグラフィー、MicroEDが行えます。
電子銃: 300kV C-FEG
エネルギーフィルター: Selectris X
電子直接検出カメラ:Falcon4
画像収集ソフト:EPU

クライオ電子顕微鏡(JEM2200FS、JEOL社)は200kV Schotkky、インカラムΩ型エネルギーフィルターを備えた、グリッドスクリーニング用クライオ電子顕微鏡です。
加速電圧: 200kV熱陰極型電子銃(Schotkky)
試料ホルダー:Gatan 622 Cryo-specimen holder
エネルギーフィルター: インカラムΩ型
電子直接検出カメラ: DE-20

電子線トモグラフィー試料作製装置(Aquilos2、TFS社)は、Cryo-FIB-SEMで、集束イオンビームで凍結試料を厚さ数百nmに加工します。連続表面走査型電子顕微鏡として試料の立体再構築を行うこともできます。さらに付属の蛍光顕微鏡ユニット(iFLM)により目的の場所をピンポイントで見つけることができます。
SEM部:Thermal Schottky FEG
集束イオンビーム部:Ga液体金属イオンソース
蛍光顕微鏡部:iFLM
当研究室では、意欲ある大学院生を募集しています。生理研には総合研究大学院大学(総研大)の生命科学研究科が併設されています。また既に大学院に所属する学生を受け⼊れる特別共同利用研究員の制度もあります。詳しくは村田まで。
Copyright (C) 2021 NINS Murata Lab. All Right Reserved