研究内容
神経細胞の移動・軸索ガイダンス
神経細胞やグリア細胞は、背腹軸や前後軸の中の位置情報にしたがって分化すると考えられています。成体の脳で見られる多様な細胞の入り交じった機能的な組織を形成するためには、神経発生の初期に神経幹細胞から分化した細胞が一定の規則にしたがって移動しなければなりません。さらに、神経細胞は長い突起を伸ばして回路網を形成し、グリア細胞は短い突起で神経細胞を取り巻くことができ、始めて機能的な組織構築が形成されます。非常にまれな先天異常ではありますが、この細胞移動に障害が生じて脳回(脳のしわ)ができなくなったり多くなったりし、精神遅滞を引き起こす病気が知られています。どのようにして細胞が最終目的地を見つけて到達できるか、またどのようにして遠隔地にあるパートナー細胞を見出してそこへ向かって突起を伸ばすのかを研究することは、脳の構築原理を知る上で最も重要なテーマです。
最近では、当部門のTakebayashiによって作製されたOlig3-lacZノックインマウスを用いて、脊髄の背側部や菱脳唇に由来する細胞の移動を可視化することに成功しました(図2;Ding et al., Dev Dyn,2005)。このマウスと軸索誘導分子やその受容体(see below)を欠損するマウスをもちいて、細胞移動の制御機構を解析しているところです。
また、軸索誘導分子のノックアウトマウスを用いた解析では、脊髄神経節(DRG)ニューロンの回路網形成不全を見出して、そのメカニズムを明らかにました(図3-5)。軸索誘導分子Netrin 1は腹側正中部での発現・機能が注目されていますが、脊髄背側部でも一過性に発現し、これがDRG線維を抑制的にガイドすることで正常な回路網、ひいては正常の機能構築の形成に重要であることを報告しています。以下のように、Netrin 1ノックアウトマウス、その受容体であるDCCやUnd5cのミュータントマウスの形態解析や、培養系を用いて、この背側部で発現するNetrin 1の機能とDRG線維の脊髄内での誘導機構を始めて明らかにしました(Watanabe et al., Development, 2006)。
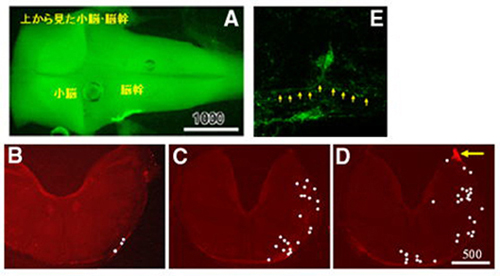
図1
菱脳唇に由来する細胞の移動。脳幹の菱脳唇に限局してEGFPを導入すると(A、Dの矢印)、ここに由来する細胞が脳幹表面を移動して反対側の脳幹 まで至るものがみられます(B-D)。その後、細胞は極性を正接方向から放射状方向に変換し、脳幹内部に入っていきます(E)。
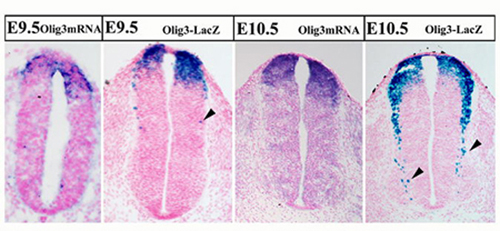
図2
マウス胎仔脊髄背側部にみられるOlig3-mRNA(in situ hybridization法)の分布と、Olig3-LacZ(X-gal染色)の発現。矢印の細胞は、Olig3-mRNAの発現がなくなった後も LacZの発現が見られる細胞。Olig3系譜細胞の移動が示されている。
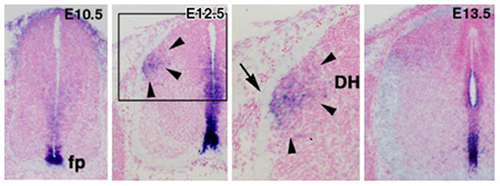
図3
マウス胎仔脊髄におけるNetrin 1の発現。Netrin 1は、E10.5などでは腹側正中部に発現するが、その後E12.5では脊髄背側部でDRG線維の進入領域近傍で一過性に発現がみられる。E13.5ではふたたび発現が弱くなる。
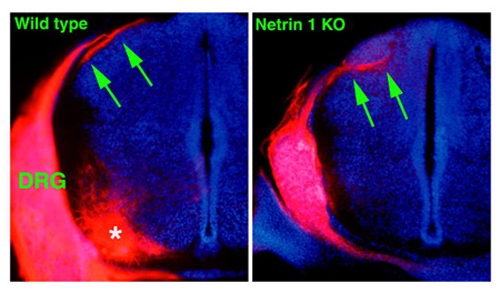
図4
DiI標識によるDRG線維の脊髄内での走行。野生型では、脊髄背外側部にDRG線維による後索の形成がみられる。一方、Netrin 1欠損マウスでは正常な領域に後索を形成することなしに直接mantle layer(将来の灰白質)に侵入する。
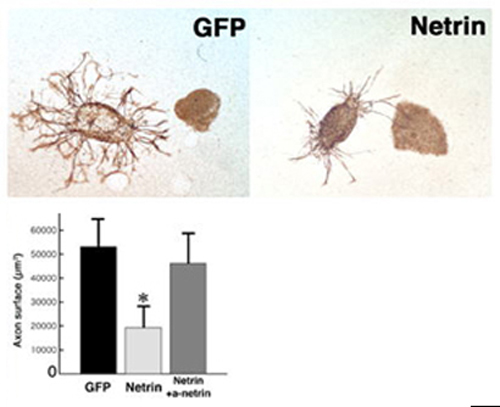
図5
DRG線維の伸長に対するNetrin 1の作用。DRGを、Netrin 1を発現させたBHK細胞とコラゲン内で共培養すると、軸索伸長が抑制される。これに抗Netrin 1抗体をくわえるとこの抑制効果は中和され、control(GFP発現細胞との共培養)と同じ程度の軸索伸長が見られる。
