研究報告
網膜剥離により視細胞死が誘導される分子機構
【はじめに】
本研究では、体温下での細胞膨化がTRPV4異常活性化を引き起こし、網膜剥離病態を悪化させることを見いだした。通常時には、恒温動物が有する“体温が一定”という特殊な性質によるTRPV4活性化を用い高度な視覚情報処理を可能にしているが、網膜剥離時にはこの性質が病態悪化に働いてしまうことを解明した。【研究の背景】
網膜剥離は強度の近視や糖尿病、ボクサーのように眼に強い刺激を受けることにより発症する。年間1万人に1人が発症すると考えられており、誰もが患者になる可能性がある失明を伴う重篤な疾患である。しかしながら、どのような分子メカニズムで病態悪化が進行するのかよく分かっていなかった。【研究成果】
網膜剥離時の細胞の変化に注目。実験動物であるマウスに網膜剥離を起こした場合、網膜内のミュラーグリア細胞が著しく膨れることを見いだした(図右側の緑色の細胞)。ミュラーグリア細胞は、TRPV4という体温と細胞の伸び具合の両方を感知するイオンチャネルを持っている。そして、正常な網膜内では、このTRPV4を用いて網膜内への栄養供給や老廃物除去を行っている。ところが、網膜剥離が起った場合には、このミュラーグリア細胞が著しく膨らんでしまうため、TRPV4がその異常な膨らみ具合をも感知し、異常に活性化することを見いだした(図右側のTRPV4)。特に、体温下だからこそ、細胞浮腫によるTRPV4異常活性化が生じることを明らかにした。その結果、このTRPV4から大量のカルシウムイオン(Ca2+)が流入してしまう。これが炎症性物質・MCP-1の放出を引き起こすことも突き止めた。そして、このMCP-1が本来は存在しないマクロファージを網膜付近へと引き寄せてしまう。最終的には、この大量のマクロファージが視細胞(視覚情報処理に必須の細胞)を次々と殺して網膜組織を破壊してしまうことを突き止めた(図)。さらに、ミュラーグリア細胞特異的TRPV4遺伝子欠損マウスを作製し、この動物に網膜剥離を引き起こした場合には、視細胞死がほとんど起らないことを証明した。そして、正常マウスでは、網膜剥離時にTRPV4阻害薬を投与しておけば、視細胞死を防ぐことが出来ることも突き止めた。
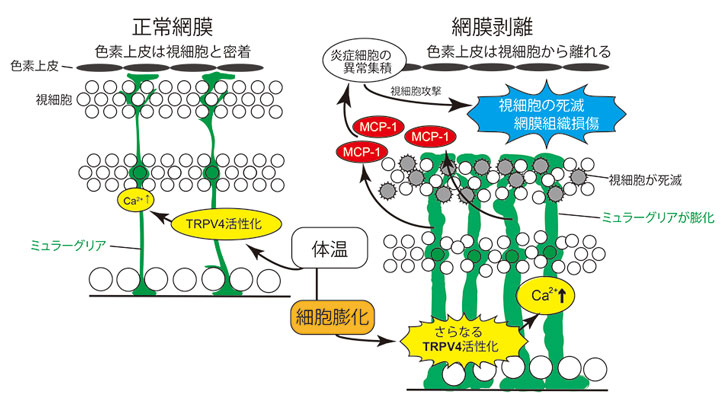
【研究の意義・今後の展望】
今回の研究で、網膜組織がダメージを受ける一連のメカニズムを明らかにした。そして、TRPV4の働きをブロックする薬剤を用いることで有効な治療法が確立出来ることが立証された。現在、網膜剥離と診断された後に手術を待っている間にも病態は悪化してしまう。患者さんが手術を受けるまでの間、TRPV4阻害薬を投薬して視細胞死を防ぐことが出来れば、臨床現場で大きな助けになる。今後はそのような視点での臨床研究を進めていく。温度センサーのマルチ機能という視点からさらに研究を発展させ、臨床応用に結びつくより多くの温度生物学的成果をあげたいと考えている。発表論文
Matsumoto H, Sugio S, Seghers F, Krizaj D, Akiyama H, Ishizaki Y, Gailly P, *Shibasaki KRetinal detachment-induced Müller glial cell swelling activates TRPV4 ion channels and triggers photoreceptor death at body temperature.
Journal of Neuroscienceオンライン掲載(冊子体は2018年12月21日に発刊)*責任著者
http://www.jneurosci.org/content/early/2018/08/24/JNEUROSCI.0897-18.2018


