JSTの目的基礎研究事業および文部科学省・脳科学研究戦略推進プログラムの一環として、(財)実験動物中央研究所の佐々木えりか室長と慶應義塾大学医学部の岡野栄之教授らは、霊長類であるコモンマーモセットで遺伝子改変動物を作り出すことに成功しました。遺伝子が導入された第一世代だけではなく、第二世代でも導入遺伝子の発現が認められており、
次世代まで導入遺伝子が受け継がれた霊長類の作出は世界で初めてです。
これまでマウスやラットなどの遺伝子改変動物
注1)はライフサイエンス研究に貢献してきましたが、ヒト疾患の実験研究のためにはげっ歯類よりは格段にヒトと機能的・解剖学的に類似している霊長類による動物実験が求められてきました。実験動物中央研究所では1970年代からこの課題に取り組み、1980年には霊長類のうちでもっとも小型で、かつ繁殖力の高いコモンマーモセットを規格化された実験動物として確立することに成功し、現在まで実験動物としての計画繁殖を継続しています。岡野教授ら慶應義塾大学 医学部の研究グループは、そのマーモセットを使用して動物実験を進め、脊髄損傷などを再生する治療法に大きな成果をあげてきました。また、佐々木室長らは岡野教授らとの共同研究を行い、ヒト疾患モデル動物の開発・研究を大きく進展させ、今回の成功に至りました。
今回の遺伝子改変霊長類では、マーモセットの体外で、マーモセット胚に、ウイルスベクター
注2)を用いて外来遺伝子である緑色蛍光たんぱく質(GFP)をコードする遺伝子を導入しました。その胚を仮親マーモセットの胎内へ戻して妊娠を成立させたところ、4匹の仮親から5匹の子が出産に至り、全てが遺伝子改変マーモセットでした。しかもこの5匹のうち2匹の生殖細胞に導入遺伝子が組み込まれていることが確認され、この1匹から第二世代のGFPが組み込まれたマーモセットが得られました。
今後、この遺伝子改変技術を用いてヒトのパーキンソン病や筋委縮性側索硬化症(ALS)、などの神経難病のモデルマーモセットを作り出し、これを用いることによって前臨床研究が大きく前進するものと期待されます。
本研究成果は、2009年5月28日(英国時間)発行の英国科学雑誌「Nature」に掲載されています。
本成果は、主に以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 発展研究(SORST)
研究課題名:「内在性神経幹細胞活性化による神経再生戦略」
研究代表者:岡野 栄之(慶應義塾大学 医学部 生理学教室 教授)
研究期間:平成17年11月~平成22年10月
上記研究課題では、①幹細胞の自己複製と活性化、②中間的前駆細胞の増殖とニューロブラストの移動の調整、③新生ニューロンのシナプス形成と成熟の解明、 の3つのステップの統合的理解、そのための可視化技術の開発と、遺伝学的・発生工学的研究手法の開発を含めた霊長類モデルの構築による再生医学への応用促 進を目指しています。 |
<研究の背景と経緯>遺伝子改変マウスは、遺伝子機能の解析や、さまざまな疾患の病態の分子機構解明などライフサイエンス研究分野に多くの貢献をしてきました。しかし、マウスとヒトは系統学的に離れているため、生理学的、解剖学的、組織学的に違いが多く、マウスで得られた研究結果を直接ヒトに当てはめることができない場合も多くあります。このような背景から、マウスよりも機能的、解剖学的にヒトに近い霊長類の実験動物を用いた研究が必要となっています。ところが、これまで霊長類では遺伝子改変動物の作出は成功せず、得られた遺伝子改変霊長類の体細胞における導入外来遺伝子の発現が科学的に証明されたことはありませんでした。さらに、これらの遺伝子改変霊長類の外来遺伝子の生殖細胞への伝達の研究報告はなく、遺伝子改変霊長類を使ったライフサイエンス研究を行うことは不可能でした。
そこで(財)実験動物中央研究所の佐々木 えりか 室長と慶應義塾大学の岡野 栄之 教授らの研究グループは、マウスと同様にこれらの研究を行うことを可能にする遺伝子改変霊長類の作出法を研究し、その確立に成功しました。
<研究の内容>本研究グループは、(財)実験動物中央研究所の野村達次所長が長年かけて本格的な実験動物として作り上げた霊長類の中で唯一、遺伝子の均質化、品質の規格化に成功した高い繁殖能力を持つコモンマーモセットを用いて、初めて遺伝子改変マーモセット5匹を作出。さらに
導入した外来遺伝子が次世代へも伝達することを霊長類では世界で初めて明らかにしました。この遺伝子改変マーモセットの作出では、前核期から桑実胚期の受精卵をスクロース-PB1培地
注3)に懸濁(けんだく)することにより、広がった囲卵腔へウイルスベクターを注入してGFPをコードする遺伝子を導入しました(図1a)。遺伝子を導入した受精卵は、数日間培養を行い、GFPを発現した受精卵だけを選んでマーモセットの仮親の子宮へ移植しました(図1b)。この方法により、生まれてきた5匹のマーモセット全てが遺伝子改変マーモセットであること(図2)、そのうち4匹は、さまざまな体細胞で外来遺伝子が発現していることが確認されました。5匹のうち性成熟に達した2匹の精子と卵子を調べたところ、外来遺伝子が生殖細胞へも組み込まれていることが確認されました。さらにこの精子と野生型のマーモセットの卵子とを体外受精させた結果、GFPを発現する健康な子供が生まれました(図3)。
スクロース-PB1培地を用いてより多くのウイルスベクターを囲卵腔へ注入したこと、GFPを発現している受精卵を選択して移植したことにより、産まれた子が100%遺伝子改変マーモセットであるという効率的な遺伝子改変マーモセットの作出を可能にしたうえ、体細胞と生殖細胞で外来遺伝子が発現する遺伝子改変マーモセットの作出につながりました。
さらにライフサイエンス研究に使用されている数多くの霊長類の中から性成熟までの期間が比較的短く、繁殖効率が高く、実験動物として確立されたマーモセットを選択したことにより、約1年半という短い期間で第二世代の遺伝子改変マーモセットを得ることにも成功しました。
<今後の展開>本研究グループはこれまで、神経幹細胞の自己複製と分化・増殖およびそこから生まれる幼弱ニューロンの移動のメカニズムに関する新たな知見を得るとともに、コモンマーモセットの発生工学における基礎的技術を確立してきました。確立した研究の基盤と知見を総動員したこの発展的研究により今回、遺伝子改変マーモセットの作出に成功しました。
作り出した遺伝子改変マーモセットの子供も遺伝子改変動物であったこと、マーモセットが高い繁殖能力を持つことなどから、ヒトに近い遺伝子改変霊長類を複数匹揃え、繰り返しの実験を行うことが可能となり、より精度の高い研究が可能となります。今後は、遺伝子改変霊長類を用いてパーキンソン病やALSといった難病の治療法開発研究などへの貢献が期待されます。また、今回作出した遺伝子改変マーモセットもGFPを発現しているため、さまざまな細胞、臓器移植研究にも役立てられます。
本研究成果は、日本の脳科学や再生医学研究を次のステージへと進めることができるものと確信しています。
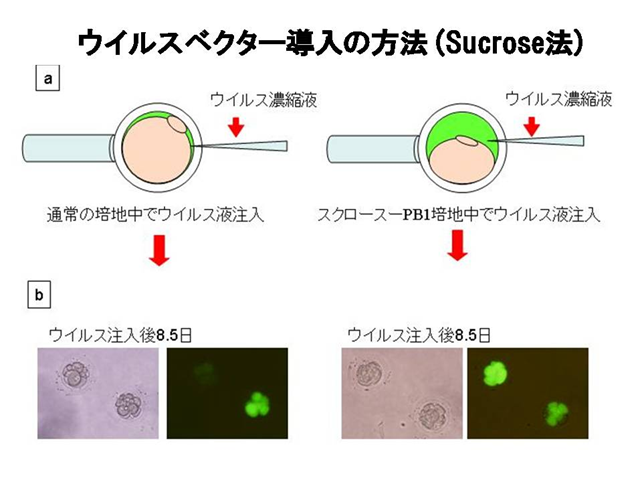
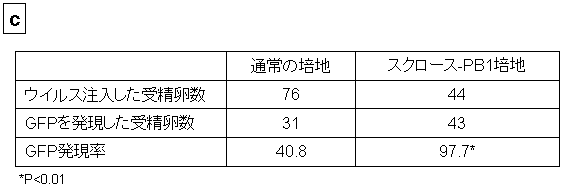
図1 Sucrose法によるウイルスベクター導入と導入遺伝子の発現効率
スクロース-PB1培地を用いた受精卵へのウイルスベクター導入(sucrose法)を模式化した図(a)
高張液のスクロース-PB1培地に受精卵を入れると受精卵が脱水により収縮し、透明帯との間に間隙ができる。この間隙にウイルスベクターを注入すると、より多くのウイルスベクターを受精卵の囲卵腔に注入することが可能となった。この方法により、導入遺伝子であるGFPが効率良く導入され発現する(b、c)。
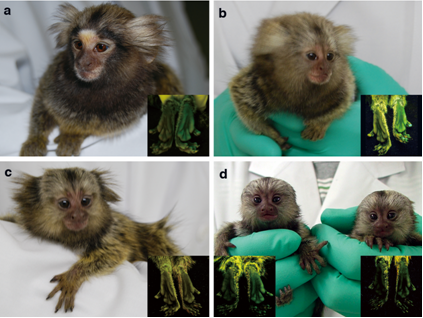
図2 生まれた5匹の遺伝子改変マーモセット
a:翡翠、b:わかば、c:ばん子、d:左から蛍、光と名付けられました。UV光の元で観察すると足の裏などの皮膚が緑色に発光していることが分かります(各写真内のボックス、ボックス内の左足は野生型のマーモセットのもの)。
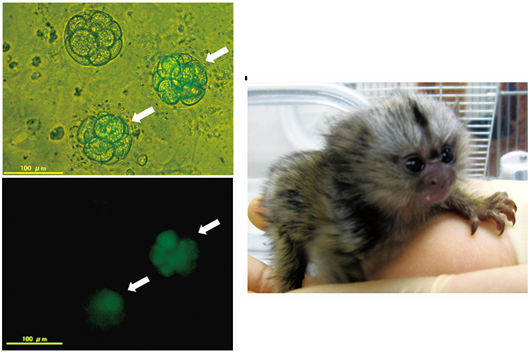
図3 第二世代の遺伝子改変マーモセット
性成熟に達した雄の遺伝子改変マーモセット(光)の精子を野生型のマーモセットの卵子に体外受精させると、受精卵が緑色蛍光を発しました(写真左)。これらの受精卵を仮親の子宮に戻すことにより、第二世代の遺伝子改変マーモセットが得られ、光一と名付けられました(写真右)。

図4 Natureの表紙をトランスジェニック・マーモセットが飾る
「Nature 2009年5月28日号表紙(Nature提供)」
Natureの表紙にトランスジェニック・マーモセットの写真が選ばれました。次世代へ導入遺伝子が伝達した遺伝子改変マーモセットが重要であると認識されています。
<用語解説>注1)遺伝子改変動物
目的とする機能を持つ外来遺伝子を導入したり、内在遺伝子を破壊したりすることなどにより、遺伝子機能の解明を可能にした動物。
注2)ウイルスベクター
ウイルス自身が持つ病原性が発現しないようにウイルス遺伝子の一部を欠損させたウイルス遺伝子に、目的の遺伝子を組み込んだ組換えウイルスを用いて、標的の細胞などに遺伝子を導入する方法。ウイルスが宿主に感染する際に、宿主の染色体にウイルス遺伝子を組み込む性質を利用したもの。
注3)スクロース-PB1培地
0.25Mのスクロース(糖類)を添加した培地。受精卵に対して高張液になるため、スクロースPB1液の中に受精卵を入れると脱水し受精卵が縮む。今回の研究では、スクロースPB1液のこの性質を利用して、受精卵が縮むと受精卵を包んでいる透明体と呼ばれる膜との隙間が広がるので、ここにウイルスベクターを注入した。
<論文名>“Generation of transgenic nonhuman primates with germline transmission“
(次世代への遺伝子伝達を伴った遺伝子改変非ヒト霊長類の作出)


 科学技術振興機構(JST)
科学技術振興機構(JST)



